Genome Med:首次揭示DNA去甲基化可促进结直肠癌细胞释放cfDNA,或可提高液体活检的灵敏度
2024-10-28 测序中国 测序中国 发表于上海
本研究利用结直肠癌细胞系,发现癌细胞 DNA 低甲基化与 cfDNA 释放正相关,确定甲基化特征可预测 cfDNA 释放,证实去甲基化促进 cfDNA 释放,为理解机制及提高液体活检灵敏度提供见解。
基于细胞游离DNA(cfDNA)分析的液体活检作为一种微创方法,在实体恶性肿瘤的诊断、基因分型和监测方面具有重要应用前景。肿瘤通过细胞死亡、主动和被动释放等在血液中释放cfDNA,但导致cfDNA释放的确切机制尚未完全明了。直接利用癌症患者样本解决该问题受到多种混杂因素的干扰,如肿瘤负荷程度、解剖和血管屏障以及正常细胞释放核酸等。
基于此,意大利Candiolo癌症研究所团队及合作者假设只有已知数量的肿瘤细胞存在的临床前癌症模型系统可以简化功能研究,利用结直肠癌(CRC)细胞系表征了癌细胞生物学参数和分子特征对cfDNA释放机制的影响,发现癌细胞的DNA低甲基化水平与cfDNA水平增加呈正相关。通过甲基化微阵列技术,研究识别出与cfDNA释放显著相关的探针子集,得到了可区分cfDNA高、低释放量的甲基化特征,并在独立的CRC细胞系和患者来源类器官中验证了该特征,基因敲除DNA甲基转移酶或使用去甲基化药物可增加cfDNA释放。该研究证实了癌细胞系的甲基化状态影响体外cfDNA释放的变异性,有助于提高液体活检的灵敏度。该研究以“DNA demethylation triggers cell free DNA release in colorectal cancer cells”为题发表在Genome Medicine上。

文章发表在Genome Medicine
cfDNA释放存在细胞间变异性
为了确定与cfDNA释放相关的癌细胞内在特征,研究团队利用240个CRC细胞系,筛选了76个CRC模型,代表临床样本中出现的主要分子亚型。如图1所示,在标准化时间点评估cfDNA释放,上清液中的原始cfDNA值通过实验结束时的细胞数量进行归一化,以考虑具有不同增殖动力学的样本。结果显示,培养中CRC细胞释放的cfDNA具有广泛的动态范围(7.8-540.8 ng/μL)。对具有代表性的8个CRC细胞系的细胞内DNA和上清液cfDNA进行全基因组测序,发现上清液cfDNA样本与其匹配的核DNA样本之间的相似性超过95%;细胞内DNA和上清液cfDNA的reads 分别有99.67% - 99.99%与染色体DNA一致。在分析的一小部分细胞系中,线粒体DNAreads仅占细胞内DNA的0.220%和上清液DNA的0.012%。因此,线粒体DNA对cfDNA总量的贡献可忽略不计。
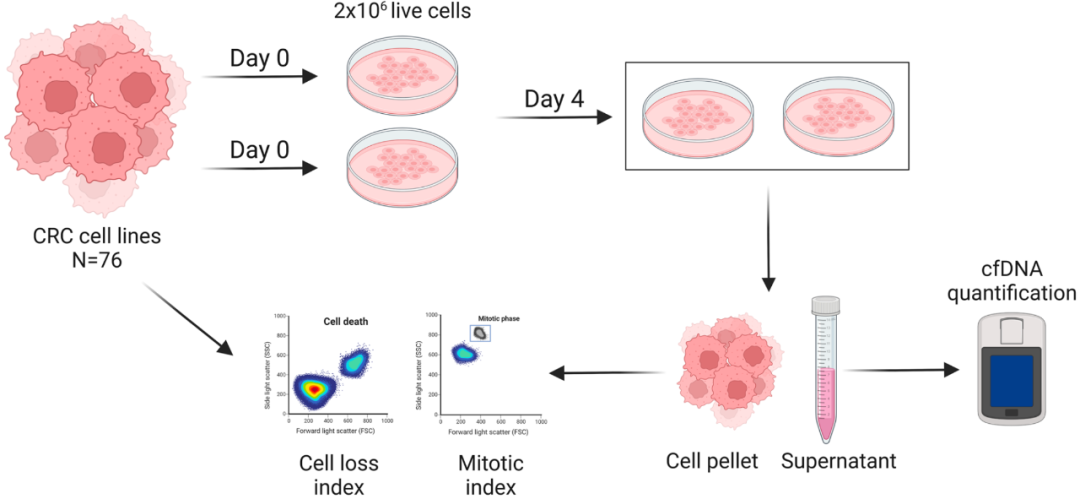
图1. cfDNA释放检测方案的工作流程
cfDNA释放受细胞增殖和细胞死亡相关参数的影响
研究发现细胞增殖最慢的细胞释放出更多的DNA,这体现在细胞倍增时间与cfDNA数量之间的相关性上。为证实这一发现,研究人员分析了细胞周期的不同阶段,发现cfDNA水平与处于2N期的细胞百分比显著负相关,与处于S期、4N期和有丝分裂(M)期的细胞百分比正相关。此外,研究人员进一步评估了上清液中导致cfDNA释放的凋亡和/或坏死细胞的数量来计算细胞损失指数,与预期一致,细胞损失指数与 cfDNA数量显著相关(图 2A)。以上结果表明,较高水平的cfDNA释放与细胞增殖变慢和细胞死亡增加有关。
cfDNA释放与CRC分子特征有关
研究团队探究了cfDNA释放值与分子特征(如MSI表型、非整倍体评分和甲基化分类(CIMP))之间的相关性,发现MSI表型与CRC细胞系中cfDNA释放呈负相关,释放更多cfDNA的细胞有非整倍体评分增加的趋势。研究团队通过对细胞系进行分类探究了表观基因型的影响,发现CIMP阳性细胞比CIMP阴性细胞释放更少的cfDNA(图 2B)。以上结果表明,由高甲基化水平和正常倍型定义的表型会释放较少的cfDNA,由低甲基化引起的染色体不稳定的表型可能导致更高的cfDNA释放。
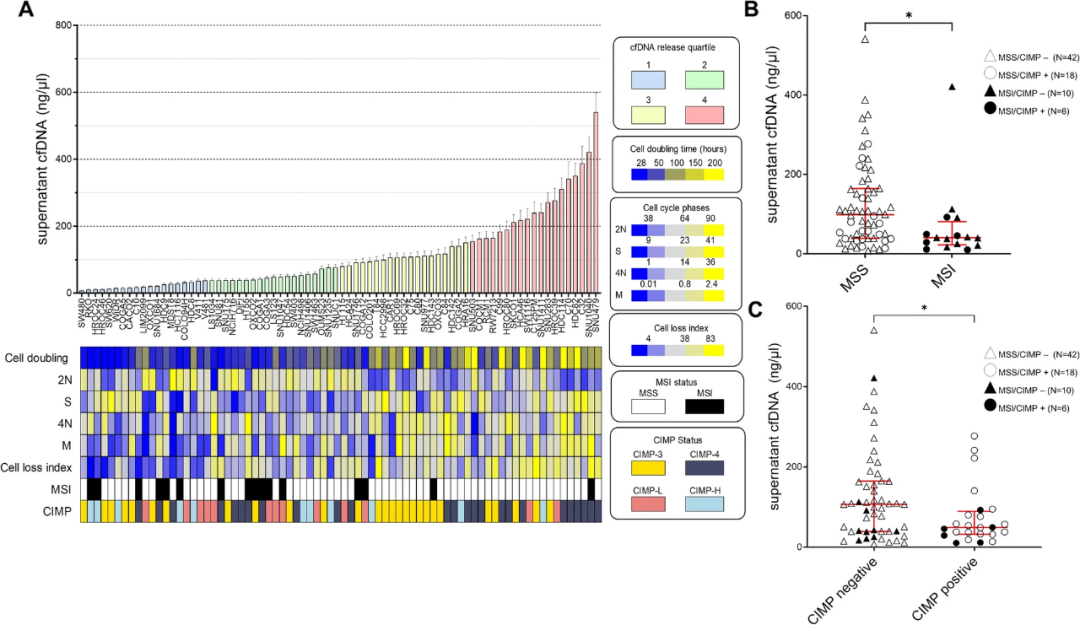
图2. CRC细胞系cfDNA释放与生物学参数和分子特征的关系
预测CRC细胞系cfDNA释放的甲基化标记
研究团队进一步探究了DNA甲基化图谱对cfDNA释放的影响。使用甲基化微阵列探针进行线性回归建模,通过cfDNA值的四分位数对先前筛选的76个细胞系进行分层,共确定了与cfDNA释放显著相关的145个差异甲基化探针。在这145个位点具有较高甲基化水平的细胞显示出较低的cfDNA释放,并且该特征可区分高释放量和低释放量样本(图3A)。将这一甲基化特征应用于预测独立收集的164个CRC细胞系和12个CRC患者衍生类器官(PDO)中的cfDNA释放(图3B),分别有79个和97个CRC模型被预测为低释放量和高释放量,预测为低释放量样本在CIMP高和MSI状态中高度富集。研究人员从临床前模型的验证集合中选择了12个预测为高释放量或低释放量的CRC细胞系,其中8个为原代细胞系,通过前述实验流程检测上清液中的cfDNA,再次验证细胞系之间cfDNA量存在巨大差异(图3C),且预测为低释放量的细胞系和类器官确实表现出cfDNA释放减少(图3D)。
为了对cfDNA测量进行体内验证并提高工作的临床相关性,研究人员分析了先前收集的490例CRC患者来源的异种移植模型(PDXs)的甲基化图谱。当甲基化特征应用于PDXs时,MSI病例聚集在预测为低cfDNA释放样本组(图3E),且CIMP高的肿瘤在预测为低cfDNA释放样本中富集。
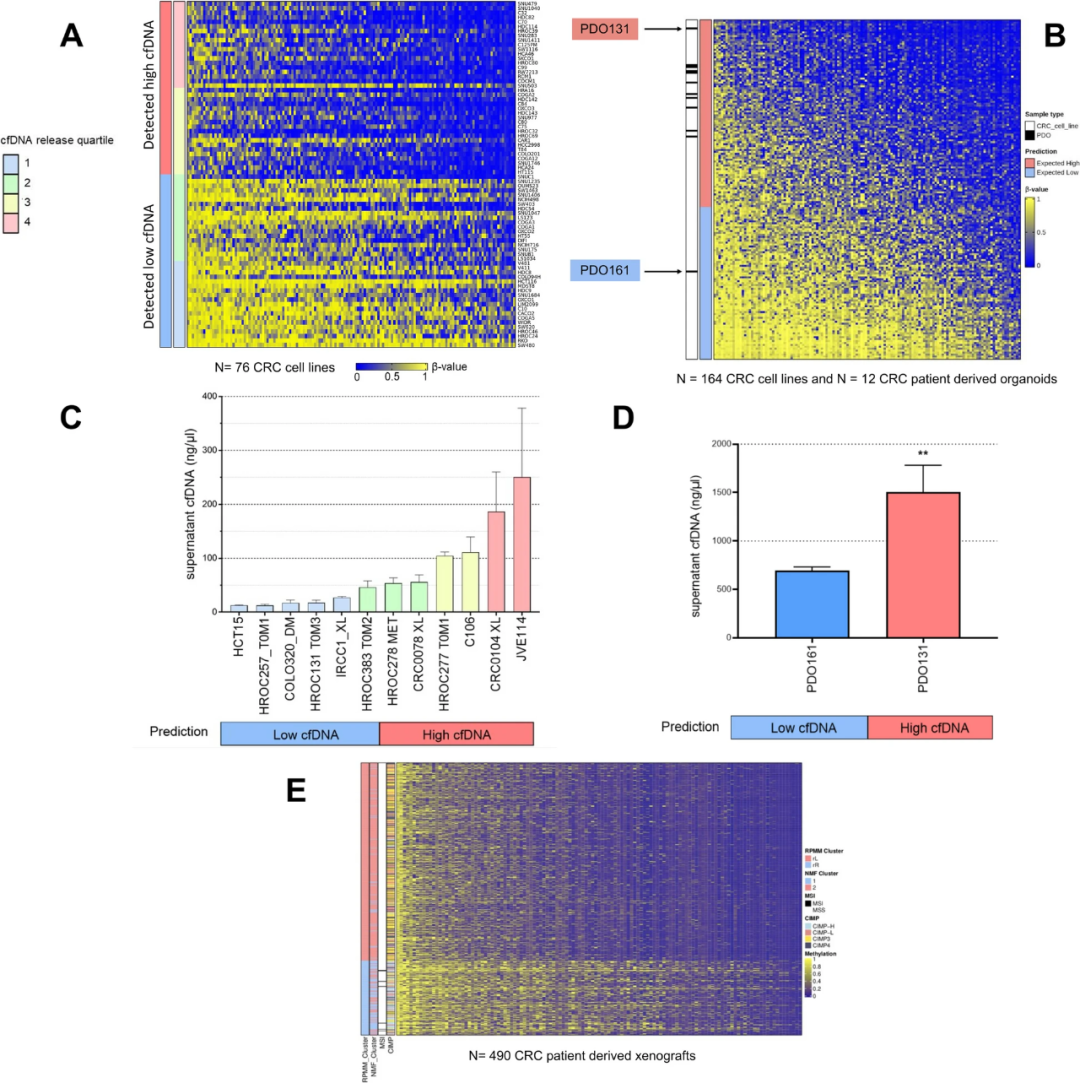
图3.在CRC细胞系、患者衍生类器官和患者衍生异种移植瘤中,推导并验证预测cfDNA释放的甲基化特征。
DNA甲基化促进cfDNA释放
上述数据表明,DNA甲基化状态与cfDNA释放之间存在关联。研究团队通过两种功能性方法研究了DNA甲基化对cfDNA释放的影响:一是利用HCT116 DNMT1/DNMT3B敲除(HCT116 DKO)细胞系,该细胞系缺乏建立和维持甲基化模式的酶,导致基因组几乎完全去甲基化,发现其比亲代细胞系释放更多cfDNA(图 4A);二是利用去甲基化剂地西他滨以1nM的浓度处理五种低释放模型,发现所有测试细胞系及四种胰腺癌细胞系中cfDNA的释放量显著增加(图 4B)。该结果表明,甲基化模式的整体变化可以促进cfDNA的释放,这一效应在CRC和胰腺癌模型中均有所体现。
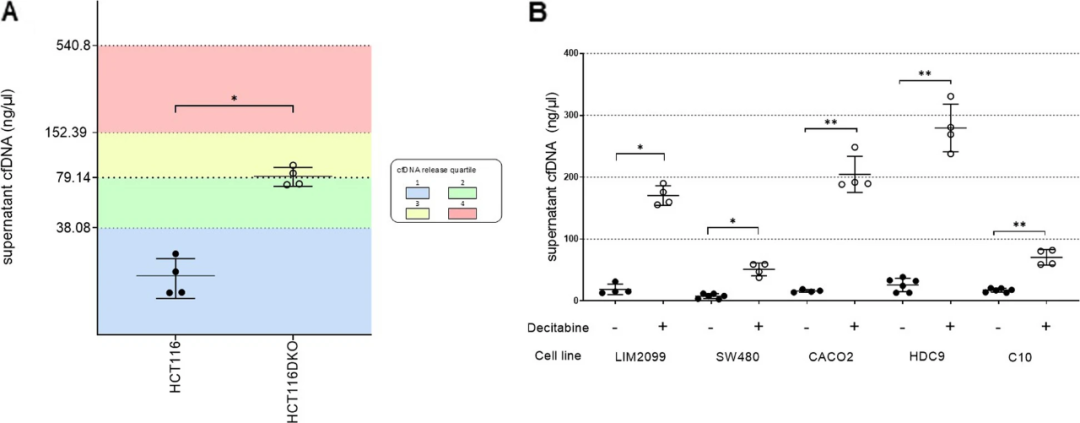
图4. DNA甲基化的遗传或药理学耗竭促进cfDNA释放。
cfDNA的释放与染色质可及性和片段化增加有关
最后,研究团队使用ATAC-seq和RNA-seq分别分析了HCT116 DKO细胞与其亲代细胞(HCT116 WT)的染色质可及性及基因差异表达情况。结果显示,DKO细胞中有10551个染色质可及性增加事件,且可观察到全基因组的染色质可及性重构;相比之下,WT细胞中仅有4470个区域的可及性(图 5A)。RNA-seq分析揭示在等基因对之间共有4455个差异表达的基因。与WT细胞相比,DKO细胞中有1676个基因下调,2779个基因上调,其中373个上调基因在其启动子中表现出染色质可及性增加(图 5B)。此外,研究人员还分析了与差异可及染色质区域相关的DNA片段化模式。相比于WT细胞,HCT116 DKO细胞中的细胞内DNA短片段显著富集(图 5C),推测在核小体可及性较高的区域,特定的核酸酶可能更容易切割核小体内的DNA。
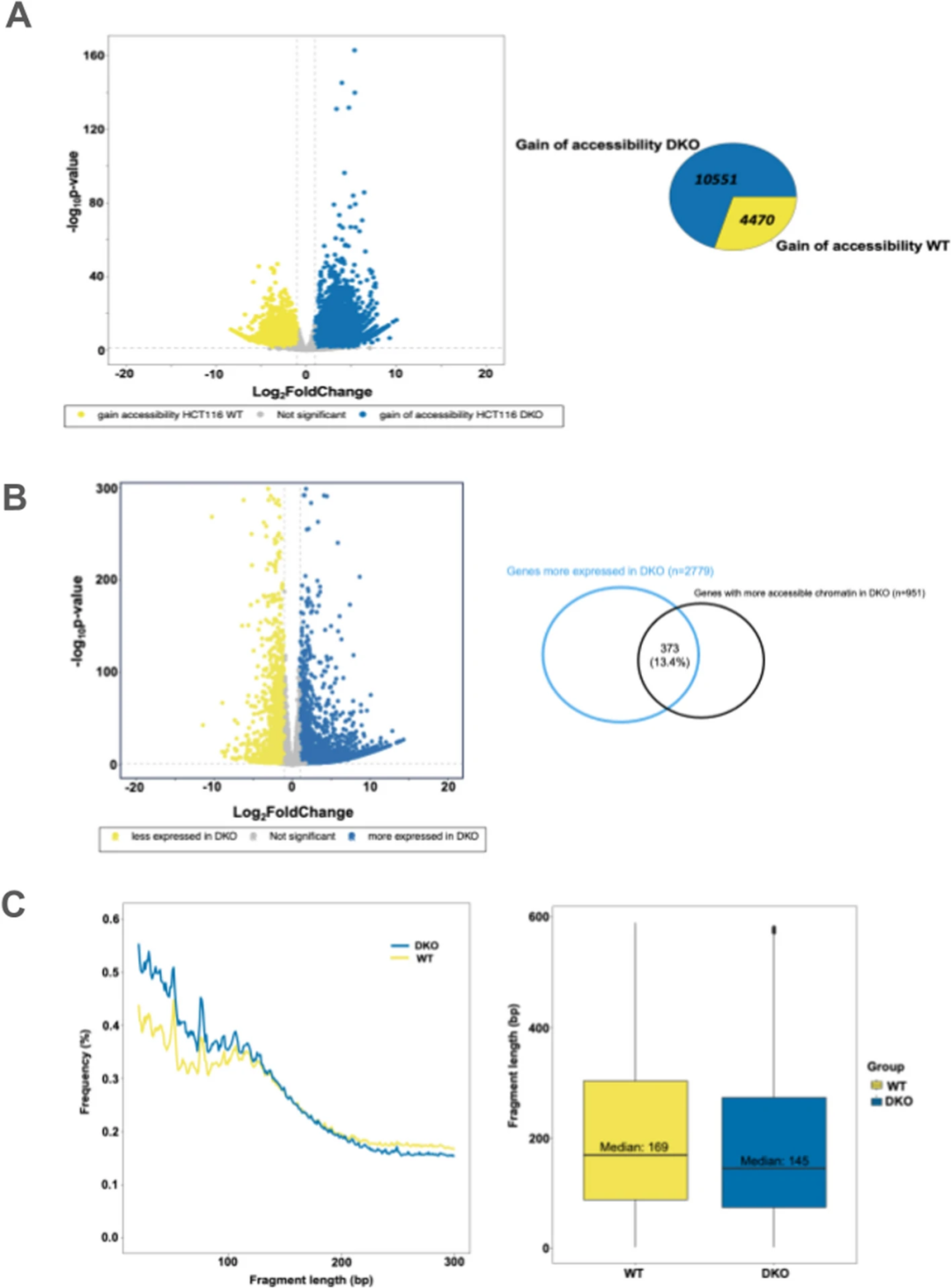
图5. cfDNA释放与染色质可及性的关系。
综上所述,该研究首次在CRC临床前模型的大型数据集中剖析了cfDNA的释放情况,发现癌细胞DNA甲基化状态与cfDNA释放相关,DNA去甲基化可促进cfDNA释放,且与染色质可及性和碎片化增加有关。这些结果为理解cfDNA释放机制提供了新见解,可能有助于提高液体活检的灵敏度。
此外,该研究未考虑肿瘤微环境的影响,癌细胞与成纤维细胞、内皮细胞及免疫细胞的相互作用可能会影响cfDNA的释放;体外研究缺乏人体特有的血管屏障、血液供应和清除。未来的研究可考虑以上局限性,以全面理解cfDNA的释放机制。
论文原文:
Pessei V, Macagno M, Mariella E, et al. DNA demethylation triggers cell free DNA release in colorectal cancer cells. Genome Med. 2024 Oct 9;16(1):118. doi: 10.1186/s13073-024-01386-5. PMID: 39385243; PMCID: PMC11462661.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#结直肠癌# #cfDNA# #DNA甲基化# #液体活检#
10