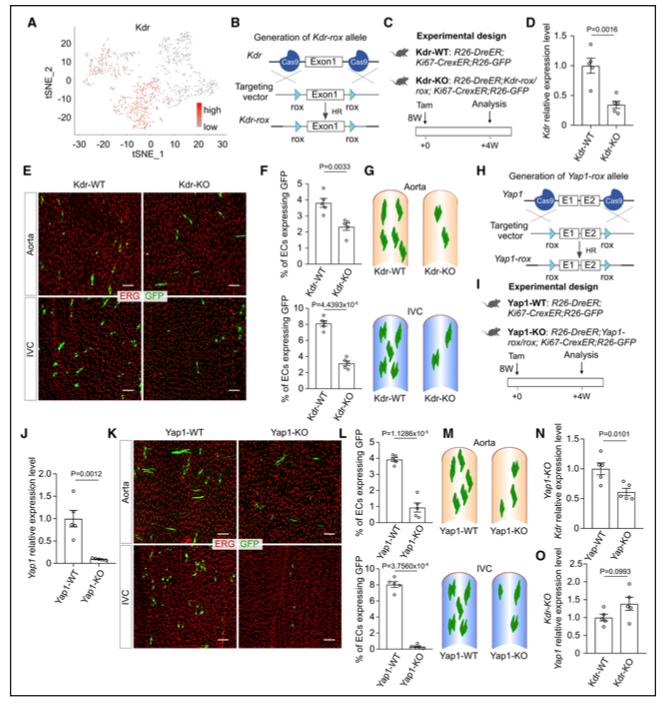
CIRCULATION:稳态和疾病期间动脉内皮细胞生成和周转的动态
2023-12-15 Jenny Ou MedSci原创 发表于上海
遗传扩散追踪定量描绘了稳态和疾病期间大型血管中EC产生和周转以及EC分裂方向的动态。主动脉中的EC亚群在稳态和2型糖尿病期间表现出更强劲的细胞增殖,将其确定为血管修复和再生的潜在治疗靶点。
严重的内皮细胞(EC)损伤和丧失可导致多种心血管疾病,如动脉粥样硬化、高血压和严重的肢体缺血 糖尿病引起的贫血。新一代EC,通过两者内皮祖细胞的增殖或分化为细胞(EPCs)提供了促进血管修复和组织再生。在90年代,EPCs首次从人外周血中分离出来,并提出在体外分化为ECs然而。最近的一项研究报道骨髓不是循环EPCs的起源,表明endoge-神经新生血管是由组织内的内皮细胞驱动的,而不是通过循环的贡献。
尽管有报道称,成年小鼠心肌梗死后,间充质细胞或成纤维细胞参与了内皮细胞的形成,但一项使用特定遗传工具的研究同样表明,间充质细胞几乎不参与内皮细胞的形成,而新生血管的形成主要是由先前存在的内皮细胞的增殖介导的因此,在血管修复和新血管形成过程中,组织内内皮细胞的增殖是新内皮细胞生成的主要途径。
尽管EC的增殖是为了补偿它们在日常磨损中的损伤和损失,但由于不同EC亚群之间基因表达和功能的异质性,它们的代数并不相等。近半个世纪前,一项开创性的研究使用甲基- 3h胸腺嘧啶检测了内皮细胞在稳态期间增殖的EC克隆或复制的EC聚集,并最早提出了EC在主动脉增殖和转换方面的异质性。
最近的谱系追踪研究再次证实,内皮细胞的克隆扩增有助于损伤后血管的修复和再生。体外细胞集落形成实验、细胞移植和遗传谱系追踪研究表明,侧群细胞10 c-kit、11 Procr、12 Peg3/Pw1、13 CD157、14 SoxF、15或Sca1、16代表或标记了在培养或损伤后优先扩增的组织常驻EPCs。
单细胞转录组学分析揭示了主动脉中几个功能不同的EC亚群,并确定了从血管内祖细胞到分化的EC的层次结构。除了基础稳态外,运动诱导的血管生成主要依赖于代谢引发的ATF3/4+ EC亚群的增殖这些研究为内皮细胞在基因表达、细胞增殖和不同功能方面的异质性提供了重要信息。
然而,由于动脉等大血管的增殖率较低,目前对其生成动力学的评估具有挑战性。由于缺乏对泛EC增殖记录的公正的遗传方法,而不是追踪一个选择的EC亚群,在稳态和疾病期间动脉中EC转换动力学的基本信息是缺失的。
血液流动的机械力是影响血管形态发生、发育和维持血管正常功能的关键因素EC的伸长和重新定向通常与血流引起的剪切应力方向平行。剪切应力也会引起体外血管EC的增殖尽管体外系统可以模拟不同类型的剪切应力,但EC增殖如何受到体内复杂环境和血流模式的影响尚不清楚。
此外,细胞分裂方向在细胞命运、组织模式和组织以及形态发生中起着重要作用。增殖的内皮细胞的重排为血管组织和形态提供了基础,并影响血管生成。机械力调节细胞分裂方向。然而,血流剪切应力作为一种机械力,是否会影响EC在体内的增殖和成体组织中的细胞重排,目前还不完全清楚。

迄今为止,Ki67在细胞周期的所有活跃阶段表达,在静止细胞中不存在,是最广泛使用的增殖标记物,并已被用于生成几种小鼠遗传工具,用于体内细胞增殖追踪。2023年12月12日发表在CIRCULATION的文章,使用内源性ki67基因生成遗传增殖示踪剂(ProTracer) 34-36来研究EC在主动脉和下腔静脉(IVC)中随时间的体内增殖。
通过使用基于Cre-loxP和Dre-rox的双重组系统,我们开发了一个遗传系统,用于暂时无缝记录体内EC增殖。我们将EC增殖的遗传记录与单细胞RNA测序和基因敲除相结合,以揭示动态平衡和疾病期间动脉中EC生成的细胞和分子机制。
研究结果显示,遗传增殖跟踪显示,成年小鼠在稳态期间每月有≈3%的主动脉EC会进行增殖。主动脉EC分裂的方向通常与主动脉血流平行,主动脉血流由机械传感器蛋白Piezo1调节。单细胞RNA测序分析揭示了4个具有不同增殖活性的异质主动脉EC亚群。
河马/血管内皮生长因子信号调节EC增殖
EC集群1表现出具有优先增殖能力和Sca1和Sox18等干细胞标记的丰富表达的过境放大细胞特征。EC增殖在高血压中增加,但在2型糖尿病中减少,这与EC集群1增殖程度的变化相吻合。基因敲除和增殖跟踪相结合显示,河马/血管内皮生长因子受体2信号通路调节大血管中的EC增殖。
本研究结果表明,在体内平衡状态下,成年小鼠每月约有3%的主动脉内皮细胞发生增殖。结合EC增殖追踪和单细胞RNA测序(scRNA-seq)分析,在成年小鼠主动脉中发现了一个高度增殖的EC亚群,该亚群富含干细胞基因Sca1和Sox18的表达。
这种EC亚群在2型糖尿病中优先扩大,但在高血压中没有,在疾病条件下增殖率发生改变。此外,通过将drerox介导的基因敲除与ProTracer同时结合,发现EC在主动脉和IVC中的增殖受Hippo/血管内皮生长因子受体2信号通路的调控。
综上所述,本文使用ProTracer研究小鼠主动脉和IVC中的EC增殖。细胞促进生命的遗传记录显示,成年小鼠的EC周转率约为每月3%。使用scRNA-seq分析,发现主动脉EC由4个具有不同基因表达谱的亚群组成,其中EC-1集群的增殖能力最高。该亚种群的血统追踪表明了其在稳态期间优先促进生命和扩张。
本研究还表明,血流剪切应力是调节EC增殖和EC原始分裂的重要机械力。在机械上,Yap-Kdr遗传轴调节主动脉和IVC的EC增殖和扩张。这些对EC周转动力学的关键见解以及识别具有增强增殖能力的EC亚群有助于推进我们对控制血管生物学基本过程的细胞和分子机电一体化的理解,并为血管再生提供新的治疗靶点。
原始出处
Li Y, Liu Z, Han X, Liang F, Zhang Q, Huang X, Shi X, Huo H, Han M, Liu X, Zhu H, He L, Shen L, Hu X, Wang J, Wang QD, Smart N, Zhou B, He B. Dynamics of Endothelial Cell Generation and Turnover in Arteries During Homeostasis and Diseases. Circulation. 2023 Dec 12. doi: 10.1161/CIRCULATIONAHA.123.064301.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













能把这篇文章的补充材料发出来吗?
46
#稳态# #动脉内皮细胞# #疾病期间#
93