Nat Commun:突触可塑性调节的新机制
2023-02-15 brainnew神内神外 brainnew神内神外 发表于安徽省
突触功能是学习和记忆的基础,其功能增强主要通过长时程增强(LTP),减弱则通过长时程抑制(LTD) 。
突触功能是学习和记忆的基础,其功能增强主要通过长时程增强(LTP),减弱则通过长时程抑制(LTD) 。
突触的长时程抑制(LTD)可以有多种形式,并有助于环路重建、记忆编码或擦除。LTD涵盖各种诱导途径,包括NMDA、mGlu或P2X受体的激活。
在CA1锥体神经元突触的Schaeffer侧枝上,这些LTD类型依赖的突触可塑性通常受到AMPA型谷氨酸受体数量和AMPAR的自由扩散和锚定在PSD上形成的膜平衡的调节。这种平衡涉及AMPAR相关蛋白和突触后支架蛋白(例如PSD-95)的结合。然而,目前研究很少涉及LTD引起的分子重组。
在此背景下,来自法国波尔多的神经科学研究所的研究人员于2021年5月14号在Nature Communications上发文,NMDAR依赖性LTD触发PSD-95的深刻重组,导致突触后膜变化,增加短期可塑性,从而改善抑制性突触的神经元反应。
 1.ATP和NMDA处理均可诱导突触AMPAR含量和微型振幅的长期下调
1.ATP和NMDA处理均可诱导突触AMPAR含量和微型振幅的长期下调
作者通过直接随机光学重建显微镜(dSTORM)实验和电生理记录大鼠原代海马神经元的ATP或NMDA处理后的AMPAR组织和电流,从膜表面的孤立受体中提取单个AMPAR的荧光发射特性,并用于估计不同神经元区室AMPAR的密度和数量。
NMDA处理后会导致树突轴和棘中AMPAR密度快速稳定降低。NMDAR依赖性LTD还与每个纳米域AMPAR含量的快速(在NMDA应用后的前10分钟内)和稳定(最多3小时)消耗有关。
AMPAR突触的这种重组与AMPAR介导的微小兴奋性突触后电流(mEPSC)的抑制有关,在NMDA处理后可以持续长达3小时。ATP处理AMPAR纳米级组织后能够诱导强大且持久的LTD,这种AMPAR纳米域的消耗与mEPSC振幅的稳定持久下降有关。
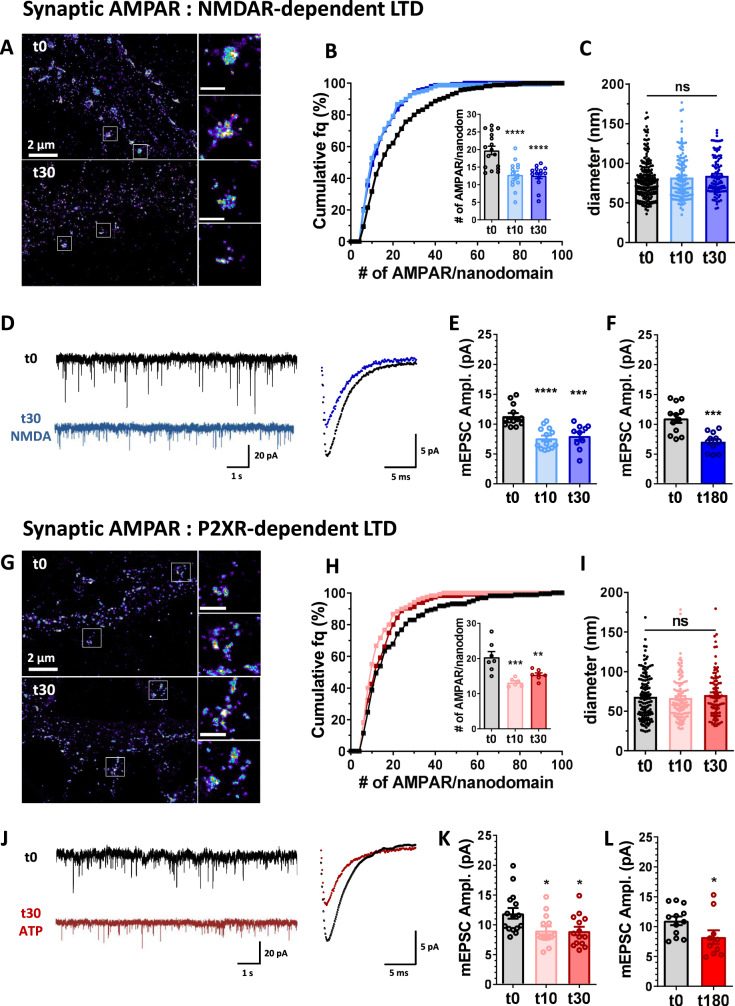
图1 NMDA和ATP应用在与长期突触电流抑制相关的突触处触发AMPAR快速持久的纳米级重组
2.AMPAR横向扩散在NMDAR依赖性LTD期间增加,但在P2XR依赖性LTD期间不增加
突触可塑性与AMPARs胞吞和胞吐作用都有关。AMPAR通过横向扩散从突触逃逸后,被突触前膜短暂内吞,从而诱导了NMDAR和P2XR 依赖性的LTD。
基于此,作者通过单粒子跟踪技术uPAINT,测量了细胞表面的内源性AMPAR亚基GluA2的迁移率,以及通过树突表达eGFP-Homer1c作为突触标记物。在基础条件下和NMDAR或P2XR依赖性LTD诱导下在对细胞进行样本采集。
NMDA处理后,AMPAR移动部分增加了35%。然而载体(H2O)处理或ATP处理后AMPAR横向扩散没有变化。NMDAR依赖性LTD诱导后AMPAR迁移率的增加在NMDA处理后的前20分钟内逐渐发生并保持稳定长达3小时。
当LTD由NMDA处理诱导时,移动受体的固定持续时间(反映AMPAR对支架蛋白的亲和力)显著降低。在应用NMDA之前,在突触处,含有GluA2的受体在轨迹持续时间的约60% (60.56 ±1.91) 中保持不动,而该持续时间在10分钟后降至48.92% ±2.11,并在NMDA治疗后30分钟降至40.37% ± 2.03。相比之下,在ATP处理后,该百分比保持不变。
该部分结果显示,受抑制的突触的长期平衡可能不是通过内/胞吐不平衡来维持,而是通过改变AMPAR与PSD相互作用来维持,以牺牲固定受体为代价来增加移动受体池。
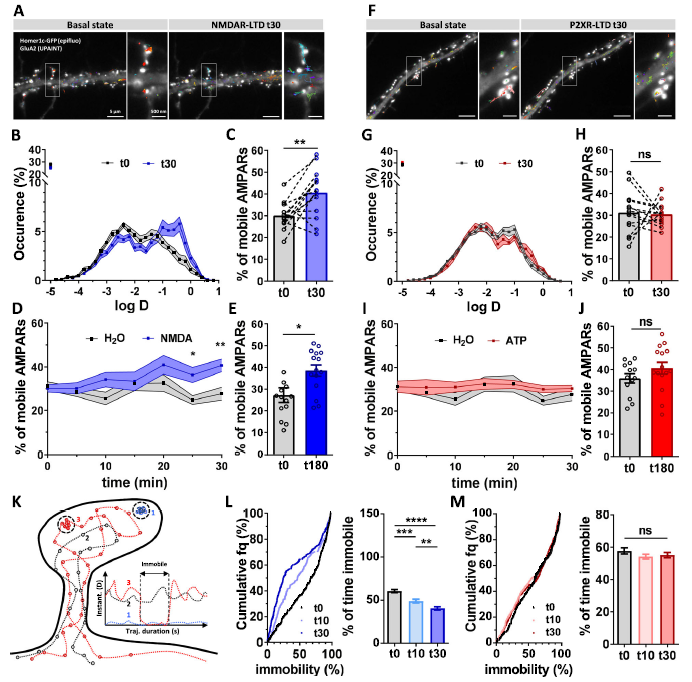
图2 NMDAR依赖的LTD而不是P2XR依赖的LTD触发了AMPAR横向扩散的长期增加
3.NMDAR依赖性LTD 使PSD-95 T19位点磷酸化,并通过自噬诱导其降解
PSD-95是兴奋性突触后密集区的主要支架蛋白,也是突触AMPAR稳定的主要参与者。PSD-95的T19残基是一个GSK3β磷酸化位点,对LTD的诱导至关重要,且PSD-95在LTD期间的降解可能是由自噬诱导的。
WT PSD-95的过度表达触发了每个纳米域突触AMPAR和PSD-95分子的增加,与mEPSC振幅的增加相关。WT PSD-95 在NMDAR依赖性LTD诱导时导致突触AMPAR和PSD-95的数量减少,且mEPSC振幅减少。
相比之下,T19A突变体PSD-95的过表达阻止了NMDA诱导的突触AMPAR和PSD-95数量的减少,并抑制了mEPSC的抑制。进一步应用TDZD8(GSK3β抑制剂),发现前10分钟内,NMDA治疗引发了突触强度(mEPSC)的下降。然而,在诱导后20和30分钟,突触抑制被消除。
这些结果证明特异性NMDAR而非P2XR依赖性LTD,在PSD-95的T19位置触发磷酸化,将PSD-95蛋白靶向自噬体,使PSD-95蛋白降解,且这种抑制负责维持LTD并导致AMPAR表面迁移率的增加。
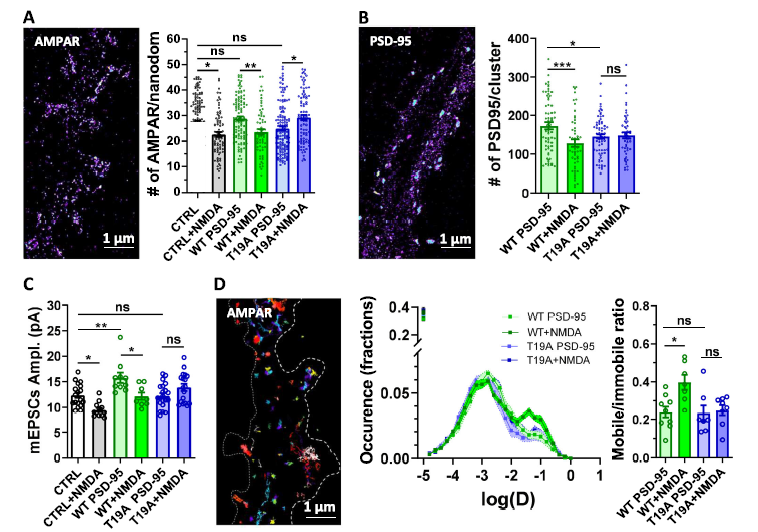
图3 T19位置的PSD-95磷酸化对于NMDAR依赖的LTD诱导的分子重组至关重要
4.在NMDAR依赖的LTD期间短期可塑性增加,需要AMPAR横向扩散
为了确定NMDAR与P2XR抑制的突触中移动AMPAR比例差异是否对突触产生功能性影响。作者对急性海马脑切片中的CA1神经元进行了全细胞膜片钳记录,并在刺激Schaffer侧枝时测量了短期突触可塑性。
应用NMDA后,EPSC振幅降低了约35%,ATP诱发EPSC振幅降低了约28%。表达P2XR依赖性LTD的神经元不会触发AMPAR迁移率的增加,呈现出与基础状态期间测量的相似的配对脉冲响应。相比之下,用NMDA处理的神经元,表现出移动AMPAR比例的增加,与基础状态的神经元相比,配对脉冲比显著增加。
在培养的神经元中表达了荧光谷氨酸报告基因(iGluSnFR),并测量了通过电场刺激触发突触前动作电位后突触后荧光的变化。LTD方案(ATP或NMDA)均未显着改变突触前释放概率。
在1Hz刺激15分钟后,观察到第一个峰值幅度下降23±5.1%。LFS(低频刺激)诱导LTD后30分钟,与诱导前相比,神经元的配对脉冲比显著增加,证实了突触诱导的LTD引发与NMDAR依赖的LTD相似的反应。
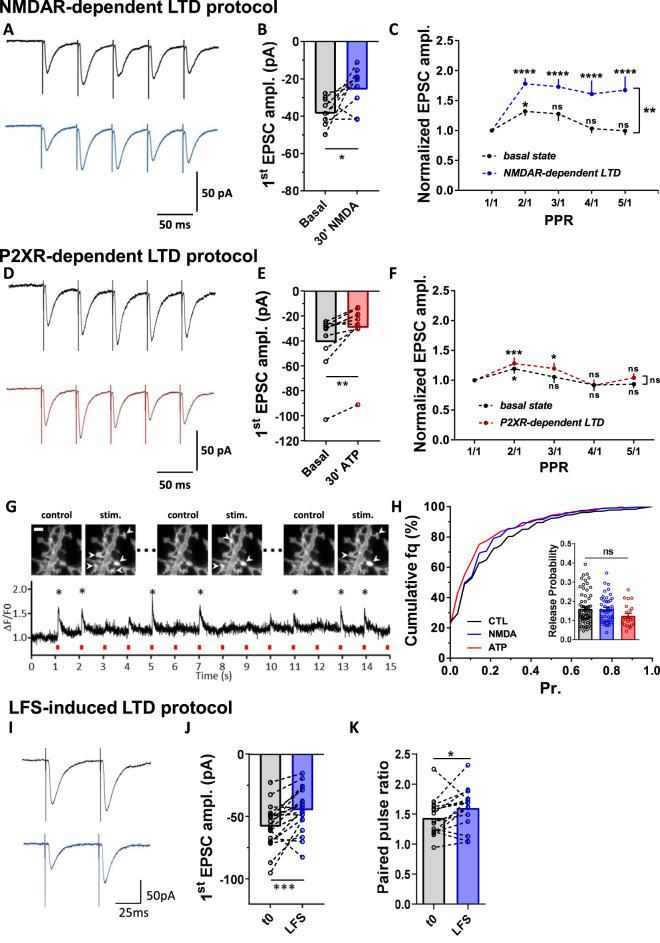
图4 NMDAR依赖性LTD与频率刺激促进相关,而不影响释放概率
5.建模证实增加 AMPAR的移动性可以改善突触反应
为了从理论上评估AMPA内吞作用或解除捕获对AMPAR移动性、组织和突触反应的影响,我们使用MCell软件进行了蒙特卡罗模拟。
根据文献和实验结果,模拟AMPAR电流幅度与两个不同相互作用常数变化之间的关系:(1)内吞速率(k8*3),(2)PSD-95失活率 (k6*4)。
k6*4Inact条件触发了配对脉冲比的增加,第二次释放的AMPAR激活增加了18.7%,第三次释放增加了20.4%。而 k8*3Endo条件不影响AMPAR移动性,并没有改变频率的突触响应。这些模拟表明,由于陷阱数量减少引起的自由扩散 AMPAR 池的增加足以触发配对脉冲促进。
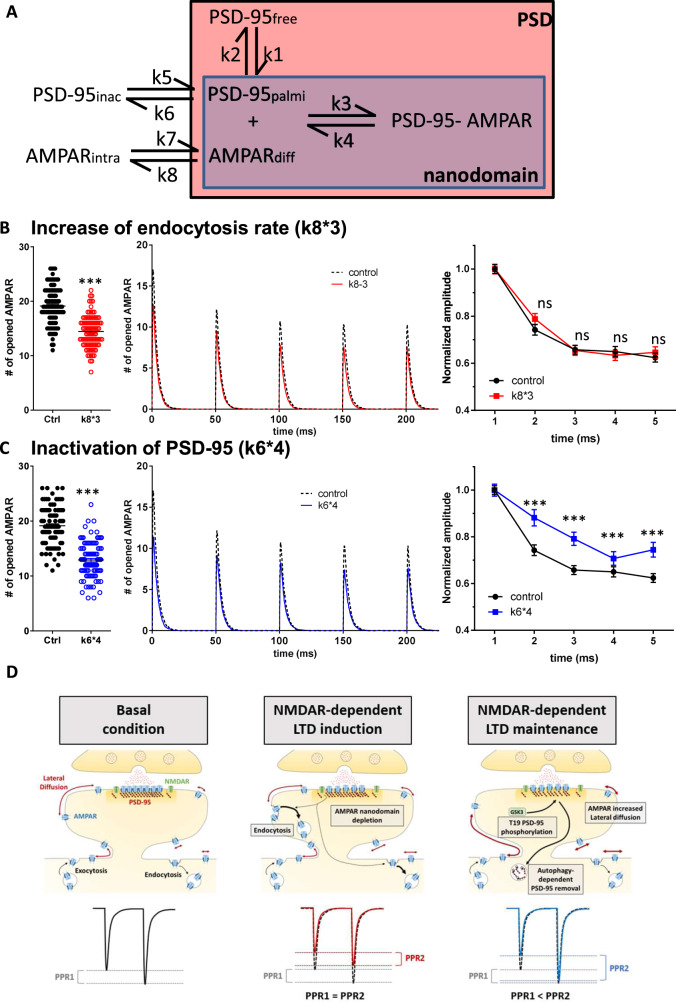
图5 计算机模拟图,AMPAR 解脱诱导了突触电流的抑制和突触反应性的增加
结 论
综上,NMDAR或P2XR依赖性LTD都与突触AMPAR的丢失和重组有关,但只有依赖NMDAR的LTD诱导才能触发PSD-95的深刻重组,其分子机制是PSD-95的T19位置触发磷酸化,将PSD-95蛋白靶向自噬体,使PSD-95蛋白降解进而导致AMPAR表面迁移率增加。突触后变化通常发生在NMDAR依赖性LTD期间,导致短期可塑性增加,从而改善了抑制性突触的神经元反应。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







