CTLA-4抑制剂临床研究进展分析
2019-11-12 陈翔天 火石创造
肿瘤免疫治疗是当下肿瘤治疗研究热点内容之一,其中免疫检查点疗法能通过解除肿瘤的免疫抑制作用,重启机体对肿瘤的免疫应答,已达到清除肿瘤细胞的目的。CTLA-4是免疫检查点疗法的重要靶点之一,本文就CTLA-4抑制剂的临床研究进展作一简单分析。
肿瘤免疫治疗是当下肿瘤治疗研究热点内容之一,其中免疫检查点疗法能通过解除肿瘤的免疫抑制作用,重启机体对肿瘤的免疫应答,已达到清除肿瘤细胞的目的。CTLA-4是免疫检查点疗法的重要靶点之一,本文就CTLA-4抑制剂的临床研究进展作一简单分析。
CTLA-4抑制剂概况
CTLA-4(cytotoxicT-lymphocyte-associated protein 4)是一类表达于活化T细胞表面的免疫球蛋白超家族成员,负责传递抑制信号给T细胞。目前通常认为CTLA-4抑制T细胞的活化机制是CTLA-4能够与T细胞共激活因子CD28竞争性结合抗原提呈细胞表面的B7分子(B7-1和B7-2),且CTLA-4较CD28与配体B7分子的亲和力更强,从而抑制T细胞的增殖和活化。
2018年诺贝尔生理学或医学奖获得者之一JamesP. Allison率先提出免疫检查点的概念,并在动物试验中首次证明CTLA-4抗体能够增强抗肿瘤免疫反应,最终与Medarex公司合作开发出了靶向免疫检查点分子CTLA-4的单克隆抗体Ipilimumab。
Ipilimumab首先被用于黑色素瘤治疗,因其具有较好的治疗效果,2011年FDA批准其用于治疗晚期黑色素瘤,成为第一个用于肿瘤治疗的免疫检查点药物。目前其他在研CTLA-4抑制剂诸如AstraZeneca公司的Tremelimumab、Agenus公司的AGEN1884、康方生物的AK104和康宁杰瑞的KN046的临床研究也正在积极开展中。
CTLA-4抑制剂临床研究现状
截至2019年10月17日,Medarex公司已上市的Ipilimumab以629个临床研究数量位居第一,这与其相关研究开展较早有直接联系;AstraZeneca公司的Tremelimumab则以183个临床研究排第二位;其他CTLA-4 抑制剂临床研究数量相比而言数量极少,本文仅针对研究数量较多的两种药物的适应症、临床研究分期和研究开展国家等进行分析。
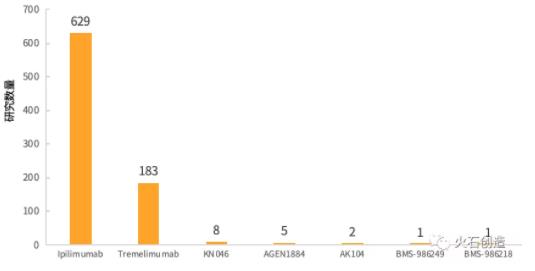
图1 CTLA-4靶向药临床研究数量
数据来源:ClinicalTrials,火石创造
1. 两种药物适应症分布
因Ipilimumab在治疗黑色素瘤获得的良好效果,其相关临床研究数量仍旧占据绝对主体地位,而Tremelimumab针对适应症类型分布则较为均匀,并未出现Ipilimumab适应症中黑色素瘤一家独大的情况,而是由肺癌相关研究占第一位,胃肠道癌居于第二位,黑色素瘤仅占第三位。
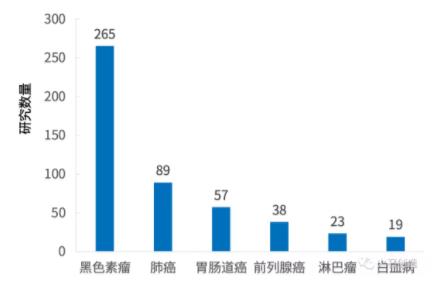
图2 Ipilimumab临床研究适应症分布
数据来源:ClinicalTrials,火石创造
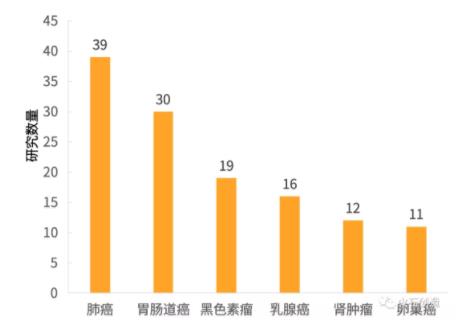
图3 Tremelimumab临床研究适应症分布
数据来源:ClinicalTrials,火石创造
另外,由于单独使用Ipilimumab治疗肿瘤效果的局限性,目前开展的Ipilimumab临床研究大多采用联用其他抗肿瘤药物的方式给药以期得到更好的治疗效果。比如在BMS公司开展的三期临床试验中,PD-1药物Nivolumab联用低剂量Ipilimumab治疗非小细胞肺癌取得了良好效果。而对于Tremelimumab,则常可见于临床试验中与PD-L1单抗药物Durvalumab联用治疗多种实体瘤。
2. 两种药物的临床研究阶段分布
由Clinical Trials登记的药物临床研究数量分析,两种药物的研究进展仍以一、二期临床试验为主,说明Ipilimumab上市后仍然处于积极扩增新的适应症及探索与其他药物联用的治疗效果初步评价阶段,Tremelimumab也同样有扩增适应症,确定合理给药剂量以及治疗效果初步评价等工作亟待完成。
其余正在研发的新药中,Tremelimumab算是将来可能的有力竞争者,但其处于三期临床试验阶段的研究数量也仅为15例,其余新药更是绝大部分都处于一、二期临床试验阶段,因每种药物开展的研究数量太少,故在此未做分析。由此看来同类药物中唯一上市的Ipilimumab在短时间内仍旧会是该领域的主流产品,鉴于全球同类药物开发进度都还处于早期阶段,近期新的研究突破点也许会集中于Ipilimumab的新适应症开发以及联用PD-1/PD-L1药物两方面。
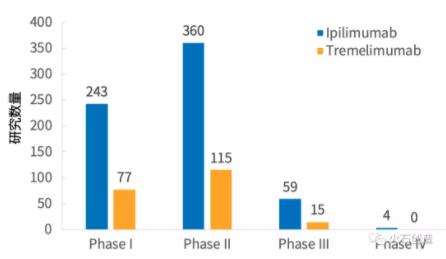
图4 不同药物的临床研究阶段分布
数据来源:ClinicalTrials,火石创造
3. 两种药物的临床研究开展国家分布
在两种药物的临床研究开展数量上,美国以较大优势居于全球首位,这得益于美国对于CTLA-4研究的起点较早,Ipilimumab在美国上市后带动了相当数量同种药物临床研究的开展,而在研究开展数量前列的另外几把交椅则由欧洲各国及加拿大占据。
从数量上分析中国开展这两种CTLA-4抑制剂的临床研究相对较少,在开展国家中处于比较中游的位置,且大部分集中于台湾地区与香港地区,中国大陆地区开展的这两类研究仅占36.73%和29.03%,这可能与国内研发机构在此领域起步较晚有直接关系。
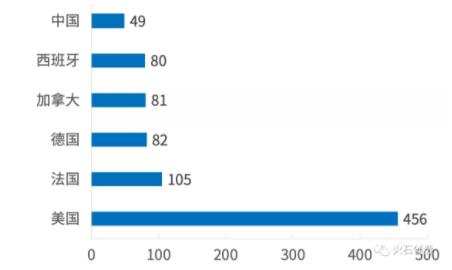
图5 Ipilimumab临床研究开展国家分布
数据来源:ClinicalTrials,火石创造
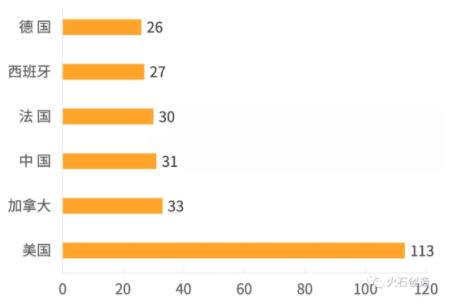
图6 Tremelimumab临床研究开展国家分布
数据来源:ClinicalTrials,火石创造
4. CTLA-4抑制剂中国企业研究进展
根据国内各药企在药物临床试验登记与信息公示平台上公开的内容显示,中国企业CTLA-4方向在研药物均处于一期或二期临床,距离成功上市成为有竞争力的产品还有不短的路要走。
目前国内企业研发的此类药物类型涉及到单抗、双抗和CAR-T细胞疗法等多种类,展现出了中国企业自身良好的创新性,且数家企业的临床研究同时布局中国与海外市场,在澳洲与美国等地同时推进研究进度。未来能否在已有适应症中表现出比已上市产品Ipilimumab更强效的抗肿瘤效果以及更好的安全性,或是针对新的适应症能否表现出自身独有的疗效优势将是上市后的关键竞争点。
小结
2011年首个CTLA-4单抗Ipilimumab获批,开启了肿瘤免疫检查点抑制剂新时代。与明星靶点PD-1/PD-L1药物上市“百花齐放”不同,CTLA-4抑制剂研究起步稍早,但目前此类药物却仍然只有Ipilimumab获批上市,足见除了Ipilimumab外全球范围内其他CTLA-4抑制剂研究进度较慢,绝大多数研究仍处于临床一、二期临床探索调整阶段,或许在相当长的时间里Ipilimumab都能坐稳此类药物的龙头位置。
和全球其他未上市CTLA-4药物的临床研究一样,我国企业研发的CTLA-4靶向抑制药的临床研究也基本都处于一、二期临床阶段,其中不少在研药物在早期研究中已经表现出了良好的初步疗效或更优的安全性,随着临床研究进度的推进中国市场有望迎来此类药物的顺利上市。
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#抑制剂#
74
#研究进展#
68
#CTLA-4#
60