Hypertension 复旦大学附属中山医院舒先红教授团队揭示CHMP4C调控病理性心肌肥厚的作用及机制
2023-10-27 论道心血管 论道心血管 发表于威斯康星
这项研究表明,靶向心肌中的CHMP4C可以显著改善病理性心肌肥厚,揭示了CHMP4C在调控病理性心肌肥厚中的新功能。
心力衰竭代表了各种心脏疾病在临床上的最终恶化阶段,其患病率和死亡率逐年上升,对全球公共健康产生重大负担。病理性心肌肥厚是一个复杂的过程,牵涉到多种分子和多因素的调控,它也是心力衰竭的独立危险因素。因此,深入研究病理性心肌肥厚的发病机制,并寻求有效的预防和治疗方法具有重要意义。
在心肌肥厚的发展过程中,蛋白质正常降解过程的紊乱,尤其是内体-溶酶体途径介导的膜蛋白降解,在其中扮演着重要的角色。带电多囊体蛋白4C (CHMP4C),作为内体分选复合物III (ESCRT-III)的关键组成部分,广泛参与细胞物质运输和信号传导。然而,CHMP4C在病理性心肌肥厚中的作用及其具体机制仍未完全阐明。
2023年10月17日,复旦大学附属中山医院的舒先红教授团队在Hypertension杂志在线发表了题为“ESCRT-III Component CHMP4C Attenuates Cardiac Hypertrophy by Targeting the Endo-lysosomal Degradation of EGFR (ESCRT-III亚基CHMP4C通过调控EGFR的内体-溶酶体降解途径减轻心肌肥厚)”的最新研究成果。这项研究表明,靶向心肌中的CHMP4C可以显著改善病理性心肌肥厚,揭示了CHMP4C在调控病理性心肌肥厚中的新功能。这一研究结果对于理解病理性心肌肥厚的发病机制具有重要启示,也为心力衰竭的预防和治疗提供了新的思路。

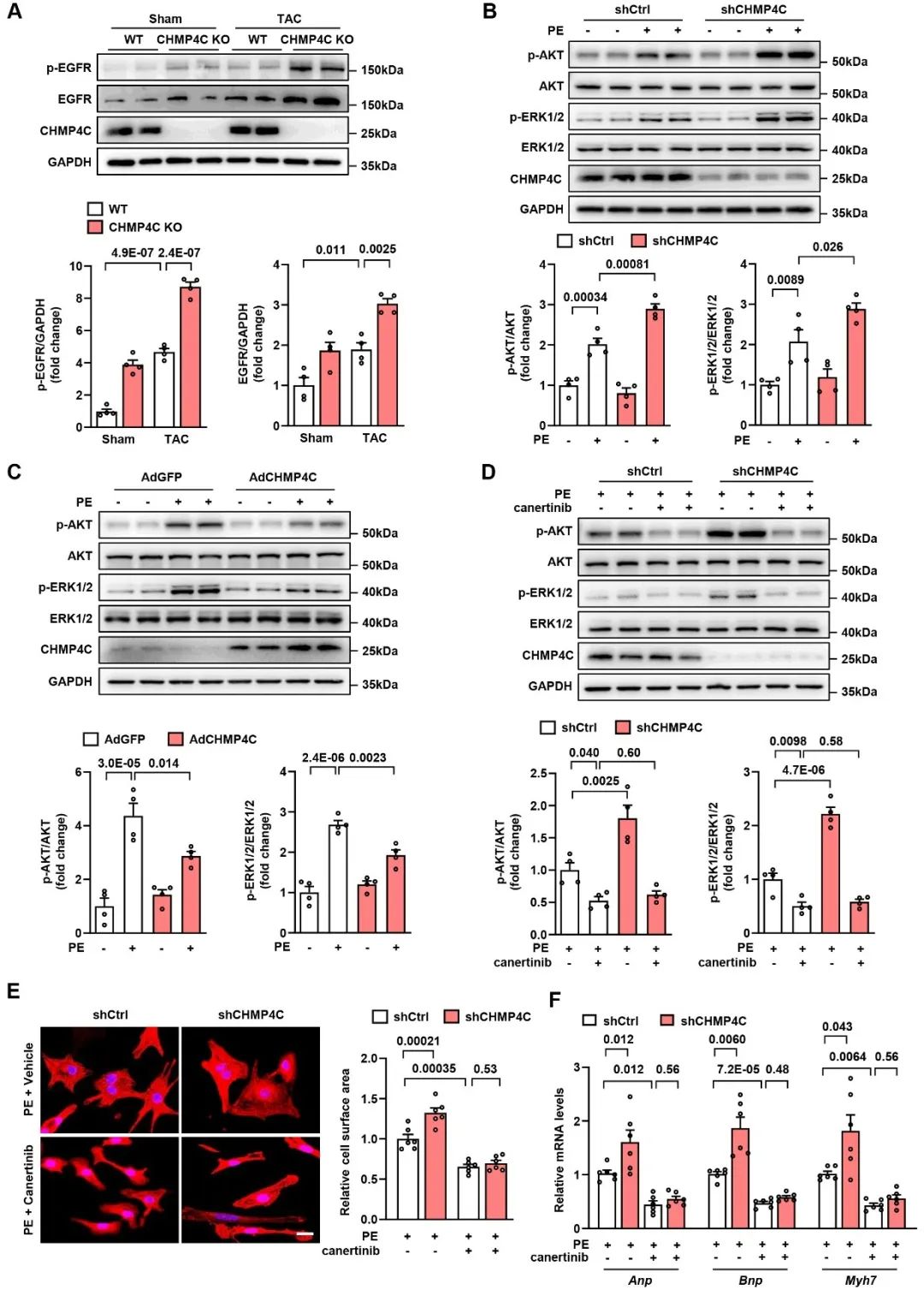
首先,作者对CHMP蛋白家族在病理性心肌肥厚中的表达情况进行了检测,发现在CHMP蛋白家族中,CHMP4C在病理性心肌肥厚情况下上调最为显著。进一步验证结果,作者在Ang II诱导的心肌肥厚和自发性高血压大鼠模型中,发现Ang II诱导的肥厚心脏和自发性高血压大鼠心脏中CHMP4C上调,提示CHMP4C可能在心肌肥厚的发病过程中起作用。
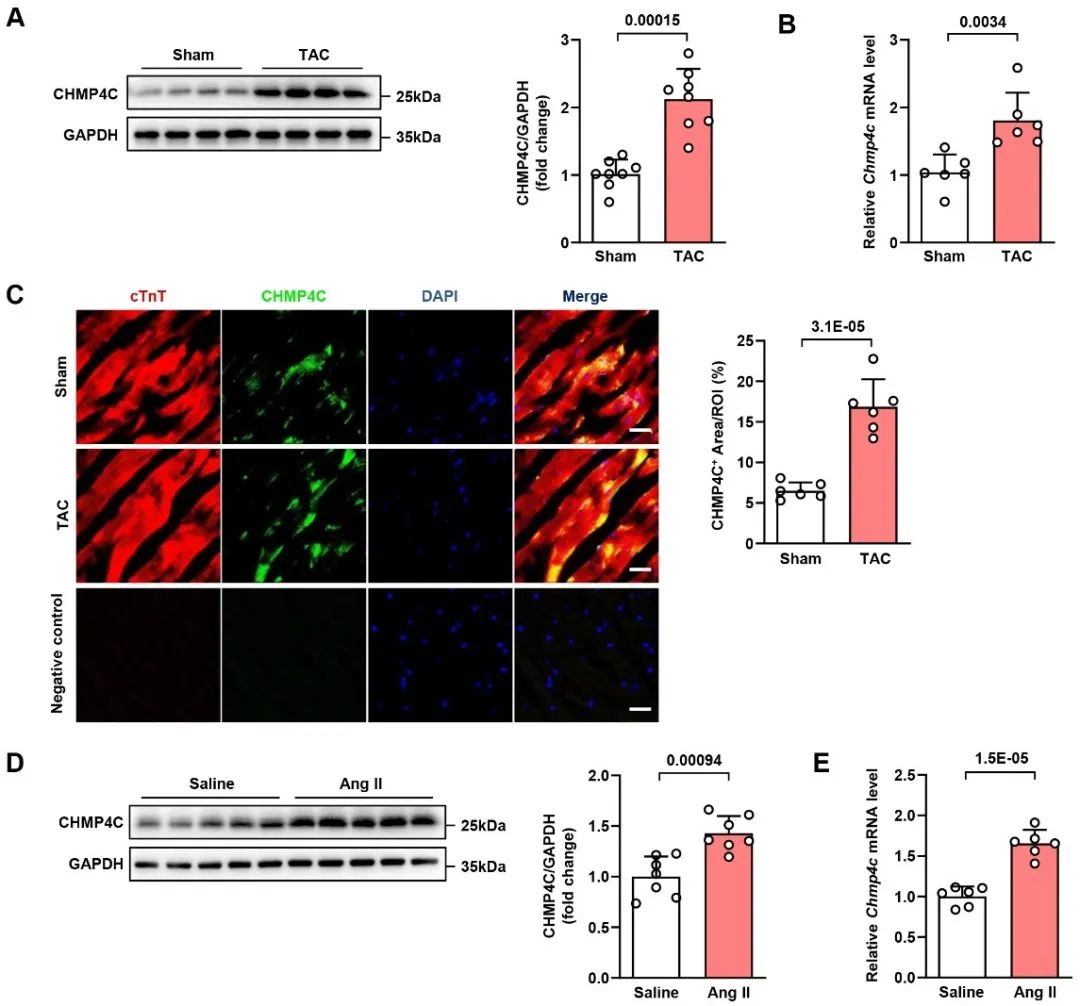
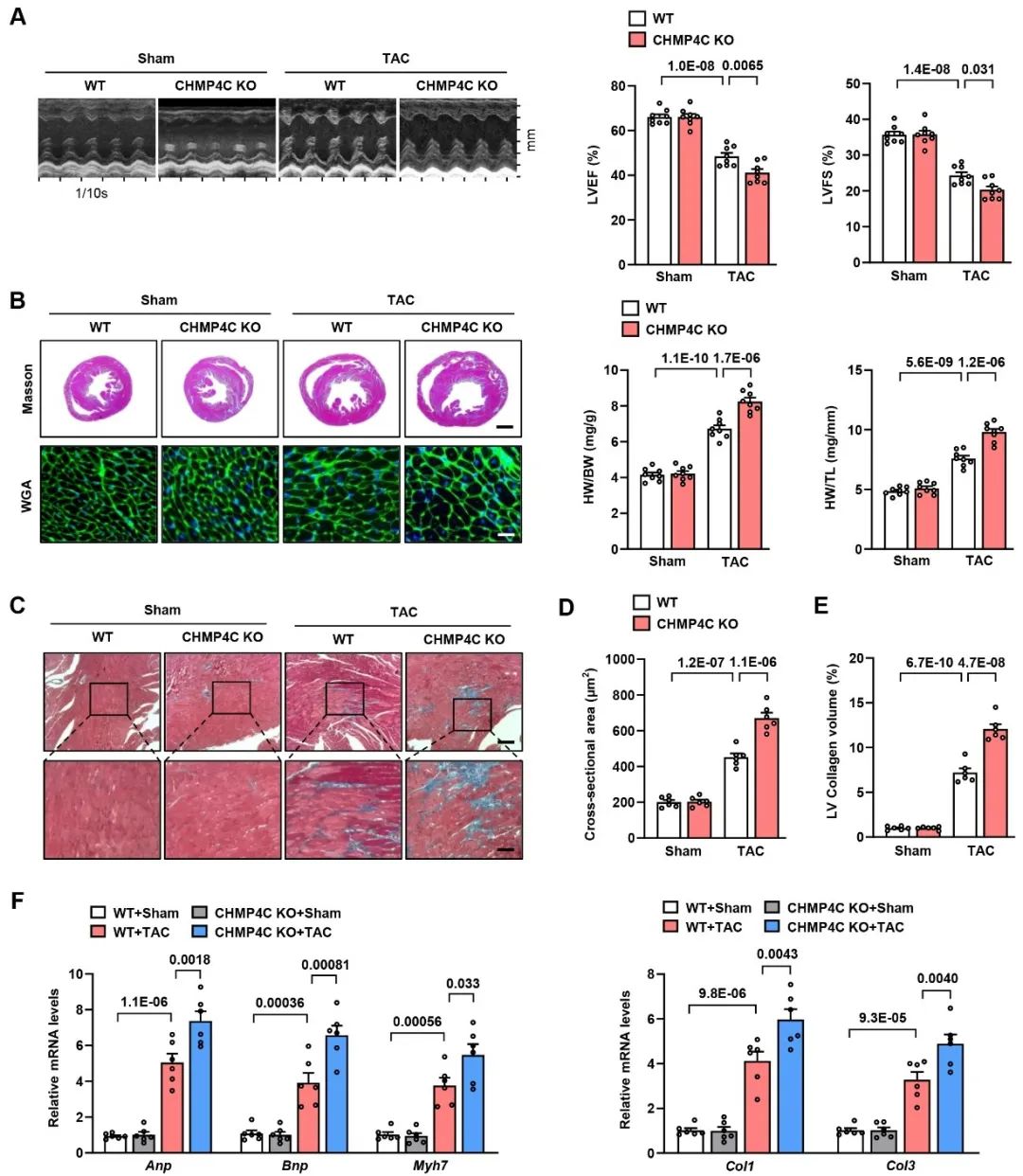
为了证实CHMP4C在病理性心肌肥厚发病过程中的作用,作者构建了CHMP4C全身敲除(CHMP4C KO)与心肌细胞特异性过表达(AAV9-cTnT-CHMP4C)小鼠,并通过主动脉缩窄术(TAC)构建了病理性心肌肥厚模型。结果显示,敲除CHMP4C能够显著增加TAC手术导致的小鼠心脏/体重比、心肌细胞横截面积和室壁厚度,降低小鼠心脏射血分数和缩短分数,同时增加心肌肥厚标志物和纤维化标志物的表达。相反,在心肌细胞中过表达CHMP4C具有相反的作用。这些结果表明,CHMP4C对小鼠病理性心肌肥厚具有明显的保护作用。
接下来,作者探讨CHMP4C保护病理性心肌肥厚的具体分子机制。据报道,ESCRT-III复合物调控内体-溶酶体的运输并促进溶酶体介导的EGFR降解,这对于病理性心肌肥厚的发展至关重要。为了确定CHMP4C是否通过调控EGFR的降解来调节心肌细胞的大小,作者利用腺病毒感染心肌细胞,降低或过表达内源性CHMP4C的水平。与siRNA对照相比,CHMP4C的敲低增强了Phenylephrine (PE)诱导的心肌细胞肥大、肥厚标志物的表达以及AKT和ERK1/2磷酸化。这种增加可以通过抑制EGFR得以完全逆转。反之,与Ad-GFP对照相比,CHMP4C的过表达降低了PE诱导的心肌细胞肥大、肥厚标志物的表达以及AKT和ERK1/2磷酸化。
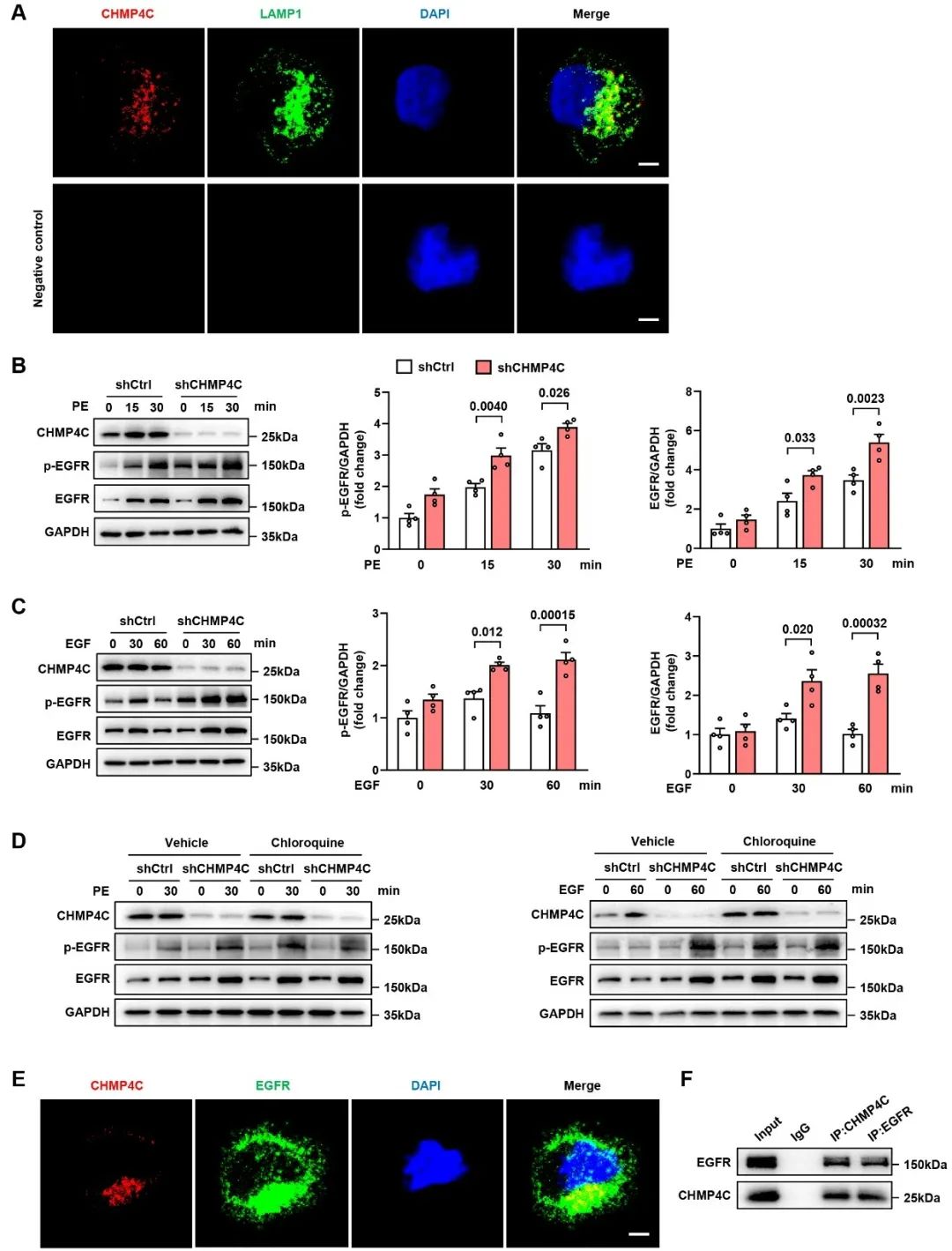
为了进一步明确CHMP4C调节EGFR的内体-溶酶体途径降解的具体机制,作者通过免疫荧光和免疫共沉淀实验确认CHMP4C与EGFR存在互作,并且CHMP4C与LAMP1(溶酶体标志物)共定位。此外,使用siRNA-CHMP4C感染心肌细胞,并用氯喹(一种溶酶体抑制剂)处理,发现与siRNA对照相比,CHMP4C的敲低增加了EGFR的表达,而氯喹处理进一步增强了这种效果。在siRNA对照组中使用氯喹可以使EGFR的表达水平与siRNA-CHMP4C组基本一致。这些发现表明,在促肥厚刺激过程中,CHMP4C与EGFR相互作用,并促进了EGFR的溶酶体途径降解。
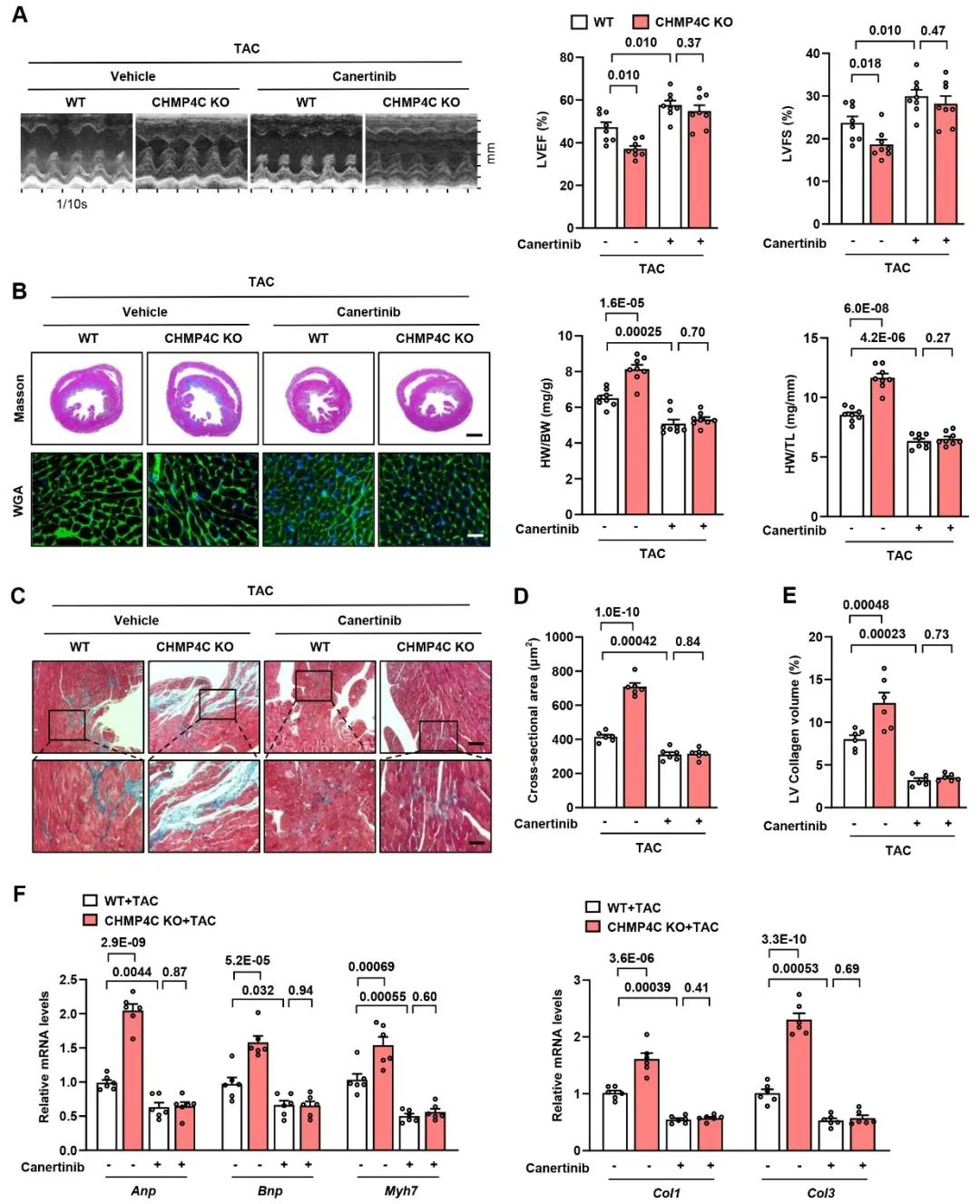
为验证内体-溶酶体途径的EGFR降解是否介导了CHMP4C对病理性心肌肥厚的保护作用,作者利用EGFR特异性抑制剂Canertinib注射到野生型(WT)或CHMP4C KO小鼠中,以特异性抑制EGFR活性,并建立病理性心肌肥厚模型。在注射Canertinib后2周,作者发现,与注射Vehicle对照组相比,Canertinib注射显著抑制了EGFR磷酸化水平,导致CHMP4C KO小鼠的心脏功能改善。因此,这些体内实验数据表明,CHMP4C通过调控EGFR的降解来减轻心脏肥大。
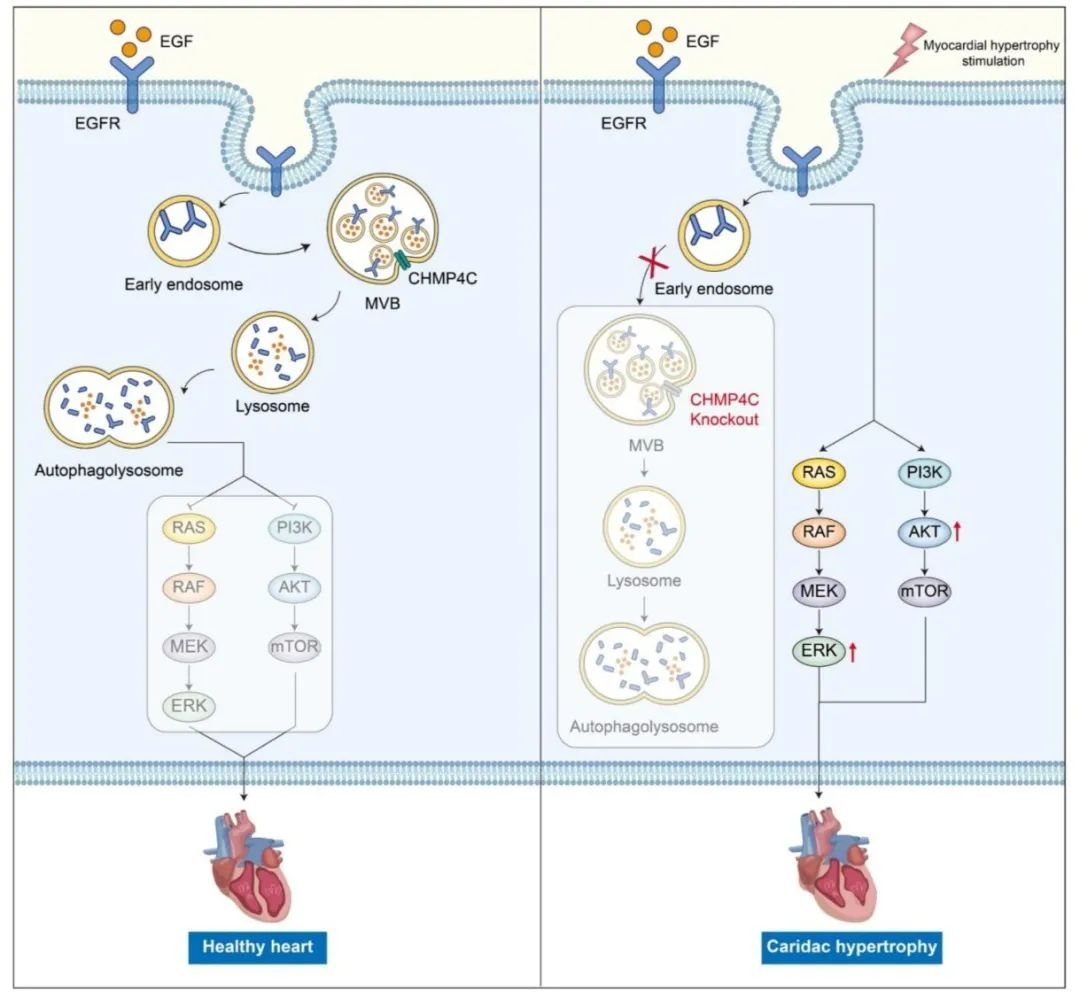
综上所述,本研究证实了CHMP4C对病理性心肌肥厚的重要保护作用。在心肌肥厚发病进程中,CHMP4C表达上调,CHMP4C促进了内体-溶酶体途径介导的EGFR降解,从而抑制了下游信号通路的激活,减轻了心脏肥大和功能障碍。因此,靶向CHMP4C可能成为治疗心肌肥厚的新策略,为心力衰竭的预防和治疗提供了新的思路。
复旦大学附属中山医院心内科刘傲博士、住院医师谢惠琳和田芳艳博士为本文的共同第一作者,舒先红教授和周年伟医生为本文的共同通讯作者。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/HYPERTENSIONAHA.123.21427
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言