专家论坛|耿智敏:精准医学时代胆囊癌的系统治疗——机遇与挑战并存
2023-10-25 临床肝胆病杂志 临床肝胆病杂志 发表于上海
笔者结合最新GBC基础和临床研究进展,就精准医学框架下GBC的关键问题如突变靶点、分子分型、靶向治疗和免疫治疗等进行深入探讨,以期为GBC的精准治疗提供参考。
胆囊癌(GBC)是指来源于胆囊上皮细胞的恶性肿瘤,也是胆道系统常见的肿瘤类型之一。由于其起病隐匿、侵袭性强等特征,患者早期症状不明显,大多数就诊时已处于晚期阶段[1-2]。目前根治性切除是唯一可以实现治愈、获得长期生存的有效手段,但由于GBC易侵入浆膜及邻近脏器,晚期患者常伴有淋巴结及肝脏转移,手术切除疗效非常有限[3]。即使接受根治手术的患者,大约50%存在术后复发可能[4-5]。同时,GBC对传统放化疗并不敏感,极大地限制了晚期GBC的治疗。
精准医疗主要通过基因测序技术和生物医学分析方法,通过对肿瘤的分子特征、遗传变异以及免疫状况等方面的分析,可以更好地预测患者的疗效和不良反应,制订更加精确的治疗方案,从而实现个性化精准治疗。通过个体化治疗方案可以显著提高患者的治疗效果和生存率,目前在乳腺癌、肺癌、结直肠癌等多种肿瘤中得到广泛的临床应用。近年来,精准医疗理念的逐渐深入和各种高通量组学技术飞速发展,极大加深了对GBC发病机制的理解。同时国内外多项靶向药物和免疫检查点抑制剂的临床试验正在如火如荼地进行,进一步确定了靶向和免疫治疗方案对GBC的疗效。笔者结合最新GBC基础和临床研究进展,就精准医学框架下GBC的关键问题如突变靶点、分子分型、靶向治疗和免疫治疗等进行深入探讨,以期为GBC的精准治疗提供参考。
1GBC突变靶点
GBC患者存在高频率的体细胞TP53失活突变,这也是其关键的分子病理学特征。根据癌症体细胞突变目录(COSMIC)数据库,大约40%的GBC患者中存在此种突变,而在国内的研究报道中,其突变率更高(60%~80%)[6-9]。除此之外,GBC还常伴有其他复发性突变,如CDKN2A/B、ERBB2、ERBB3、PIK3CA、ARID1A、ELF3、SMAD4和KRAS等,尽管这些基因的突变率低于25%,但是其中大部分被认为有害或存在潜在致病性[6,10-11]。GBC常见的体细胞突变模式为C-T和C-G替换,主要与两个COSMIC突变特征一致:(1)时钟样特征,与内源性突变和衰老相关的过程有关;(2)载脂蛋白B mRNA编辑催化类多肽(APOBEC)相关特征,其源自APOBEC3A和APOBEC3B胞嘧啶脱氨酶的活性过度激活[12]。其中有研究[13]表明,APOBEC介导的突变特征与较高的突变负荷(TMB)和ERBB家族突变富集相关,提示APOBEC介导的突变可能通过ERBB通路发挥作用。
GBC驱动突变影响多个关键的癌症相关分子通路,包括ERBB家族、RAS-RAF-MEK-ERK、细胞周期、染色质重塑、DNA损伤修复和Hedgehog信号通路[14-18]。ERBB信号通路是GBC突变最广泛的通路之一,也是目前GBC研究较为深入的通路,主要包括ERBB受体和下游基因的突变[14-15]。一项纳入491例GBC患者的研究[19]发现体细胞拷贝数改变导致表皮生长因子受体(EGFR)(1%)、ERBB2(10%)、ERBB3(4%)和ERBB4(0.2%)过度表达。ERBB2是肿瘤发生的关键驱动因素,也是胃肠道癌症治疗的重要靶点。一项针对智利人群的研究[20]对GBC样本进行免疫组化分析,结果显示13%患者存在ERBB2中度表达,表明靶向ERBB2在此类患者中的潜在治疗价值。国内刘颖斌教授团队[15,21]通过对GBC患者进行全外显子测序发现ERBB3和ERBB2突变率分别为8%和7%,此类患者中位总生存期较没有这些突变的患者更差,这可能是由于ERBB突变患者中存在大量免疫抑制性巨噬细胞浸润到肿瘤微环境,从而促进肿瘤免疫抵抗。体外和体内实验也证实ERBB3和ERBB2突变体的异位表达导致GBC细胞恶性表型和免疫逃逸。由于ERBB2可能需要与EGFR或其他ERBB家族成员二聚化才能激活,因此抗EGFR靶向治疗可以作为GBC治疗方案的选择之一[22]。相对而言,DNA错配修复系统(MMR)和微卫星不稳定性(MSI)相关的突变特征在GBC患者中并不常见。MMR缺陷和/或MSI的发生率小于10%,在高TMB患者中也仅占1.2%~5.8%,但是MMR和MSI对于免疫治疗策略制订具有重要的指导意义[23]。低效的DNA修复系统导致基因组不稳定和突变积累,这是癌症发生和发展的关键驱动因素。据报道,DNA修复基因与高TMB存在显著相关性,其中最常发生突变的基因为ATM,其次是BRCA,提示DNA修复抑制剂可能对GBC具有潜在治疗效果[17]。
GBC突变谱的表征有助于鉴定潜在的复发性新抗原,这些新抗原可以作为癌症疫苗候选物,为GBC的免疫治疗提供机会。针对TP53、ELF3、CTNNB1、ERBB2、ARID1A和CDKN2A等基因的热点突变,已经预测出多个与其相关的新抗原[10]。其中ELF3(Y19fs、L73fs和V345fs)、ERBB2(S310Y、S310F)和TP53(G154V)的新抗原肽段被发现能够激活CD8+ T淋巴细胞,因此作为潜在的GBC疫苗候选物,可以单独使用或与检查点抑制剂联合使用。虽然GBC具有高度异质性,但是有研究[24]表明约50%的患者携带至少一种潜在可操作的分子突变(具有靶向治疗潜力的分子改变),分子检测有望为探索GBC靶向治疗新方案提供参考。笔者认为目前对于GBC突变图谱尚缺乏深入认识,其分子特征也尚未明确,仍然需要大样本、多组学、高通量测序研究的进一步探索。在临床中应重视对晚期GBC患者的高危或者潜在可操作基因进行常规化、规范化检测,通过分析患者分子突变信息,为制订个性化治疗方案提供依据。
2GBC分子分型
精准医学强调通过强大的检测和分析手段,将患者分子特征和临床特征进行整合,可以对异质性疾病尤其是肿瘤进行更加精确的亚型分型,从而使临床医生针对不同疾病亚型的人群制订更准确的治疗方案。晚期GBC以高度侵袭性表型和对放化疗的广泛耐药性为特征。在GBC进展过程中,其侵袭性表型的发展主要是由于多个信号通路的失调,通过研究遗传和/或表观遗传机制,包括基因突变和扩增、DNA甲基化、非编码RNA和微小RNA的失调,有望进一步指导GBC的分子分型[25-26]。
一项国际多中心研究[10]通过分析转录组数据对GBC进行分子分型,发现GBC在细胞和分子水平上存在明显的异质性。根据生存时间对患者进行分层,发现两个生存较差的亚型(亚型1、亚型3)与不良病理预后特征(如pN1、pM1等)相关,同时也与免疫抑制微环境(髓源性抑制细胞积累、广泛纤维结缔增生、缺氧)和T淋巴细胞功能障碍有关,而预后较好的亚型(亚型2)则表现出相反的特征。预后较差的亚型同时具有类间充质表型,上调与上皮-间充质转化和TGF-β信号通路相关的基因集合[27]。在上皮-间充质转化过程中,肿瘤细胞与周围微环境之间双向相互作用促进了多个过渡阶段的不同信号级联的同时激活[28]。此外,GBC细胞通过释放免疫抑制细胞因子或趋化因子,诱发肿瘤免疫抑制状态,从而促进癌症进展[29]。因此,在预后最差的GBC亚型中存在免疫抑制性肿瘤微环境,其特点是某些免疫途径如IFN-γ和IFN-α相关炎症反应的上调,和TNF信号通路的上调,以及免疫检查点抑制基因的表达增加和髓系抑制性细胞含量的增加[10]。
通过对GBC的单细胞转录组学分析,证明肿瘤微环境存在丰富而多样的淋巴细胞类型,包括自然杀伤细胞、多个亚型的T淋巴细胞,以及多个亚群的髓系细胞,表明GBC存在高度免疫浸润的热点肿瘤表型。特别是浸润的CD4+调节性T淋巴细胞、CXCL13+辅助性T淋巴细胞、CCL20low/CD163high巨噬细胞和APOE+巨噬细胞在GBC组织中占主导地位,这些细胞亚型反映了肿瘤对免疫治疗的潜在反应能力[30]。尽管近几年GBC相关多组学分子分型研究增多,但目前尚没有建立广泛认可的分子分型共识。笔者认为,随着多组学(基因组学、转录组学、蛋白质组学、代谢组学、单细胞组学等)技术的进步,对GBC分子机制研究的逐渐深入,将推动获得可以反映肿瘤生物学特征本质的分子分型。针对不同亚型的人群制订更准确的方案,从而实现GBC的精准诊疗。
3GBC的靶向治疗
随着成纤维细胞生长因子受体抑制剂英非格拉替尼和佩米替尼以及异柠檬酸脱氢酶1抑制剂艾伏尼布被美国食品药品监督管理局批准,靶向治疗在胆道肿瘤(BTC)的治疗中取得了重要进展。然而,这些靶标在GBC患者中相对少见,其治疗效果也很有限。GBC患者存在广泛的HER2/neu过表达或扩增,证明了基于HER2靶向抗体或与EGFR或HER2/neu相关的酪氨酸激酶抑制剂的治疗合理性。已有研究[20]表明曲妥珠单抗单药联合全身化疗治疗对存在HER2/neu扩增的晚期GBC患者具有增量价值。MyPathwayⅡ期篮式研究[31]对39例既往治疗失败的HER2/neu扩增或过表达的BTC患者进行帕妥珠单抗联合曲妥珠单抗的联合治疗。该试验纳入16例(41%)GBC患者,其客观缓解率为31%,疾病控制率为63%,中位总生存期达14.2个月。相比之下,接受二线FOLFOX联合积极症状控制治疗的转移性GBC患者的中位总生存期仅为5.1个月。MyPathway阶段性结果初步表明双抗HER药物在治疗携带HER2/neu扩增或过表达的局部晚期或转移性或不可切除GBC方面具有临床探索性价值,同时HER2/neu靶向治疗对于晚期GBC患者而言也是一个有吸引力的选择。泽尼达妥单抗是一种双特异性HER2靶向抗体,在一系列HER2过表达的癌症中已经证明其抗肿瘤的疗效和安全性[32]。一项Ⅰ期临床试验对20例BTC患者(其中11例为GBC)进行泽尼达妥单抗靶向治疗,患者的总体反应率为47%,中位反应持续时间为6.6个月。目前该药物正在进行一项临床试验研究[33],用于治疗HER2扩增的晚期或转移性BTC患者(HERIZON-BTC-01;NCT04466891)。其他针对HER2/neu的药物还包括托西酸伐利替尼、来那替尼、曲妥珠单抗+德喜曲妥珠单抗等[34-35]。根据中国抗癌协会胆道恶性肿瘤靶向及免疫治疗指南[36]建议,HER2抑制剂可用于胆道恶性肿瘤一线化疗失败后的后线探索性临床研究。
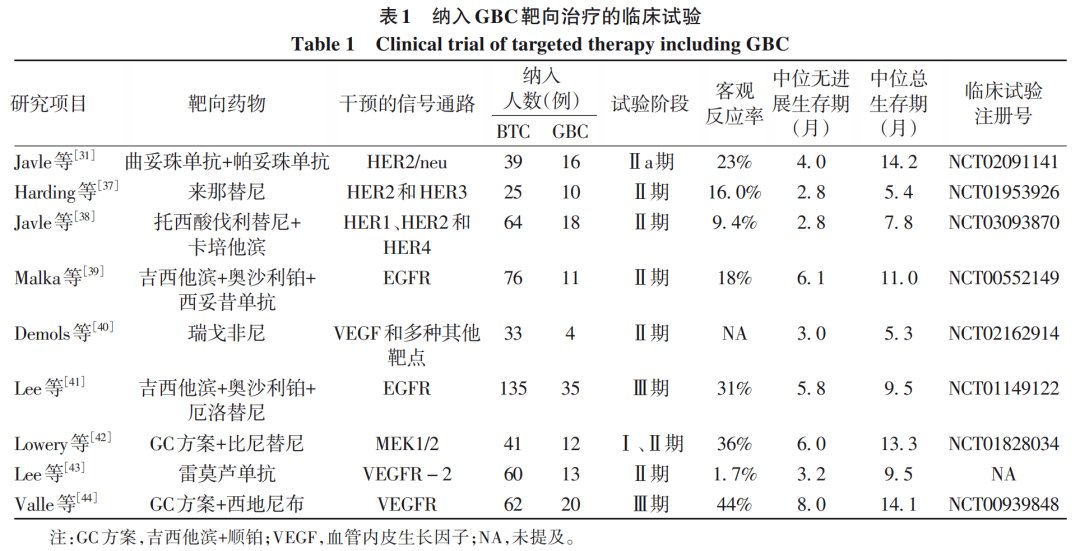
其他靶点如EGFR、VEGFR和MEK激酶等治疗GBC的相关临床试验正在进行,相关靶向治疗的临床试验见表1。近些年,靶向治疗在GBC中取得了一定的进展,多项靶向药物的临床研究正在如火如荼地进行。但是总体来说,研究的样本量相对较小,大多数的研究都是将GBC纳入在BTC中进行,目前尚无重大突破,但笔者相信随着肿瘤基因检测技术的不断进步,越来越多的治疗靶点将被发现和利用,将进一步促进GBC个性化靶向治疗的开发和应用,为GBC的治疗提供新的方法。
4GBC的免疫治疗
近些年,免疫治疗已经在多种肿瘤(如黑色素瘤、淋巴瘤、非小细胞性肺癌、肾癌等)中取得了突破性进展。免疫治疗通过改善免疫系统识别体内肿瘤细胞的能力,调动T淋巴细胞和其他免疫细胞对抗肿瘤。目前已有多个免疫检查点相关药物获批用于恶性肿瘤的治疗,而且有越来越多的潜在免疫治疗相关靶点受到关注。国内外已开展多项针对PD-1或PD-L1治疗BTC的临床研究,使免疫治疗成为一种具有潜力的治疗策略[45]。由于GBC具有免疫抑制的微环境,单独使用免疫检查点抑制剂的客观反应率相对较低[17]。根据KEYNOTE-158和KEYNOTE-028两项研究,帕博利珠单抗单药治疗已经被推荐作为错配修复缺陷或高微卫星不稳定性、不可切除或进展期胆道恶性肿瘤一线治疗方案[10,46]。但遗憾的是,研究缺乏关于肿瘤位置(即胆囊、肝内胆管癌或肝外胆管癌)的具体信息。目前包含GBC患者的相关免疫治疗的临床试验详见表2。
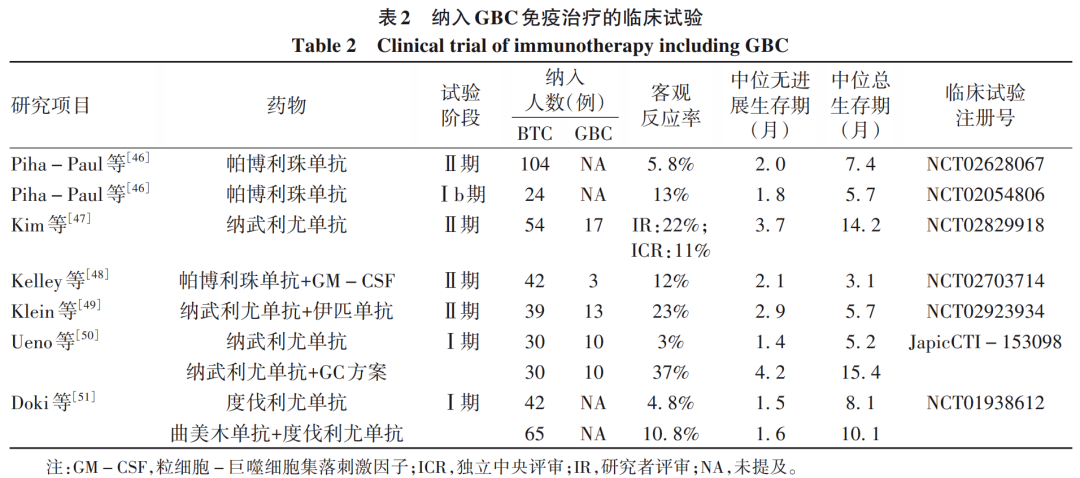
提高免疫治疗效果主要有两种方法:一是筛选有效人群,二是联合治疗。目前筛选有效人群仍在探索中,即通过探究GBC分子机制,挖掘和评估与免疫治疗相关的标志物,包括驱动突变和肿瘤突变负荷。免疫联合治疗的方向主要包括:免疫检查点抑制剂联合化疗、免疫检查点抑制剂联合抗血管生成药物、双免疫检查点抑制剂联合、免疫检查点抑制剂联合局部治疗等。相较于免疫检查点抑制剂单药治疗,检查点抑制剂组合方案的反应率则明显增加。免疫检查点抑制剂联合化疗协同增效在晚期不可切除的胆道恶性肿瘤的治疗中效果较为显著。目前已有两项关于BTC的Ⅲ期临床研究评估了在一线标准治疗GC方案中加入免疫检查点抑制剂对于改善晚期胆管癌患者的疗效,其具体内容详见表3。两项研究(TOPAZ-1和KEYNOTE-966)均取得了重要的突破。TOPAZ-1研究[52]旨在评估度伐利尤单抗联合化疗治疗晚期BTC患者的疗效和安全性。在该双盲、安慰剂对照的Ⅲ期临床试验中,共纳入685例未经治疗的晚期BTC患者。结果显示,总体生存期在度伐利尤单抗组比安慰剂组显著延长(HR=0.80,95%CI:0.66~0.97,P=0.021);无进展生存期的HR为0.75(95%CI:0.63~0.89,P=0.001)。度伐利尤单抗组的客观反应率为26.7%,安慰剂组为18.7%。度伐利尤单抗联合GC方案化疗可显著提高患者的总生存期、无进展生存期和客观缓解率,目前已成为胆道恶性肿瘤一线免疫核心治疗方案。TOPAZ-1是BTC免疫治疗的第一个阳性Ⅲ期试验,但该试验中并未专门针对GBC患者进行分层统计分析。另外一项Ⅲ期试验研究是KEYNOTE-966[53],是迄今为止针对BTC开展的规模最大的全球研究,共纳入1 069例BTC患者,涉及全球175个医疗中心。患者被随机分配到帕博利珠单抗+GC方案(帕博利珠单抗组,n=533)或安慰剂+GC方案(安慰剂组,n=536)。最终分析发现:帕博利珠单抗组的患者总生存期明显延长(12.7个月 vs 10.9个月),同时帕博利珠单抗组和安慰剂组的治疗相关不良事件发生率相似。因此,帕博利珠单抗加用GC方案可能成为转移性或不能手术的BTC患者新的治疗选择。
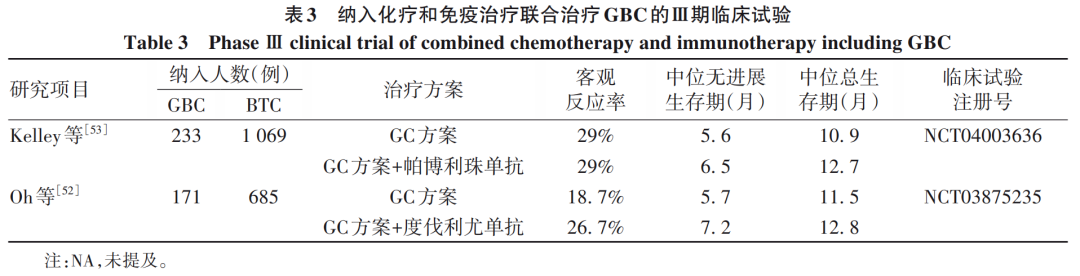
KEYNOTE-966研究和TOPAZ-1研究标志着BTC步入免疫治疗的黄金时代,两项研究的结果相互印证,共同验证了PD-1/PD-L1免疫检查点抑制与GC标准化疗方案联合可以作为不可切除的局部晚期或转移性BTC的标准一线治疗。然而,值得注意的是,两项研究亚组分析发现,GBC患者并不能从免疫检查点抑制联合GC方案明显获益。目前大部分针对BTC的研究,都是将GBC与其他BTC作为整体进行研究,然后再进行分层分析。但是GBC具有独特的生物学特性,与肝内胆管癌和肝外胆管癌的分子特征存在显著的差异。在此背景下,免疫治疗在GBC的临床应用仍然还有很多工作需要进行,如何根据不同人群的分子特征筛选出可以从免疫治疗中获益的亚组,如何发现可以有效提高免疫治疗效果的靶标,以及免疫治疗与靶向治疗或传统放化疗的联合能否带来更高的疗效和生存获益,这些问题均需要今后进一步的研究去解答。笔者也期待将GBC作为独立的研究对象来开展大规模前瞻性临床试验,同时也需要进一步开展研究来确定有效、准确的预测性生物标志物。
5未来方向
目前多个临床试验正在探索靶向治疗和免疫治疗在BTC中的应用。然而,近期的研究清楚地指出了改善患者的预后亟需解决的问题。基因组分析和临床试验经验明确表明,靶向HER2通路是治疗GBC的主要策略,但是总体而言其疗效并不理想,可能需要联合其他肿瘤杀伤作用机制来增加疗效,如抗体依赖性细胞毒性、免疫介导的杀伤作用或化疗提供的直接细胞毒性。深度研究GBC耐药机制并开发新的治疗方案对于GBC的治疗至关重要,这样也可以使GBC患者获益最大。为此,在未来的研究中需要不断开发和测试联合策略,同时挖掘和发现更有效的靶点及靶向药物,来增强抑制GBC的效果。
尽管基于KEYNOTE-966和TOPAZ-1研究的亚组分析略不尽如人意,但免疫疗法未来的发展前景应该建立于GBC基础转化研究之上。PD-1只是引起肿瘤免疫抵抗的众多机制之一,其他检查点如LAG3、TIM3和TIGIT都与T淋巴细胞耗竭有关,仍需要进一步探究。此外,需要在未来的试验方案中不断探索其他一些已知生物难题,包括肿瘤微环境中的间质纤维化、免疫抵抗、免疫抑制性骨髓细胞增生等。TOPAZ-1和KEYNOTE-966研究的积极结果证实了未来免疫治疗将会给晚期BTC患者带来曙光,鼓励研究者开发更好的生物标志物,根据GBC患者分子特征进行分子分型,从而更加精准地确定可以从免疫检查点抑制剂中受益的患者。
6小结
多组学研究表明,GBC在生物学上是一种异质性很高的肿瘤,其与肝内胆管癌、肝外胆管癌具有不同的分子遗传特征。近年来,越来越多BTC的可操作突变被作为靶标用于治疗,但在多项临床试验的亚组分析中却发现此类突变在GBC方面的治疗效果有限。主要原因包括药物脱靶、药物抵抗、个体遗传差异、肿瘤基因突变、肿瘤异质性等。因此,需要不断探究GBC分子机制,开发新的靶标以克服这些机制。除了GBC的内在基因组改变外,还需要深入开展分子分型研究,根据患者个体的分子突变特征,基于患者分子亚型给予相应治疗是大势所趋,也是GBC个体化精准治疗的关键依据。与此同时,还应该意识到GBC是一种相对罕见的癌症,将GBC患者作为单独研究对象,并进一步将其分为不同的组织学分型和分子分型具有一定挑战性。迄今为止,BTC所有开创性试验都是国际密切合作的结果,这将依然是未来努力的基石,希望GBC也可以通过密集协作的国际或者国内多中心共同努力来改善其预后。随着高通量测序技术和生物医学的不断发展、靶向和免疫治疗药物研发的快速进展、国内和国际多中心合作交流的不断加强,相信在不久的将来,临床医生有望依据GBC分子特征,制订个体化精准治疗方案,延长患者生存期,改善临床预后,极大地推进GBC精准医疗的历史进程。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.09.005
引证本文
张瑞, 耿智敏. 精准医学时代胆囊癌的系统治疗——机遇与挑战并存[J]. 临床肝胆病杂志, 2023, 39(9): 2049-2056

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言