CD:浙江大学毛春友/宋章法/张岩揭示促甲状腺素释放激素受体激活的分子基础
2022-10-27 iNature iNature
该研究报道了TRH结合TRHR-Gq信号复合体的高分辨率冷冻电子显微镜(Cryo-EM)结构。结合细胞信号分析、三维变异性分析和分子动力学(MD)模拟,该结果揭示了配体识别和TRHR激活的分子基础。
促甲状腺激素释放激素受体(TRHR)是一类G蛋白偶联受体(GPCR),是下丘脑-垂体-甲状腺轴的关键信号转导器。TRHR主要表达于垂体前叶,通过调节促甲状腺激素释放激素(pGlu-His-Pro-NH2 (TRH))的作用,调节促甲状腺激素和催乳素的合成和释放。TRHR激活后,主要与Gq/11蛋白结合发挥其调节作用。
2022年10月25日,浙江大学毛春友、宋章法及张岩共同通讯在Cell Discovery(IF=38)在线发表题为“Molecular basis for the activation of thyrotropin releasing hormone receptor”的研究论文,该研究揭示了促甲状腺素释放激素受体激活的分子基础。
该研究报道了TRH结合TRHR-Gq信号复合体的高分辨率冷冻电子显微镜(Cryo-EM)结构。结合细胞信号分析、三维变异性分析和分子动力学(MD)模拟,该结果揭示了配体识别和TRHR激活的分子基础。

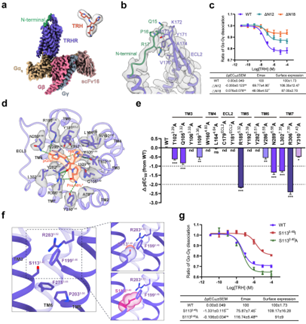
与最近报道的TRH结合TRHR-Gq复合物的两种结构相比,该研究的高分辨率重构为TRHR的肽识别和激活提供了更精确的模板。值得注意的是,作者的结构分解了受体的一个扩展N端区域(残基13-21),这在之前解决的结构中都没有观察到。N端部分指向ECL2,并与β-hairpin的171-176氨基酸残基接触。TRHR的N端(残基1-12)在低温电镜图中没有被解析,可能是由于其固有的灵活性。然而,截断N端12个残基(残基1-12;ΔN12)似乎会损害TRHR的激活。
进一步删除与ECL2接触的N端残基(残基1-18;ΔN18)导致最大反应(Emax)大幅减少50%的T R H 。尽管如此,作者的MD模拟分析表明,ΔN12和ΔN18突变体都没有破坏激动剂的结合,TRH表现出相似的RMSD值~0.9 Å。这些结果表明TRHR的N端可能通过变构作用调节TRHR的激活。
解析的TRHR结构采用A类肽GPCRs的经典活性态构象,与已报道的胆囊收缩素A受体(CCKAR)高度相似,对于7TM束的Cα RMSD值< 1 Å。同时,A类GPCRs激活所必需的保守“微开关”(Toggle switch, DRY, NPxxY, PIF motif)在TRHR和CCKAR之间显示出几乎相同的构象,表明TRHR的保守激活机制。有趣的是,A类GPCRs的P5.50I3.40F6.44基序中保守的I3.40分别被TRHR中罕见的S1133.40和CCKAR中的T3.40所取代。结构分析表明,S1133.40取代典型的I3.40会与TRHR的相邻残基R2836.52或F1995.46发生空间位阻,可能会损害受体的激活。
正如预期的那样,用I3.40替换S1133.40显著降低了TRH诱导的受体激活,而S1133.40A突变在没有破坏局部残基构象的情况下保留了与野生型受体相似的信号传导。对不同物种TRHR的序列比对表明,在TRHR的同源物中,功能残基S3.40和A3.40被高度保存。与TRHR不同的是,CCKAR中T1293.40被I3.40取代似乎增强了与V1253.36、L2175.46和F3306.52的疏水相互作用。事实上,细胞信号分析显示,在CCKAR中T1293.40与I3.40的突变明显增加了激动剂的效力这些结果突出了A类GPCRs激活机制的共性和多样性。
人TRHR的配体识别与激活(图源自Cell Discovery )
总之,该研究报告了TRH结合TRHR-Gq复合体的高分辨率低温电镜结构,这为TRHR激活提供了分子方面的洞察。与最近的两个相关研究相比,该研究的工作提供了更多的结构和功能细节。首先,该研究的结构解析了TRHR的一个扩展的N端区域(残基13-21),该区域可能通过变构作用调节受体激活。其次,该研究的高分辨率结构定义了更精确的配体结合位姿和相互作用,为药物发现提供了精确的平台。第三,该研究的结果显示,PIF基序中非保守的S3.40或A3.40对TRHR的激活至关重要,并且在TRHR同源序列中高度保留。总的来说,这些发现,以及最近的研究,揭示了TRH结合和TRHR激活的分子机制。
原文链接:
https://www.nature.com/articles/s41421-022-00477-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







