繁荣表象下,AI影像“瓶颈期”初现
2020-08-12 孙鹏 CGDHI
2016年3月,在一场五番棋的围棋比赛当中,由Google旗下DeepMind开发的AlphaGo打败了韩国棋手李世石,掀起了这一轮人工智能的浪潮。
2016年3月,在一场五番棋的围棋比赛当中,由Google旗下DeepMind开发的AlphaGo打败了韩国棋手李世石,掀起了这一轮人工智能的浪潮。以深度学习为基础的人工智能(AI)技术以极快的速度被推广到产业和生活的各个领域,并且均有长足的发展。在医疗领域,AI主要的应用场景包括:医学影像处理、病例分析、信息录入、健康管理、临床诊断及决策支持等。随着不断的进行数据积累、技术迭代以及硬件设备的更新,可以预见在不久的将来,AI医疗应用会愈发成熟,也将会有越来越多的AI研究成果落地于医疗应用场景。本文以AI在医学影像处理方面为切入点,以管窥豹,简单的介绍一下现阶段AI与医疗相结合的概况。
01 简介和临床应用
简单来说,“AI+医学影像”是指利用AI技术在认知和模式识别(主要是图像识别)上的独特优势,将其应用于医学影像数据,达到提高诊断效率和准确率等目的。北京大学信息科学技术学院的王立威教授于2017年末在雷锋网发表演讲时就提出:“医学影像是未来几年之内人工智能影响最深远的领域。”
王教授做出这样的判断是有理由的。一方面,他认为医学影像属于静态图像识别的范畴,相比视频处理技术更加成熟(笔者注:当然,技术发展到了2020年,视频处理技术、尤其是实时视频处理技术,已经有了长足的发展,例如YOLO系列。2020年发表的YOLO v4已经可以达到在65 FPS速度下仍有很好的表现);另一方面,很多医学影像处理的用例(Use Case)具有一定的封闭性——也就是任务本身和一般常识关系不大。这样模型就不需要有大量的常识累积,比如不需要让模型理解自然语言。此类任务很适合现阶段的AI模型。
当然,困难与优势是并存的。医学领域有着高度复杂性和专业性。医学影像涉及的病种数量非常庞大,达2000多种。以病灶部位分类,有肺部影像、骨关节影像、心血管影像、神经系统(脑部)影像、乳腺影像、各种脏器的肿瘤影像、眼底图以及皮肤影像等等。以不同设备技术分类,又可以分为CT、X光、超声、MRI、内窥镜和病理切片等。以病种分类,则有肺癌、肝癌、皮肤癌、眼底各种疾病(例如黄斑变性)、乳腺癌以及各种脑部疾病(例如脑出血引发的中风)和神经性疾病(例如阿尔兹海默症)等。病种之间差异很大,各种设备之间缺乏统一的标准,这都对AI产品的研发提出了相当大的挑战。AI医学影像属于交叉学科,其产品需要医学专家和AI专家的通力合作,这已经是业界的共识。
时间来到2020年,不少企业在单病种产品上都做了比较充分的探索。目前在中国最为成熟产品当属肺结节识别等胸部AI。据统计,2019年放射科室中使用的AI产品,高达88%是肺结节筛查。肺结节影像的特点是病灶相对微小,不容易找到,而且医师阅片量巨大,免不了产生疲劳。肺结节识别是放射科医师最消耗体力精力的工作。此外,每年放射科医生的增长量远不及新增的检查量(4%的医师增长对比30%的检查量增长)。这就为AI产品的落地提供了巨大的临床需求。在实际应用中AI也表现不俗:据梅斯(MedSci)2019年报道:“AI能够有效识别易漏诊结节比如6mm以下实性结节和磨玻璃结节,而且准确率在90%左右,同时能提供结节位置、大小、密度和性质等 ”。在国内各个AI公司中,肺结节识别也成了医学影像方向的“入门级”产品。除了肺结节之外,在其它单病种医学影像分析上,例如脑出血、内动脉粥样硬化,颈动脉易损斑块评估以及阿尔兹海默症、帕金森病的诊断以及治疗效果预测上,
都有不同的产品问市。
虽然医学影像分支众多,涉及到的医学知识极广,但是其对AI产品要求也存在一定的共性。2019年由中国医学影像AI产学研用创新联盟(CAIERA)撰写的《中国医学影像AI白皮书》中就总结了AI产品开发中需要解决的三个实际问题:
(1) 产品的鲁棒性
为了防止AI模型在陌生数据中准确性下降,有必要多管齐下,从数据集质量、神经网络架构以及训练方法等多方面入手。其中,数据集的影响尤为重要 :AI产品对数据的数量和质量非常敏感,其优劣对产品有直接的影响。数据的产生,质控以及特定的训练方式——比如合理的数据增强等和鲁棒性密切关联。这其中涉及到数据标记规则的合理性、一致性,标记的质控以及数据的分布(地域,人群,影像产生的特定机型,扫描方案,重建算法)以及有无可能引入系统性的偏见(bias)等等。
(2) 产品的易用性
对于医学影像的AI产品,医疗从业人员(Healthcare Professionals, HCPs)既是直接用户,又是利益相关者。一个好的产品不仅要有优良的算法和有效的训练,在模型以外的功能上更要以用户为中心(User Centricity)。确保医师能方便快捷的获取AI处理结果,不需要额外的操作(打开另外窗口,运行其它App,甚至手动拷贝文件等),这对于提高产品的易用性非常重要。要达到这个目标并不容易,尤其是现阶段各个医院的信息化系统千差万别,数据接口缺乏统一化标准(无论是在技术上还是在数据模型上)。如何确保AI服务器的数据能够畅通无阻碍的进入医院系统,这是每一个AI团队必须解决的问题。只有保证数据的通畅,保证产品“对用户友好”,才能更好的推广产品,从而最终被医师所接受。
(3) 产品的安全性
医疗数据的安全性向来是敏感话题。这其中包括了以下几个方面:1. 病患的数据隐私保护;2. 医院数据不能通过AI产品泄露;3. 由医院数据所训练出的模型归属问题;4. 国内生物医学数据不能流出。这些都是硬性要求,也是每一个AI团队必须做到的。
图片来源:图虫创意
02 技术概述
AI医学影像产品所用到的深度学习技术主要有:图像分割(Image Segmentation), 图像分类(Image Classification)和图像配准(Image Registration)。其中图像分割和图像分类都是深度学习的经典问题,各类研究和网络模型层出不穷。图像分割的网络模型有:FCN(Fully Convolutional Networks, 全卷积网络),YOLO(You Only Look Once, 最新版本是YOLO v4), SSD (Single Shot Detector), FRCNN (Faster R-CNN), Mask FRCNN等;图像分类有经典的ResNet, DenseNet, VGG系列以及2019年谷歌推出的EfficientNet (也是笔者最推荐的图像分类网络)。这些神经网络模型大多是基于卷积神经网络 (CNN),对网络结构进行不同程度的“魔改”,例如层数、卷积核大小、池化层的位置,残差层(ResNet)的引入等等 。图像分割模型则是对网络的上游数据处理和损失函数进行了不同的改动,以达到不同的目标:例如YOLO网络将输入图片分割为S x S的网格,损失函数也不再是经典的交叉熵,而改为带有不同权重的均方差函数。
Ronneberger在2015年提出的U-Net是生物医学图像分割的一个“里程碑”式的研究。U-Net网络架构仍基于FCN。作者修改并扩展了FCN的网络结构,主要改动是将编码器中得到的特征图拼接到相应的解码器上的特征图。这种结构允许解码器保留一部分在编码器池化层中丢失的信息,使U-Net在数据量较小的生物医学图像集上也能取得较好的分割结果,相比FCN更加精准。在U-Net之后有众多研究者在其基础上进行了不同程度的改进,例如Drozdzal加入了ResNet类似的结构,Ronneberger本人及团队将U-Net扩展到了3D图像等等,在本文中就不详细的一一列出了。
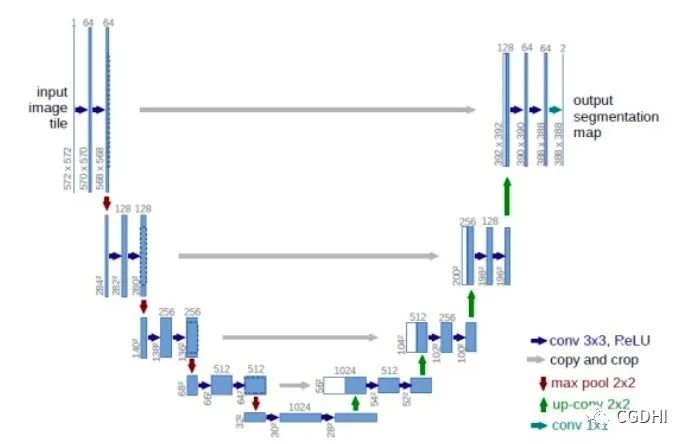
图:U-net网络结构示意图(来源于网络)
医学影像配准的目的是为了整合不同时间点和不同来源的图像,用来建立不同影像之间的同一解剖部位的关联。传统的配准方法需要对图像提取特征,然后再基于图像的特征空间,利用迭代的方法来找到最优的几何变换参数,使变换后的两图达到最为相似。其中,特征的选取和相似性测度是难点。应用深度学习则可以自动提取图像的相关特征,比人工设计的特征更为精确,鲁棒性也更高。现阶段采用深度学习进行医学影像配准的方法大致可以分为三类:深度迭代配准方法,监督学习或者半监督学习配准以及非监督学习配准。
03 产业概述 & 未来挑战
“AI+医学影像”是公认的AI重磅应用,不论是在学术界,还是在产业界,都是“炙手可热”的话题。采用AI模型处理医学影像的论文大量的在顶级会议上发表,其中包括计算机视觉方向的顶级会议CVPR和ICCV,也有更强调AI临床价值的会议比如MICCAI。此外,非AI类会议,例如大名鼎鼎的RSNA(北美放射学会)这样传统医学的全球顶级会议,自2017年开始也出现了专门的“Machine Learning”的展区,而且规模在逐年增加 —— 到2019年,RSNA的主办方专门为人工智能安排了一个展馆,有130家AI公司参与了展出,这在其会议历史上都是非常少见的。
图:RSNA 2019的主题--See Possibilities Together(来源于网络)
这个主题有很强烈的拥抱新科技的色彩。“以患者为中心的医患互动”在AI的参与下将不只是一个理想。
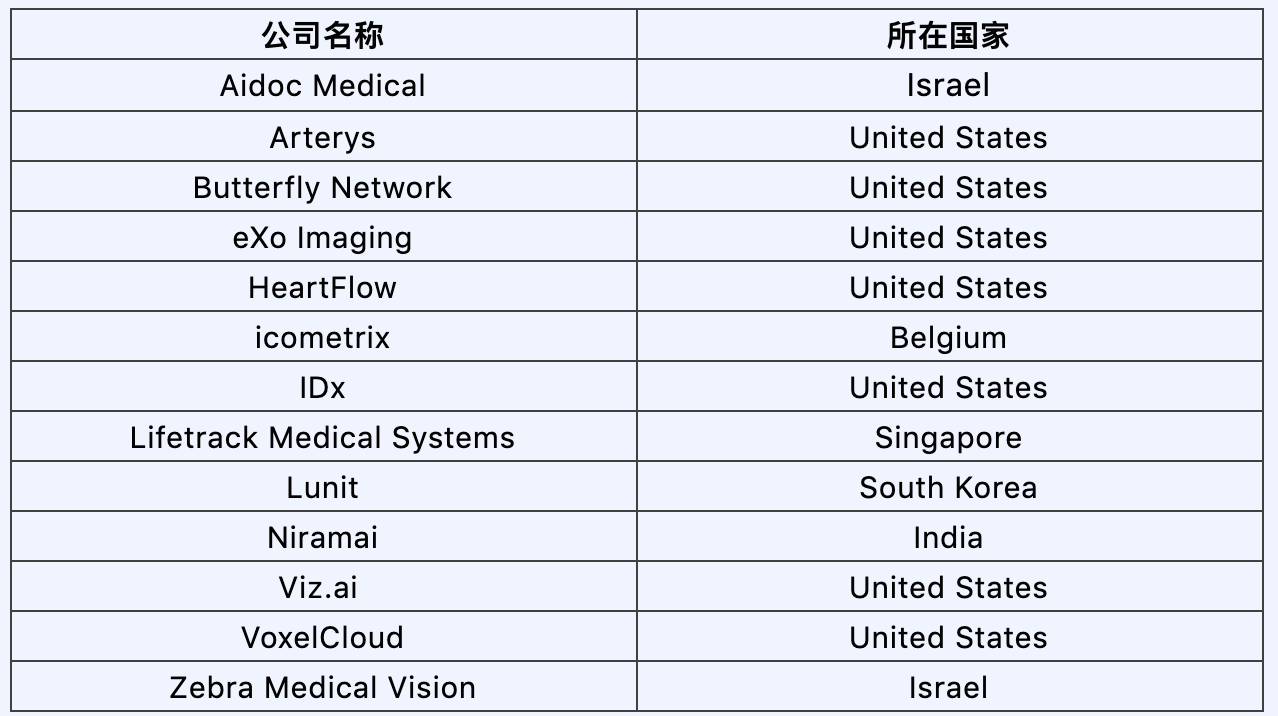
在产业界, 新生的AI公司如雨后春笋,在国内比如联影智能、体素科技,以及AI视觉三大独角兽之一的依图科技,在国外比如Viz.ai, Zebra Medical Vision, Arterys都在着力开发医学影像处理的AI产品 。2019年10月,CB Insights出具的一份报告中,列出了150家最有前景的数字化医疗初创公司,其中13家属于医学影像处理方向。在这之中的两家独角兽公司—— Butterfly Network和HeartFlow —— 的估值均超过了10亿美元。另一方面, 传统医疗巨头自然也不甘落后,“AI+”已经成为医学影像设备巨头如西门子医疗,通用医疗以及飞利浦医疗的既定战略方向。这些设备巨头依托自身强大的硬件优势,积极的拥抱AI技术。大公司着眼的方向往往是应用平台的建设,以培养一个良好的生态系统为目的,来确保自身的产品能够不断迭代更新。在这一过程中,行业巨头多管齐下,不仅着力培养自己公司内部的AI团队,也时刻保持开放,与中小企业和初创公司进行深度合作。此外,应用平台的建设已经开始向云端转移,这个趋势有目共睹。
CB Insights 2019年最具价值的150家数字化医疗初创公司中,13家医学影像方向的公司:
机遇和挑战并存。从2015、2016年开始的这一波AI热潮在2020年已经显现出“即将触及天花板”的趋势。在2020年的今天,“AI+医学影像”的瓶颈也慢慢显露,体现在以下几个方面:
如上文所述,目前的AI产品主流还是集中解决单病种问题。虽然取得了不俗的成绩,但和现实需求也存在一定差距。多场景&多病种+医疗报告自然语言生成这类一站式应用成了各大AI公司新的挑战。应用场景的增多自然要求训练数据的“大而全”。如果做不到这点,一旦遇到陌生数据,模型的结果就会出现较大的偏差。但是如何判断一个数据集已经满足了“大而全”的需求,目前还没有一个公认的标准。
在医疗领域,AI的“黑箱性”长期为医学界所诟病。确实,让医生和患者接受一个不可解释的诊断结果并不容易。如何在算法中融入相对应的领域知识,如何构建知识模型是学术界和工业界面临的重大难题。
很多医疗领域的数据集都有“长尾”的特性,其表现为特例众多,个案众多。很多个案需要用到其它领域的知识来解释,即“非封闭”。如何把不同领域的模型整合起来,形成一个统一的模型,在这个问题上当前主流的深度学习研究还鲜有涉猎,仍然任重而道远。
04 总 结
基于深度学习的AI发展到今天,大致可以分为“工程派”和“理论派”。工程派倾向于将现有的技术发挥到极致,通过建立更全面、更大型、更快速(分布式)的深度学习平台,将模型的准确性和应用的广度推向最大化。理论派则倾向于将现有的应用理论化。通过建立有效的理论,再来反哺工程,从根本上解决一系列瓶颈比如可解释性、神经网络的逻辑推理等问题。
在医学领域,一方面我们可以寄希望于AI专家们提出更精确更鲁棒的模型;另一方面,也可以通过构建行业标准等非技术性手段,来推动AI在医学影像方向上的发展。而这需要在医学界+业界+政府法律法规层面形成合力。2018年9月,国家颁布了《国家健康医疗大数据标准、安全和服务管理办法(试行)》,为将来推行标准化做出了铺垫。在几年的AI产业化大潮中,全世界都涌现出一批AI解决方案的供给方。这些新科技的代表与传统医学的结合,再加上政策的助力,相信在不久的将来会给患者、医疗从业者和管理者创造更多的价值。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Deepmind#
106
#Deepmind#
109