唐本忠院士团队最新ACS Nano:重建供体-受体-供体结构近红外II 区AIEgen,可用于饥饿-光热抗肿瘤和抑制肺转移!
2024-10-22 BioMed科技 BioMed科技 发表于上海
本研究利用新型受体 BFF 构建 NIR-II AIEgen,TPE-BFF 性能优异,结合抗糖酵解剂用于肿瘤治疗和抑制肺转移。
具有强吸电子能力和卓越稳定性的电子受体对于开发具有第二近红外(NIR-II)发射的供体-受体-供体(D-A-D)结构聚集诱导发射发光体(AIEgens)至关重要。尽管6,7-二苯基-[1,2,5]噻二唑并[3,4-g]喹喔啉(PTQ)和苯并双噻二唑(BBT)被广泛用作NIR-II构建单元,但它们在碱性条件下仍存在吸电子能力有限或化学稳定性不足的问题。
在此,香港科技大学唐本忠教授、Jacky W. Y. Lam和西安交通大学靳国瑞教授、西北大学赵婧副教授等人利用二氟化硼甲氮酸盐(BFF)受体构建了新型NIR-II AIEgen,与PTQ和BBT衍生的荧光团相比,其在NIR-II发射和化学稳定性方面表现出更好的整体性能。TPE-BFF具有精细调节的分子内运动和强大的D-A相互作用强度,同时表现出高摩尔消光系数(ε=4.31×104 M-1cm-1)、强NIR-II发射(Φ=0.49%)和光热效应(η=58.5%),以及高稳定性。由于这些优点,通过整合TPE-BFF和抗糖酵解剂2-脱氧-d-葡萄糖(2DG)构建的热敏纳米粒子可通过调节糖酵解和减少ATP依赖性热休克蛋白,成功实现成像引导的光热抗肿瘤肺转移。结合实验结果和理论计算,BFF被证明是设计多功能NIR-II AIEgens的优秀电子受体。总的来说,这项研究为在生物医学应用中开发多功能NIR-II AIEgens提供了一种有前景的替代方案。相关工作以“Reengineering of Donor–Acceptor–Donor Structured Near-Infrared II Aggregation-Induced Emission Luminogens for Starving-Photothermal Antitumor and Inhibition of Lung Metastasis”为题发表在ACS Nano。

【文章要点】
在设计NIR-II AIEgens时,供体-受体-供体(D-A-D)骨架因其结构可操作性而非常理想。它具有一个具有推拉构型的共轭π系统,其中最高占据分子轨道(HOMO)主要位于供体部分,最低未占据分子轨道主要位于受体核心。本文探索了新型受体工程,以开发精细的二氟化硼甲氮酸酯(BFF)衍生的有机NIR-II AIEgens。作者首先研究了三种荧光团(Ph-PTQ、Ph-BBT和Ph-BFF)的光化学和光物理性质,这些荧光团配备了不同的受体,包括PTQ、BBT和由二氟化硼部分和稳定的六元N-二烯酸配体组成的二氟化硼甲氮酸酯(BFF)。实验结果表明,BFF具有最高的吸电子能力和高稳定性。随后,作者将同时作为供电子基团和分子内转子的四苯乙烯(TPE)-稠合三苯胺(TPA)引入BFF核心,构建了称为TPE-BFF的NIR-II AIEgen(图1)。
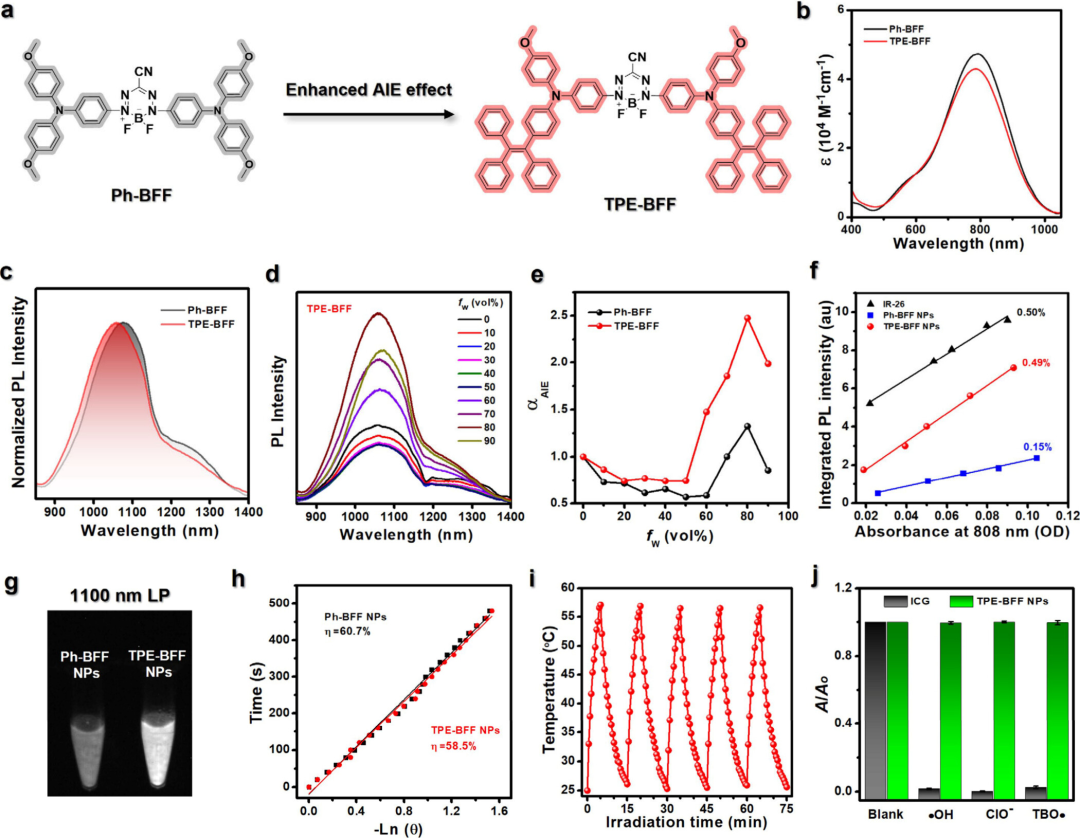
图1 TPE-BFF
TPE-BFF利用强大的D-A相互作用和AIE特性,具有高摩尔消光系数、NIR-II发射波长和适中的NIR-II相对量子产率、高光热转换效率和高稳定性。由于这些优异的优点,TPE-BFF和抗糖酵解剂2-脱氧-d-葡萄糖(2DG)可被共包封到热敏纳米颗粒(TPE-BFF-d-TNPs)中,通过2DG介导的糖酵解调节增强PTT效应,成功地用于肿瘤治疗和抑制癌症肺转移(图2)。总体而言,这项工作为开发用于多种生物医学应用的多功能NIR-II AIEgen提供了一种替代和通用的受体策略。
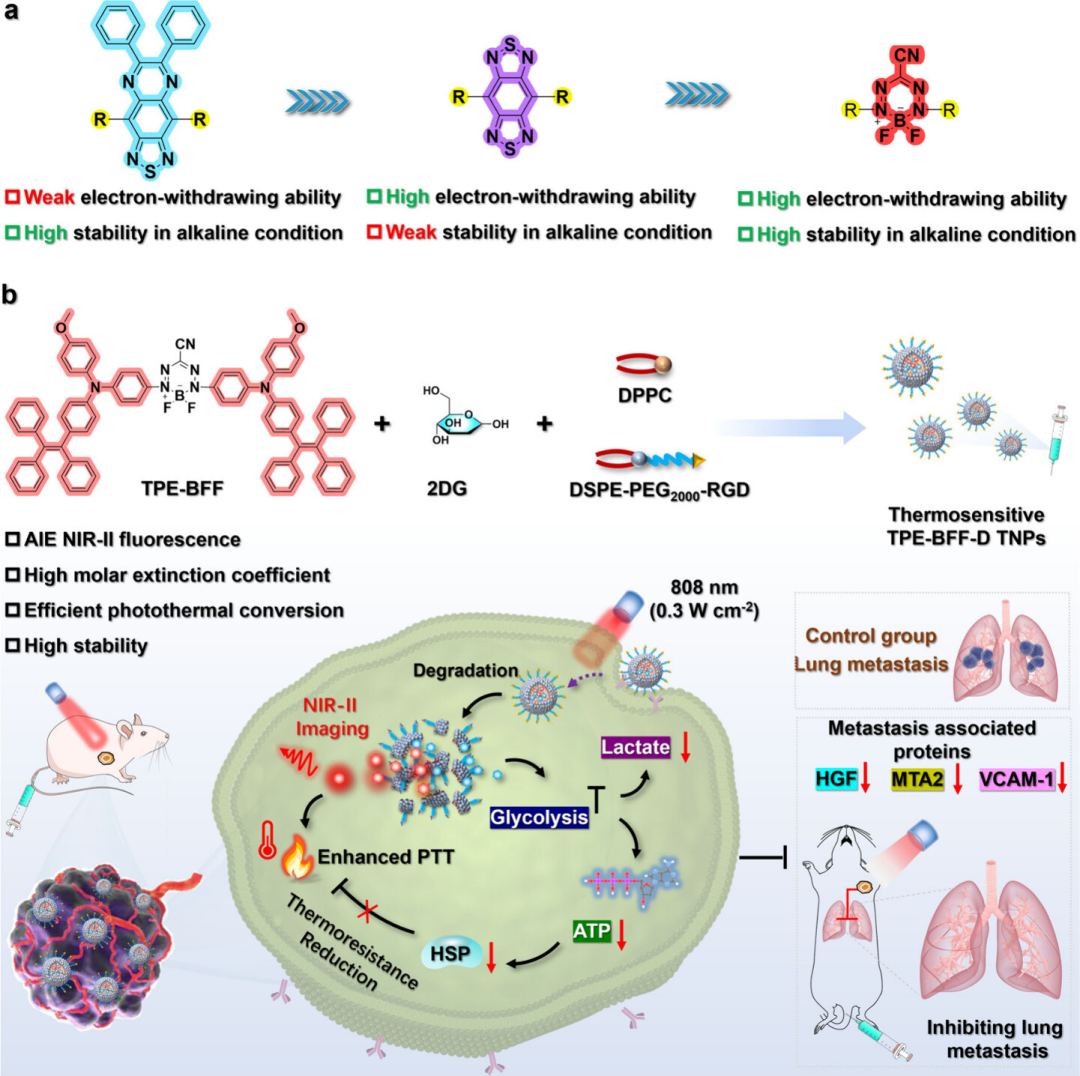
图2 TPE-BFF及其治疗机制
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c11527
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#肿瘤治疗# #NIR-II AIEgen# #BFF#
33