Nature深度好文:看这篇T细胞综述,做更好的免疫疗法!
2016-10-06 佚名 生物探索
导语:癌症免疫疗法近期的进展强调了理解肿瘤中免疫调节通路的重要性。抗肿瘤T细胞的功能失调背后的机制是多样的。T细胞功能失调的这种状态被称为“耗竭(exhaustion)”。尽管有一些共享属性,但近期的研究鉴定出了癌症与慢性感染中的T细胞耗竭之间的显著差异。在这篇题为“Regulatory circuits of T cell function in cancer”的综述中,作者们讨论了肿瘤微环
导语:癌症免疫疗法近期的进展强调了理解肿瘤中免疫调节通路的重要性。抗肿瘤T细胞的功能失调背后的机制是多样的。T细胞功能失调的这种状态被称为“耗竭(exhaustion)”。尽管有一些共享属性,但近期的研究鉴定出了癌症与慢性感染中的T细胞耗竭之间的显著差异。
在这篇题为“Regulatory circuits of T cell function in cancer”的综述中,作者们讨论了肿瘤微环境(Tumour Microenvironment, TME)中T细胞内在的分子变化和代谢通讯(metabolic communication)。文章指出,鉴定出T细胞功能紊乱相关的分子驱动器对癌症研究和治疗的进一步发展至关重要。瑞士洛桑大学的Daniel E. SPEISER教授是这一综述的通讯作者。

Daniel E. SPEISER(图片来源SRF)
T细胞参与了出现在感染、癌症、自身免疫疾病和过敏性疾病中的多种不同类型的免疫反应。1型免疫反应为对抗病毒和细胞内的细菌提供了最佳的免疫防御。细胞毒性CD8+ T细胞和CD4+ TH1细胞(辅助性T细胞,helper T cell)也是免疫系统对抗癌症的主要武器。
事实上,进化塑造的1型免疫反应对抗急性感染比对抗肿瘤更佳。启动强大的1型免疫反应不久后,一系列的T细胞抑制机制会被激活。在疾病最初的急性期之后,T细胞反应的有效弱化其实是有利的。因为延长的1型免疫反应会导致额外的组织损伤,带来潜在致命的免疫病理反应。然而,抗癌免疫力(anticancer immunity)却需要依赖长期的1型免疫反应,T细胞活性的下调会成为抗癌免疫力的阻碍。因此,CD8+和CD4+ TH1细胞(以下简称抗肿瘤T细胞)常常无法控制和消除癌症。
这一综述聚焦了肿瘤微环境中导致T细胞功能失调的免疫抑制作用。作者们总结了TME中不同细胞群导致T细胞抑制的相关机制。近期的研究发现,TME中不同细胞营养组成的变化决定了T细胞功能状态的代谢调节,连同其它一些因素,改变了T细胞的迁移、生存、增殖和效应器功能。此外,T细胞中所有的这一切都是依据它们的信号转导和转录程序严格调控的。
这篇文章中,作者们提供了功能失调T细胞分子特征的一个详细综述。具体来说,文章回顾了近期的一些研究进展,区别出了癌症中T细胞与慢性感染中T细胞的共享特性,以及前者独有的属性。此外,作者们还讨论了基于靶向T细胞功能失调背后机制的治疗方法,希望能够进一步推动癌症免疫疗法的发展。
正文第1部,作者们介绍了TME中的T细胞抑制性细胞。TME由多种细胞类型组成,它们参了肿瘤进展或者休眠(dormancy)相关的一系列生物过程。这些细胞通过接触、细胞因子、趋化因子、营养共享或竞争等交流方式“守住”癌细胞,避免其被抗肿瘤T细胞消灭。
TME中多种细胞群的转录和翻译调控机制诱导了T细胞功能失调的发生。这些复杂微环境的改变为修复抗肿瘤免疫力提供了机会;也就是说,我们可以通过扰乱TME中的免疫抑制机制来对抗癌症。作者们在这部分内容中总结了TME中不同种类的免疫抑制细胞群,为评估TME中的代谢变化以及T细胞功能紊乱的机制提供了框架。
具体涉及的细胞类群包括调节性T细胞、肿瘤浸润(Tumour-infiltrating)抗原递呈细胞(antigen-presenting cells)和髓源性抑制细胞(myeloid-derived suppressor cells)、肿瘤相关巨噬细胞、癌症相关成纤维细胞和脂肪细胞、内皮细胞。

图1:Microenvironmental factors instructing T cell dysfunction. (来源:Nature Reviews Immunology)
文章介绍,T细胞依赖的代谢通路与癌细胞非常相似,包括有氧糖酵解、glutaminolysis、氨基酸代谢、脂肪酸合成等。因此,为了获得充足的营养,TME中的T细胞和癌细胞必须互相竞争(图1)。第2部分内容中,作者们汇总了TME中代谢通讯相关的研究。
 图2:T cell inhibition through mechanisms that are evolutionarily conserved or acquired by somatic mutations(来源:Nature Reviews Immunology)
图2:T cell inhibition through mechanisms that are evolutionarily conserved or acquired by somatic mutations(来源:Nature Reviews Immunology)
紧接着,作者们介绍称,事实上,有多种因素抑制着TME中的抗肿瘤T细胞,其中一些抑制机制是由基因改变引起的,另一些则与T细胞抑制进化保守机制有关(图2)。
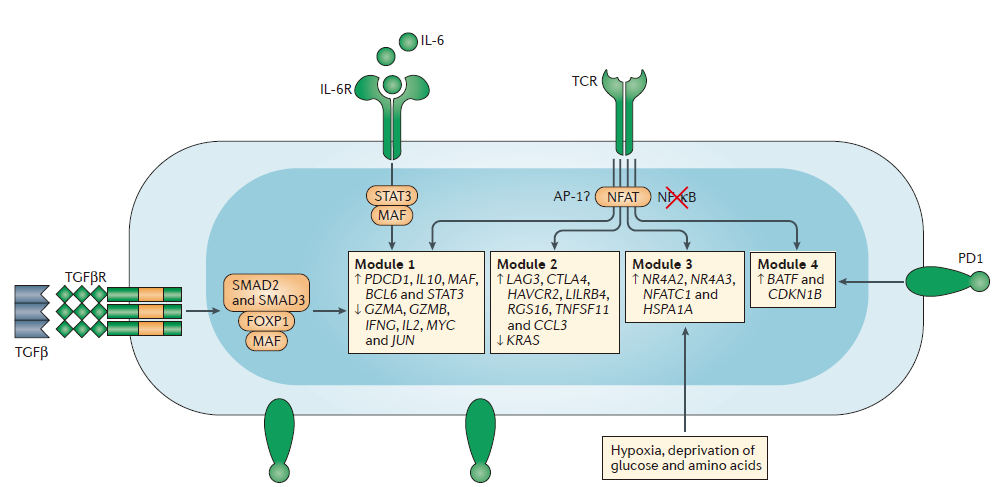
图3:Modular regulation in dysfunctional T cells(来源:Nature Reviews Immunology)
第4部分内容中,作者们总结了T细胞功能失调背后细胞内基因调节有关的一些研究。他们将这些基因分成了4个模块(图3),分别由T细胞中不同的信号通路调节。此外,作者们还将慢性感染和癌症常见的分子改变与癌症中独特的分子改变进行了区别。
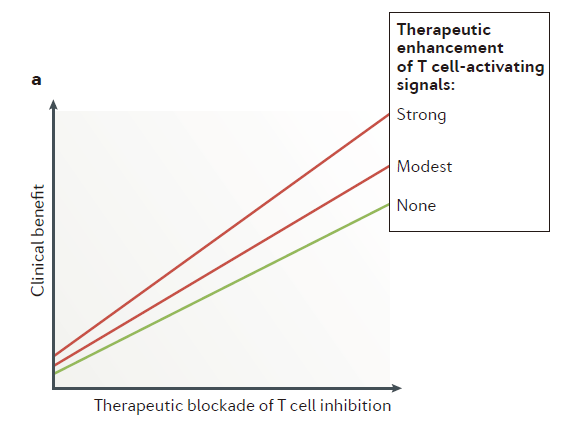
图4:Therapeutic benefit depends on targeting T cell inhibition(来源:Nature Reviews Immunology)
免疫系统独特的性质(如抗原识别、免疫记忆)为对抗疾病提供了持久的免疫力,也表明了基于T细胞的疗法具有产生持久抗癌作用的潜能。相比于其它的抗癌疗法,免疫疗法真正可以让转移性癌症患者实现长期生存,甚至治愈癌症。然而,目前大部分这类癌症患者的病情依然会进展。这就表明需要更好的疗法。在综述的最后一部分,作者们总结了T细胞的这些研究进展对癌症治疗的影响。他们认为,原则上,增强T细胞的激活和/或削弱T细胞抑制能够带来治疗效益(图4a)。
结论与观点
毫无疑问,T细胞具有对抗癌症的巨大潜能,因为它们参与了强大的1型免疫反应。有多种不同的原因引发了TME中的T细胞功能失调。鉴定出主要的TME类型,获得同类或不同癌症患者TME异质性相关的信息是非常重要的。这些研究最终可能帮助确定每个患者或每个患者小组独特的T细胞抑制机制,将患者进行分类。理解这些生物学机制将为开发新疗法奠定基础,使更多的患者受益。
原始出处:
Speiser DE1,2, Ho PC1, Verdeil G1.Regulatory circuits of T cell function in cancer.Nat Rev Immunol. 2016 Oct;16
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#Nat#
61
好文章,受益
107
文章很好,继续关注
111
看看应该不错
118
学习起来
113
深度好文。
104
好好学习
67
好好学习
62
继续深入学习?
55
免疫系统独特的性质(如抗原识别、免疫记忆)为对抗疾病提供了持久的免疫力,也表明了基于T细胞的疗法具有产生持久抗癌作用的潜能。相比于其它的抗癌疗法,免疫疗法真正可以让转移性癌症患者实现长期生存,甚至治愈癌症。能够治愈癌症,这说的难以相信???
53