FDA批准又一通用型CAR-T疗法进入临床试验
2017-03-14 佚名 医谷
近日,施维雅(Servier)、辉瑞(Pfizer)和法国生物技术公司 Cellectis 联合宣布,CAR-T细胞疗法UCART19的实验性新药申请(IND)已获得美国食品和药物管理局(FDA)的批准,可在美国开展人体临床试验,用于治疗复发/难治性急性淋巴细胞白血病(ALL)的适应症。UCART19是一种同种异体CAR-T细胞疗法,利用Cellectis公司(医谷注:2017年2月7日,Cell
近日,施维雅(Servier)、辉瑞(Pfizer)和法国生物技术公司 Cellectis 联合宣布,CAR-T细胞疗法UCART19的实验性新药申请(IND)已获得美国食品和药物管理局(FDA)的批准,可在美国开展人体临床试验,用于治疗复发/难治性急性淋巴细胞白血病(ALL)的适应症。
UCART19是一种同种异体CAR-T细胞疗法,利用Cellectis公司(医谷注:2017年2月7日,Cellectis曾宣布其通用型CAR- T疗法UCART123获得了美国FDA的IND批准,成为第一款获美国FDA批准进入临床试验的此类产品)专有的同种异体方法(allogeneic)开发而成,经Talen基因编辑,不需要依据患者进行相应修饰,而是直接将来源于非患者(non-patient) 供体的T细胞进行工程化,用于多个患者的治疗,该方法与自体移植(autologous)方法不同,后者是将来自患者自身的T细胞进行工程化,包括风筝制药、Juno均采用的是自体移植方法。UCART19与现有基于T细胞的自体产品相比较,UCART19具有同种异体、冷冻状态、“现成型”等优势来克服当前自体方法限制的潜力。
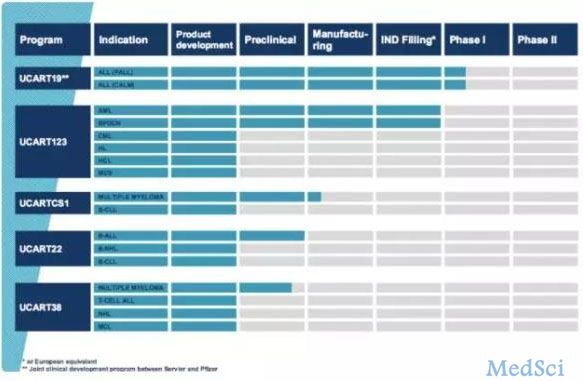
Cellectis 的 UCART 产品线
据悉,施维雅将负责UCART19的I期临床研究CALM,2015年11月,施维雅从Cellectis公司获得了UCART19的专有权,CALM临床试验于2016年8月在英国启动,这是一个开放标签的剂量递增研究,旨在评估UCART19在复发性或难治性CD19阳性B细胞急性淋巴细胞白血病(B-ALL)患者中的安全性、耐受性和抗白血病活性。随着此次IND的批准,CALM研究将进一步扩大,并被纳入包括MD安德森癌症中心在内的多个美国癌症中心。
辉瑞公司CAR- T研究部门副总裁Barbara Sasu女士表示:“辉瑞对这种在研CAR- T方法治疗ALL和其他B细胞恶性肿瘤的潜力感到兴奋,我们很期待有机会在美国进一步研究这种方法。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#CAR-#
122
#FDA批准#
123
希望该技术能救活更多的病人
146
好好学习,好文章谢谢分享
136
学习了,谢谢了
140