医院感染
医院感染是指患者在住院期间获得的感染,被学界称为一场困扰全球已久的没有硝烟的战争[1-2]。我国医院感染发生率从2012年的3.22%下降至2018年的1.98%[3],虽呈明显下降趋势,但其中仍有约30%的医院感染发生于重症医学科[4]。究其原因,重症医学科绝大部分患者存在慢性疾病和急性生理功能紊乱,留置导管且使用大量支持设备[5],故重症医学科的医院感染以呼吸机相关性肺炎、导管相关血流感染以及导管相关尿路感染最为常见,且感染的菌种大多为多重耐药菌,大大增加了治疗的难度[6]。但需明确的是,患者处于高危状态以及留置导管不应成为医院感染发生的理由,而一旦发生医院感染往往给患者带来严重不良后果[7]。
有效预防重症患者发生医院感染是重症救治的前提。大量研究证实,多种感染控制措施可有效降低重症医学科医院感染的发生率[8-10],但不同重症医学科之间的医院感染发生率大相径庭,其中原因虽不乏与病种和患者病情严重程度相关,但更多的是医院感染防控水平存在差异。
当前重症患者医院感染发生率已成为评价重症医学科医疗质量的重要指标之一。重症医学科的医院感染防控涉及多个环节,需从理论、管理、教育、规范、监督等多个层面共同发力。此外,单一的感染控制措施作用有限,需在不同位点多措并举,如通过完善和落实临床操作的各项要求避免和减少医院感染的发生、规范环境清洁和接触隔离措施减少多重耐药菌的传播、提高抗菌药物使用的合理性减少多重耐药菌的诱导和筛选压力等,最终形成合力,才能实现医院感染的有效防控[11-12]。
2024年3月,国内多名重症医学、感染病学及医院感染相关专家在参考国内外最新循证医学证据的基础上,结合临床实践,形成了《重症医学科医院感染控制原则专家共识(2024)》,旨在为重症医学科制订医院感染防控策略提供相关依据。
1 本共识推荐总则
1.1 感染控制目标
主要以降低重症患者医院感染风险,避免感染进一步加重重症患者的病情,缩短治疗周期,最终促进重症患者的病情恢复为主要目标;同时兼顾减少抗菌药物的使用,降低其耐药性扩散。对于重症患者而言,在原发病的基础上,治疗过程中出现新发感染是另一种致命打击,同时医院感染的致病菌往往存在多重耐药,进一步增加了治疗的难度,因此重症医学科内的感染控制是重症患者治疗过程中需严防死守的底线。
1.2 目标人群
入住重症医学科的重症患者。
1.3 共识使用者
所有类型医院的临床医生,尤其是重症医学科医生。
1.4 推荐意见、证据及推荐说明
2024年3月,国内多名重症医学、感染病学及医院感染相关专家召开了工作会议,讨论重症医学科医院感染控制现状及其问题,决定成立 “重症医学科医院感染控制原则专家共识(2024)”编写组。编写组以“院内感染”“重症感染”“nosocomial infection AND ICU”“hospital acquired infection AND ICU”“infection in hospital AND ICU”“catheter-related infection AND ICU”“CRBSI”“ventilator-associated pneumonia”“VAP”等为主题词检索了PubMed、Embase、Cochrane Library、中国知网、万方数据库,检索时间为建库至2024年3月31日,经去重处理后共获得相关文献275篇,阅读文献摘要及精读全文后, 最终纳入符合本共识主题的文献42篇。同时,采用2001年牛津循证医学中心制定的证据等级(表1)对文献进行分类。
表1 2001年牛津循证医学中心证据等级分类
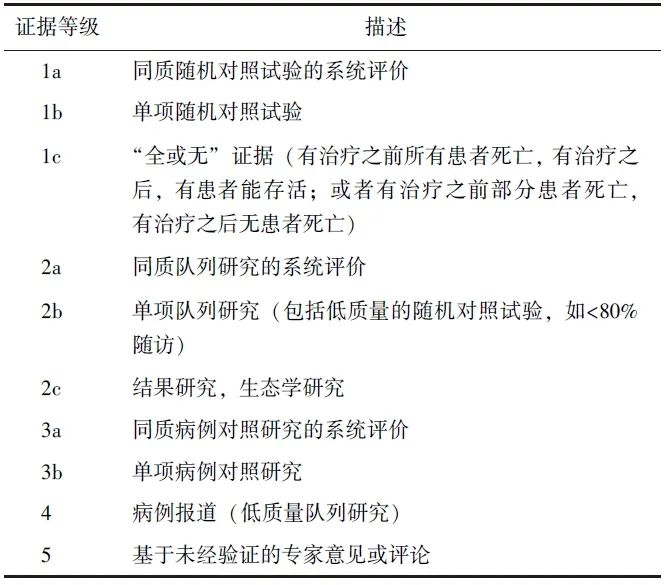
基于牛津分级的循证医学证据,结合既往工作经验,共识编写组认真讨论后形成初稿。2024年4月,通过德尔菲法向全国52名重症医学、神经重症、感染病学、感染控制、重症护理等相关领域专家征集意见,前后开展了4轮意见征集并进一步形成共识条目,包括15条推荐意见,并对推荐意见进行综合评分(0~9分),其中,0~3分为不推荐,4~6分为弱推荐,7~9分为强推荐。2024年5月,再次组织编写组召开会议,对共识条目进行审阅和讨论,根据讨论意见,在综合评分的基础上,对条目进行最后修订,形成终版共识。
2 重症医学科医院感染控制原则
推荐意见1
医生需认识到重症状态导致的机体防御机制破坏是重症医院感染的根本原因【证据等级:2a;综合评分:(7.98±1.88)分】
在当前医疗条件下,具有高毒力、高侵袭力的病原菌很难在重症医学科存活,常见的机会性致病菌一般不会对防御机制正常的普通患者造成感染,但当患者处于重症状态时,机体防御机制往往被破坏,此时即表现出对机会性病毒菌更加易感[13]。同时,重症必需的治疗和操作为机会性致病菌的侵入创造了条件,最终易导致医院感染的发生。
重症病房多重耐药菌的播散使重症医院感染的致病菌更倾向于耐药[14-16],抗菌药物的大量使用产生的诱导和筛选机制导致多重耐药菌成为重症病房的优势菌[17-18],同时造成的菌群失调也为发生新的感染留下了隐患。
认识重症患者发生医院感染的根本原因,对理解后续重症医院感染控制策略的制订具有重要意义。积极有效地救治重症患者有助于消除医院感染的高危因素,但此过程中避免操作导致的医院感染是保证重症患者救治成功的基础。
通过各种辅助手段对被破坏的防御机制进行替代补救是医院感染控制的出发点。而针对无菌操作,如中心静脉导管的留置和使用,严格操作规范是预防医院感染的关键;针对相对非无菌区域的介入操作,如人工气道的建立和使用过程中,通过口腔管理、痰液引流、肺部物理治疗等维持患者局部正常微生态是预防医院感染的核心。
对于多重耐药菌的管控,首先需减少不必要的抗感染药物应用,这需要更为精准的诊断和更有针对性的抗感染治疗,同时接触隔离和环境清洁是减少已有多重耐药菌播散的重要措施[11,19]。
推荐意见2
重症医学科应建立相应机制,推进各项感染控制措施的制定和落实【证据等级:1b;综合评分:(8.73±0.69)分】
重症患者,无论是感染性因素还是非感染性因素导致的重症状态,其救治均需面对感染问题。这给临床带来两点重要提示:一方面,通过积极治疗原发疾病让患者摆脱重症状态是控制患者发生医院感染的根本;另一方面,治疗重症患者首先需采取必要的感染控制措施,避免患者陷入医院感染境地,从而为重症救治创造必要的条件[20]。
由于重症救治过程中,感染控制问题贯穿始终,因此所有参与重症医疗的人员及其每一项治疗操作均需遵守感染控制原则[21],换言之,重症感染控制需有效落实到每一个人和每一个医疗环节中。单个、孤立的措施难以达到控制医院感染的目的,这就需要制订有效机制以保障各项措施的真正落地。这一机制内涵应包括感染控制基本理论的普及,各项操作规范的制定,感染控制相关教学培训、监测方法、分析及措施的更新改进等。
推荐意见3
重症相关医院感染控制措施是重症医院感染治疗的基础【证据等级:1b;综合评分:(8.37±0.93)分】
皮肤黏膜结构和功能破环是发生医院感染的主要始动因素[22],但从某种程度上来说,在重症治疗过程中,感染控制漏洞是医院感染发生的主要原因。在感染诱发因素未得到有效控制前,导致感染的机制仍然存在,此时往往在治疗现有感染的同时,新的感染仍不断出现。其临床表现为在抗感染药物治疗过程中,感染反复发生、迁延不愈,且检出的病原菌也不断变化,说明相继有新的病原菌在侵入机体。
只有完善感染控制措施,去除导致感染的原因,在抗感染药物和患者机体自身免疫力改善的双重作用下,医院感染才能逐渐好转。临床上,除多重耐药菌感染时抗菌药物的使用受到严重限制外,重症感染控制措施存在缺陷是导致感染持续和感染叠加的另一个重要原因。
此外,通过针对重症本身的有效治疗使患者尽快脱离重症状态是避免和治疗重症医院感染的基础,如尽快拔除留置的中心静脉导管,尽快脱离呼吸机并拔除人工气道等。
推荐意见4
重症医院感染控制的执行与监督应分解为可执行的具体措施和指标,并逐项推进【证据等级:2b;综合评分:(8.56±0.78)分】
降低重症患者医院感染发生率是重症感染控制的终极目标。为此,需将这一大目标根据内在因果联系细分为能够执行、落实和监督改进的小目标,主要包括医院感染率的控制、多重耐药菌的控制和抗菌药物合理应用3个层面,其相对独立又相互影响。
相对独立表现为每个层面都有针对性的处理原则,比如抗菌药物使用尽可能做到合理,这样可降低其对多重耐药菌的筛选压力和诱导新的耐药菌产生;做好病房环境清洁和相关人员的接触隔离可减少多重耐药菌的播散;落实床旁操作规范可直接降低医院感染发生率。相互影响表现为每个层面的改变均会对其他层面产生影响,比如医院感染多发势必造成抗菌药物的大量使用,同时加重多重耐药菌负荷,导致多重耐药菌控制困难,反之亦然。
通过不同指标反映重症感染控制状态可更为有效、精准地制订和调整相应策略,起到事半功倍的效果。而盲目采取缺乏针对性的措施,则会增加不必要的人力和物力投入,导致其依从性降低,难以达到预期效果。
医院感染率升高往往提示床旁感染控制措施存在缺陷。例如,中心静脉导管相关的血流感染说明中心静脉置管过程和使用过程中的无菌操作存在缺陷,针对相应操作过程进行调查和改进,可有效降低中心静脉导管相关血流感染的发生率;呼吸机相关性肺炎频发说明重症患者的气道管理存在缺陷,细分成口鼻腔清洁、人工气道气囊的管理、痰液引流、肺部物理治疗和胃肠道管理等几个方面进行评估并调整相应策略,不仅可降低呼吸机相关性肺炎的发生率,还可通过降低肺部病原菌的负荷从而提高呼吸机相关性肺炎抗感染治疗效果。
有效的床旁感染控制措施可通过降低重症相关医院感染的发生率,提高重症救治的成功率[23]。而通过减少因发生医院感染导致的额外工作量,如反复更换中心静脉导管的次数、降低呼吸机使用时间等,最终可提高总的工作效率。
推荐意见5
为有效贯彻各项感染控制措施,应建立具体的操作规范【证据等级:2c;综合评分:(8.31±1.49)分】
虽然针对重症感染控制,国内外有各种指南可以参考[11,20,24-25],但要让这些指南充分发挥应有的作用,必须根据本科室的具体情况建立行之有效的操作规范。
由于科室内具体操作者的年资和水平存在差异,个人对指南的理解不同,在具体工作中又会因各种外界因素影响而产生偏差,最终决定了感染控制效果千差万别。但这并非由个人能力所决定,而是整体管理水平的体现,因此需要采取系统的多环节精细化管理。
以“尽早拔除不必要的中心静脉导管”这一原则为例[11],这是预防中心静脉导管相关血行性感染的重要措施,但如何判定导管留置的必要性,每个人的标准不同,这在客观上难以落实“尽早拔除”的理念,需要科室反复讨论拔除标准,并以规范的形式确定下来,每个人必须遵守。
规范的制定过程不是简单地把指南推荐意见罗列出来,而是通过学习指南、理解指南的过程,以规范的形式把学术内涵贯彻到本科室的实际操作中。把重症相关操作的每一个细节都从感染控制的角度进行规范。规范一旦制定,所有相关人员必须学习和遵守,避免因个人因素导致在执行过程中发生偏差。监督机制是规范执行的保障,通过监督促进规范的落实,也可通过监督发现规范的不足之处进而加以改进。
推荐意见6
重症医学科应建立重症感染控制规范更新修正机制【证据等级:2c;综合评分:(8.25±1.52)分】
同重症救治一样,重症感染控制的理论、技术和方法一直在不断更新,因此规范亦需要不断更新,才能适应当代重症医学的发展。例如,无针输液接头的临床应用,其本身降低了医务人员针刺伤的风险,但由于其结构的复杂性造成消毒困难,潜在增加了感染风险[26],因此关于输液接头的消毒规范必须随之更新,而新技术的开展需要感染控制规范的保驾护航。
在重症救治的临床实践中,有些情况在制订规范时未考虑到,而有些规范在某些特殊情况下又不完全适用,因此应定期对已制定的规范进行更新和修正以适应临床需求。修改和更新不仅不会动摇规范的权威性,恰恰相反,只有不断更新和修正,才能保持规范始终立于学术的制高点,更好地发挥临床指导价值。
推荐意见7
重症医学科应建立以本科室感染控制规范为核心的培训与考核机制【证据等级:2a;综合评分:(7.50±2.68)分】
首先,重症感染控制培训需传递“重症医学科的医院感染具有可预防性”这一理念。在很多人的认知中,重症患者发生医院感染合情合理且司空见惯。在这种思想的指导下,重点必然放于医院感染的诊断、治疗及预防用药上。如果发生医院感染的机制不能被清晰认识,病因即无法得到控制,重症医院感染无论从预防还是治疗上将均难以取得良好的效果。
其次,培训应强调规范的作用。规范是我们认知的所有理论和技术在临床行为上的体现,而规范落实到临床需要所有相关人员理解、接受和准确执行,因此需要多次、反复培训。在很多情况下,并非感染控制技术不够成熟,而是操作者在进行各种临床操作时的基本要求落实不到位。其重要原因之一即是培训和考核的缺失。通过系统培训可让操作者认识到感染控制措施的重要性、必要性,同时培训后的考核机制可强化培训效果,确保各项措施能够在临床准确落实。
再次,培训应强调目标导向的感染控制策略的调整[27]。每一种感染的每一个细节管理,例如,重症患者的肺部物理治疗是否有效,是否需要增加治疗强度、频率或改变方式等,均需进行评估后才能调整,以达到最理想效果。而每一个小目标的实现是降低重症患者医院感染率这一最终目标实现的基础。
换言之,充分的培训是改善感染控制措施执行依从性的重要一环。
推荐意见8
重症医学科应建立感染控制操作相关常规监督和反馈机制【证据等级:1b;综合评分:(7.71±2.65)分】
当前大量研究证明,良好的感染控制措施可有效降低重症医院感染的发生率。但在每一个具体的医院感染事件中,很难与某一个未充分落实感染控制措施的操作确立明确的因果关系,因为向前追溯时可发现在一定时间内有多人、多次进行了与本次感染相关的操作,很难界定哪一次不规范的操作与感染发生有关。这是改善感染控制措施依从性的最大障碍之一。为克服这一障碍,除结果导向外,更应强调过程管理。
过程管理是通过多种方法让所有操作符合既定的感染控制标准,从而避免不良后果的发生[28]。通过规范的制定和培训,可使感染控制具有可操作性、可评价性和可监督性。在临床实践中,通过有效的监督手段可促使规范充分落实,同时也可观察落实过程中的问题,反过来修正规范。从理论的理解、消化到规范制定,再到监督执行,最后反馈并结合结果进行分析,可优化整个感染控制过程,使之形成闭环管理。
推荐意见9
重症医学科应建立医院感染的确诊和疑似病例讨论机制【证据等级:2c;综合评分:(8.37±0. 93)分】
任何医院感染病例都可能提示当前感染控制存在缺陷。针对重症相关医院感染病例开展讨论和分析,可发现临床实践工作中的诸多具体问题,包括感染控制措施本身的缺陷,执行过程中依从性差的原因等。针对性地采取相应措施是感染控制进一步落实和推进的动力。
在病例讨论中,需要克服“感染原因与高危因素混淆”的误区。几乎每一例重症患者都有医院感染的高危因素,但不代表都会发生感染,高危因素不能成为感染发生的理由[29]。重症感染控制与高危因素应是对应的——正因为有高危因素的存在才有感染控制的必要。也正是如此,重症感染控制应作为重症患者救治的基础,避免具有多种高危因素的重症患者在救治过程中发生医院感染,从而导致整个治疗的失败。
此外,新的医疗技术不断更新,其对感染控制的影响首先表现在个案上,这些可在具体病例讨论中被发现,同时新的感染控制理念和技术也应先在个案中进行验证。
需注意的是,病例讨论也是宣传贯彻重症医院感染控制策略的窗口,值得认真对待。
推荐意见10
重症医学科应从感染控制角度关注非预期的体温波动【证据等级:3a;综合评分:(7.88±1.60)分】
多种因素可导致重症患者的体温出现波动,在排除原发疾病本身导致的体温波动外,医院感染是其中较为常见的原因,但此时可能尚未达到感染诊断标准。例如一过性菌血症出现发热,由于抽血时患者体内含菌量低,或血培养敏感度低等问题导致结果为阴性[30],随着细菌被机体免疫细胞清除,体温可很快恢复正常。这种情况可能是床旁操作过程中无菌操作不严格所致,也可能与液体配置环节的轻度污染有关,常被冠以“体温波动”而未引起重视,但这种炎症过程对机体的损害在累积,到一定程度时就会出现明显的器官功能损害表现[31-32]。
能够明确诊断的医院感染只是所有医院感染的一部分,无论何种原因导致的不能用原发疾病解释的非预期体温波动都需要高度关注,这对重症医院感染防控提出了更高要求。
推荐意见11
应注意鉴别机会性致病菌定植和感染状态,以及二者之间的相互转化【证据等级:2a;综合评分:(8.02±1.55)分】
除因无菌操作不严格导致细菌直接入血外,机会性致病菌导致感染首先需经过患者的皮肤、气道黏膜或消化道等途径定植。此时,若机体的防御屏障完整,机会性致病菌难以突破皮肤黏膜屏障导致感染[33-34];若黏膜屏障和局部微生态遭到破坏,定植的机会性致病菌则可引发机体发生感染,如呼吸机相关性肺炎[35-36]。单纯从实验室检查结果上难以区别检出的机会性致病菌是定植状态还是感染状态;此外,若患者具有感染的临床表现,在疑似感染部位获得的标本中检出机会性致病菌时才考虑为感染相关病原菌。
这些机会性致病菌虽然致病力相对较弱,但因其常常具有极强的耐药性,一旦感染,后续抗感染药物的选择将受到极大限制。避免机会性致病菌定植已是重症感染控制的重要方面,主要措施包括:完善环境清洁和接触隔离的各项操作,避免因致病菌播散导致周围患者发生多重耐药机会性致病菌定植。
临床实践中最常见的问题是未被发现的感染控制漏洞和某些环节的过度强调,例如,病房内水龙头和洗手池距离医疗区域过近,缺乏相应的隔离措施;又如,病房的不当隔离不仅造成人力物力浪费,且导致感染控制措施难以长期有效落实,反而影响医疗行为的展开。此类问题需要以目标为导向,不断优化相应的感染控制措施,以达到理想效果。
避免定植转化为感染是感染控制中另一项重要任务。适当的口腔管理[37]、充分的痰液引流和良好的肺部物理治疗[38]是减少局部机会性致病菌由定植转变为感染的重要预防手段,其核心理念是降低局部机会性致病菌负荷,使其难以达到致病水平。在已经发生机会性致病菌感染的情况下,通过降低局部菌负荷也可为感染治疗创造有利条件。
推荐意见12
应注意抗菌药物对机体微生态的影响【证据等级:1c;综合评分:(8.21±1.18)分】
机体与外界交通的区域均有相对稳定的特定微生态,如皮肤、消化道、泌尿生殖道等。局部微生态通过占位效应及代谢改变等机制限制外来其他微生物入侵,成为机体预防感染的重要生物屏障[39-40]。研究证明,抗感染药物是破坏这种微生态的重要原因。正常情况下,机体微生态中除了非致病的正常菌群外,也常伴有少量具有耐药性的机会性致病菌[41]。在应用抗感染药物后,机体耐药性低的正常菌群会被大量杀灭,而耐药性高的机会性致病菌则会迅速增殖,从而导致感染[40-42]。
目前,重症医学科使用抗感染药物非常普遍。尽可能减少抗菌药物的应用是减少机会性致病菌感染的重要策略之一。无论是预防用药还是治疗用药,明确的指征、确切的诊断、规范的评估均是精准使用抗感染药物的基础。
明确的指征是指在抗感染药物使用前有明确使用的目的,如果是预防性用药,应先明确感染类别、预防时长,一旦需要预防的因素解除即应立刻停药。临床常常为了“保险起见”而擅自延长抗菌药物的使用时间或更改为广谱抗菌药物,此种现象应予以纠正。
确切的诊断包括感染部位和致病菌诊断明确,应避免模棱两可的诊断和在此基础上的抗感染药物使用。同时,诊断中还应包括严重程度的评价,如影像学表现、器官功能的改变、炎症指标的改变等,为治疗后效果评价作好准备。
规范的评价是指在抗感染过程中,需对治疗效果进行及时评价,以评估前述诊断和治疗的正确性,常采用诊断感染和使用抗感染药物的临床表现和实验室检查作为评价指标。随着更多检查结果的出现,如实验室或影像学资料等,诊断也应进一步被修正,并根据治疗效果随时调整治疗策略。
需注意的是,感染的发生与发展受多个环节的影响,抗感染治疗也是对多个环节的管控,如解除导致感染的原因、做好感染控制避免医院感染的反复叠加、感染灶的充分引流等,而抗感染药物应用只是其中一个关键环节。应避免过度依赖抗菌药物的使用而导致整个治疗失败。
推荐意见13
以细菌侵入通路为核心的节点控制策略可有效降低中心静脉导管相关血流感染【证据等级:2b;综合评分:(8.38±1.05)分】
经皮肤表面穿刺进入封闭无菌的血管内并置入导管,是重症救治过程中的重要操作之一,该操作为重症患者治疗和监测提供了重要途径,但同时也为细菌入侵提供了可乘之机。通过如下一系列策略做好中心静脉导管相关血流感染的预防是使用导管的前提[24-25]。
1 节点的确定:
导致中心静脉导管相关性感染的机制可分为沿导管内腔进入和沿导管壁侵入。从临床流程出发可捋出因导管置入和操作导致血管内无菌环境与外界有菌环境相通的环节,如穿刺置管过程、导管开放操作、配置液体操作、留置期间穿刺点的管理等,这些环节既是发生感染的关键环节,也是预防感染的关键环节。
2 封闭感染入路:
针对上述可能导致感染的关键节点,制订相应的无菌操作规范,按照规范要求进行充分消毒,阻断细菌通过开放导管进入体内的途径。
3 节点控制策略:
以上述的关键节点为核心,建立相应的操作规范,然后以规范为基础进行教学和监督,确保规范有效落实,从而让中心静脉导管相关血流感染的预防更具操作性。
与中心静脉导管管理类似,其他导管,如腰大池置管引流、 脑室置管引流等,均可以此作为参考。
推荐意见14
目标导向的气道管理策略可有效预防和治疗呼吸机相关性肺炎【证据等级:2a;综合评分:(8.19±1.46)分】
与中心静脉导管相关血流感染不同的是,虽然有多种生理保护机制,但呼吸道并非完全无菌状态,无论是口鼻腔、上呼吸道、下呼吸道,均有相对稳定的微生态。绝对避免口鼻腔细菌进入下呼吸道难以实现,口鼻腔和咽部是通往下呼吸道的重要通路,胃内返流液也在口咽部汇聚。
在会厌反射功能正常的情况下不会有大量误吸,但受疾病状态及相关治疗的影响,重症患者的气道自洁能力下降,会厌反射功能削弱,留置气管插管后声门无法闭合,口鼻咽腔分泌物和胃内返流物夹带着大量细菌进入下呼吸道导致肺部感染是呼吸机相关性肺炎发生的主要机制。
如果口鼻腔被多重耐药菌定植,后续就可能转变为多重耐药菌的肺部感染,导致抗菌药物的作用严重受限。肺部感染的发生除与各种病原菌侵入有关外,其决定因素在于侵入的病原菌数量。医院感染的主要病原菌均是机会性致病菌,其本身致病力较弱,少量侵入的病原菌很快能够被机体的防御机制清除或仅保持定植状态,但当病原菌的数量超过机体防御能力时,即可发展为感染状态。因此,呼吸机相关性肺炎的预防和治疗需围绕上述机制展开。
当前临床预防呼吸机相关性肺炎的措施可概括为如下2个方面:
|
1 |
尽可能避免或减少口鼻腔、人工气道的分泌物及细菌进入下呼吸道,具体措施包括加强口腔护理、人工气道的气囊和声门下吸引以及半坐位等。 |
|
2 |
尽可能让下气道内的分泌物及细菌排出体外,具体措施包括痰液引流(体位引流和气道温湿化管理)以及目标导向的肺部物理治疗等[20,24-25]。 |
因患者病情不同,仅规定每天吸痰、口腔护理、翻身拍背的频率是不够的。口腔护理除每天按要求定时进行口腔清洁外,还需维持口鼻腔内不能有分泌物积聚。人工气道的气囊压力要有明确的监测流程,多项研究证实,持续气囊压力监测、动态维持恒定压力同时进行持续气囊上冲洗和吸引,可有效减少通过气囊与气道间隙进入下气道的分泌物。
无论是否进行胃肠营养,均需常规进行胃肠功能监测,评价是否存在胃潴留及其严重程度,采取积极措施避免胃内容物反流误吸。需结合双肺听诊和影像学检查结果评价痰液引流是否充分、是否存在局部肺实变和不张等情况,在此基础上调整痰液引流、肺部物理治疗和体位引流等多项措施的强度、频度和方法,以达到预期治疗目标。所有上述预防肺部感染的措施,其目标均是降低肺部机会性致病菌的数量,而预防效果取决于降低菌负荷的效果。
以降低肺部菌负荷为核心,为每一项具体措施明确相应目标,并以目标为导向发挥各项措施的最佳效果,才能达到降低肺部感染的最终目的[27]。
推荐意见15
通过采取良好的重症感染控制措施有助于临床诊疗方向的判断【证据等级:1b;综合评分:(8.12±1.82)分】
重症患者的临床表现是多种因素共同作用的结果,除原发疾病外,感染是重要原因之一,但感染的诊断和鉴别往往存在一定挑战。例如,创伤患者出现体温波动,提示感染的可能,此时如果患者采取了呼吸机辅助呼吸且留置有中心静脉导管,其体温波动除需考虑原发疾病外,还需鉴别体温是否来自呼吸机相关性肺炎或导管相关血流感染。该鉴别需采取额外检查,不仅耗时,更严重的后果是造成临床误判,延误真正感染灶的确诊和治疗时机,进而造成严重的临床后果。
若有良好的重症感染控制作为基础,针对感染的诊断和筛查就可能更倾向于医院感染以外的原因,如原发感染灶处理不够充分、新发感染等。换言之,良好的感染控制可让医院感染这一干扰尽可能降低,让原发疾病与重症治疗过程的脉络更为明晰,减少不必要的误判和治疗延误[20-21]。
3 小结与展望
基于重症医学科医院感染控制现状及相关问题,国内多名重症医学、感染病学及医院感染相关专家总结临床经验、复习相关文献后,从理论、管理、教育、规范、监督等多个层面提出了详细建议,以促进重症医疗质量的持续改进。但在临床工作中,仍持续不断有新的问题出现,本共识仅基于目前所得最新研究证据制订,无法指导临床工作中遇到的所有医院感染问题,未来随着医疗水平的发展,更多高质量临床研究证据将不断涌现,本共识也将不断更新和完善。
参考文献
[1]Blot S, Ruppé E, Harbarth S, et al. Healthcare-associated infections in adult intensive care unit patients: changes in epidemiology, diagnosis, prevention and contributions of new technologies[J]. Intensive Crit Care Nurs, 2022, 70: 103227.
[2]GBD 2019 Antimicrobial Resistance Collaborators. Global mortality associated with 33 bacterial pathogens in 2019: a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet, 2022, 400(10369): 2221-2248.
[3]国家卫生健康委员会. 中国抗菌药物管理和细菌耐药现状报告 (2019)[R]. 北京: 中国协和医科大学出版社, 2019.
[4]Vincent J L. Nosocomial infections in adult intensive-care units[J]. Lancet, 2003, 361(9374): 2068-2077.
[5]Fridkin S K, Welbel S F, Weinstein R A. Magnitude and prevention of nosocomial infections in the intensive care unit[J]. Infect Dis Clin North Am, 1997, 11(2): 479-496.
[6]Gikas A, Roumbelaki M, Bagatzouni-Pieridou D, et al. Device-associated infections in the intensive care units of Cyprus: results of the first national incidence study[J]. Infection, 2010, 38(3): 165-171.
[7]Burgmann H, Hiesmayr J M, Savey A, et al. Impact of nosocomial infections on clinical outcome and resource consumption in critically ill patients[J]. Intensive Care Med, 2010, 36(9): 1597-1601.
[8]Kollef M H, Torres A, Shorr A F, et al. Nosocomial infection[J]. Crit Care Med, 2021, 49(2): 169-187.
[9]Lewis S R, Schofield-Robinson O J, Rhodes S, et al. Chlorhexidine bathing of the critically ill for the prevention of hospital-acquired infection[J]. Cochrane Database Syst Rev, 2019, 8(8): CD012248.
[10]Zhao T T, Wu X Y, Zhang Q, et al. Oral hygiene care for critically ill patients to prevent ventilator-associated pneumonia[J]. Cochrane Database Syst Rev, 2020, 12(12): CD008367.
[11]Zahar J R, Lucet J C, Timsit J F. Antimicrobial resistance in intensive care units[J]. Lancet Infect Dis, 2014, 14(1): 3-5.
[12]Huang S S, Septimus E, Kleinman K, et al. Targeted versus Universal decolonization to prevent ICU infection[J]. N Engl J Med, 2013, 368(24): 2255-2265.
[13]Huang S S, Septimus E J, Kleinman K, et al. Nasal iodophor antiseptic vs nasal mupirocin antibiotic in the setting of chlorhexidine bathing to prevent infections in adult ICUs: a randomized clinical trial[J]. JAMA, 2023, 330(14): 1337-1347.
[14]Strich J R, Palmore T N. Preventing transmission of multidrug-resistant pathogens in the intensive care unit[J]. Infect Dis Clin North Am, 2017, 31(3): 535-550.
[15]Derde L P G, Cooper B S, Goossens H, et al. Interventions to reduce colonisation and transmission of antimicrobial-resistant bacteria in intensive care units: an interrupted time series study and cluster randomised trial[J]. Lancet Infect Dis, 2014, 14(1): 31-39.
[16]Nasr P. Genetics, epidemiology, and clinical manifestations of multidrug-resistant Acinetobacter baumannii[J]. J Hosp Infect, 2020, 104(1): 4-11.
[17]Chinese XDR Consensus Working Group. Laboratory diagnosis, clinical management and infection control of the infections caused by extensively drug-resistant Gram-negative bacilli: a Chinese consensus statement[J]. Clin Microbiol Infect, 2016, 22(Suppl 1): S15-S25.
[18]Giamarellou H. Multidrug-resistant Gram-negative bacteria: how to treat and for how long[J]. Int J Antimicrob Agents, 2010, 36(Suppl 2): S50-S54.
[19]Lancet Infectious Diseases. Antimicrobial resistance: the Hydra among us[J]. Lancet Infect Dis, 2015, 15(11): 1243.
[20]O’Grady N P, Alexander M, Burns L A, et al. Guidelines for the prevention of intravascular catheter-related infections[J]. Clin Infect Dis, 2011, 52(9): e162-e193.
[21]Noto M J, Domenico H J, Byrne D W, et al. Chlorhexidine bathing and health care-associated infections: a randomized clinical trial[J]. JAMA, 2015, 313(4): 369-378.
[22]Harris-Tryon T A, Grice E A. Microbiota and maintenance of skin barrier function[J]. Science, 2022, 376(6596): 940-945.
[23]Odada D, Munyi H, Gatuiku J, et al. Reducing the rate of central line-associated bloodstream infections; a quality improvement project[J]. BMC Infect Dis, 2023, 23(1): 745.
[24]Timsit J F, Baleine J, Bernard L, et al. Expert consensus-based clinical practice guidelines management of intravas-cular catheters in the intensive care unit[J]. Ann Intensive Care, 2020, 10(1): 118.
[25]Papazian L, Klompas M, Luyt C E. Ventilator-associated pneumonia in adults: a narrative review[J]. Intensive Care Med, 2020, 46(5): 888-906.
[26]陆英金, 唐运姣, 雷丽芳. 无针密闭输液接头在重症病人的应用研究进展[J]. 保健文汇, 2021, 22(9): 252-253.
[27]Amavasi B, Zimmerman P A. Infection prevention and control continuous education and training in pre-registration nursing programmes[J]. Nurse Educ Today, 2024, 133: 106051.
[28]Tsioutis C, Birgand G, Bathoorn E, et al. Education and training programmes for infection prevention and control professionals: mapping the current opportunities and local needs in European countries[J]. Antimicrob Resist Infect Control, 2020, 9(1): 183.
[29]Dergousoff B A, Vayalumkal J V, Wright N A M. Survey of infection control precautions for patients with severe combined immune deficiency[J]. J Clin Immunol, 2019, 39(8): 753-761.
[30]Mazuel M, Moulier V, Bourrel A S, et al. Systematic culture of central catheters and infections related to catheters in a neonatal intensive care unit: an observational study[J]. Sci Rep, 2024, 14(1): 8647.
[31]Schuttevaer R, Brink A, Alsma J, et al. The association of body temperature with antibiotic therapy and mortality in patients attending the emergency department with suspected infection[J]. Eur J Emerg Med, 2021, 28(6): 440-447.
[32]Kushimoto S, Gando S, Saitoh D, et al. The impact of body temperature abnormalities on the disease severity and outcome in patients with severe sepsis: an analysis from a multicenter, prospective survey of severe sepsis[J]. Crit Care, 2013, 17(6): R271.
[33]Wu Y F, Wang Y Q, Yang H M, et al. Resident bacteria contribute to opportunistic infections of the respiratory tract[J]. PLoS Pathog, 2021, 17(3): e1009436.
[34]Kadioglu A, Weiser J N, Paton J C, et al. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease[J]. Nat Rev Microbiol, 2008, 6(4): 288-301.
[35]Siegel S J, Weiser J N. Mechanisms of bacterial colonization of the respiratory tract[J]. Annu Rev Microbiol, 2015, 69: 425-444.
[36]Sharma L, Feng J J, Britto C J, et al. Mechanisms of epithelial immunity evasion by respiratory bacterial pathogens[J]. Front Immunol, 2020, 11: 91.
[37]Czarnowski M, Słowińska M, Sawieljew M, et al. Efficacy of ceragenins in controlling the growth of oral microorganisms: implications for oral hygiene management[J]. Pharmaceuticals (Basel), 2024, 17(2): 204.
[38]Engel H J, Brummel N E. What exactly is recommended for patient physical activity during an ICU stay?[J]. Crit Care Med, 2024, 52(5): 842-847.
[39]Aggarwal N, Kitano S, Puah G R Y, et al. Microbiome and human health: current understanding, engineering, and enabling technologies[J]. Chem Rev, 2023, 123(1): 31-72.
[40]Willing B P, Russell S L, Finlay B B. Shifting the balance: antibiotic effects on host-microbiota mutualism[J]. Nat Rev Microbiol, 2011, 9(4): 233-243.
[41]Sommer M O A, Dantas G, Church G M. Functional characterization of the antibiotic resistance reservoir in the human microflora[J]. Science, 2009, 325(5944): 1128-1131.
[42]Smith W P J, Wucher B R, Nadell C D, et al. Bacterial defences: mechanisms, evolution and antimicrobial resistance[J]. Nat Rev Microbiol, 2023, 21(8): 519-534.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#专家共识# #医院感染#
74