华西经验 | 肝癌5年生存率提高15%的关键是什么?
2024-12-17 肝癌在线 肝癌在线 发表于陕西省
近期,四川大学华西医院文天夫教授分享了肝细胞癌全程管理的华西经验。肝癌在线特将精华整理成文,以飨读者。
肝癌治疗全程管理的理念主要针对肝癌高危人群筛查、诊断及治疗过程中的关键环节,通过多学科诊疗的模式,基于已有的临床证据,提出并制定科学合理的病人管理诊疗计划,将筛查、诊断、治疗、随访管理等各环节进行有机整合。近期,四川大学华西医院文天夫教授分享了肝细胞癌全程管理的华西经验。肝癌在线特将精华整理成文,以飨读者。
一、肝癌全程多学科管理理念的提出
1. 肝细胞癌的概述
中国肝细胞癌每年新发病例近40万,发病人数占全球的50%左右,5年生存率仅有12.1%-14.1%,疾病负担仍然呈上升趋势[1]。因此,要完成健康中国2030规划纲要提出的肝癌总体生存率提高15%的目标,还需要做多方面的努力。
2. 肝占位性病变:门诊基本处理思路
肝占位性病变分为良性病变和恶性病变,临床上要先明确诊断,然后才考虑治疗,而不宜直接考虑手术治疗。对于肝占位病变患者,需要参考以下思路进行处理:是肝癌吗?其病因是乙肝、丙肝、肝硬化吗?有肝癌家族史吗?是否需要服用抗病毒药物,或已服用什么抗病毒药物?具有肝癌影像学检查的血供特征吗?其肿瘤标志物变化支持肝癌诊断吗?如果临床诊断为肝癌,那么患者的美国东部肿瘤协作组体力状况评分(ECOG PS)、肝功能以及血细胞水平也需要进行评估。
3. 华西医院在提出肝癌全程多学科管理过程中所做的工作
自2013年起,华西医院肝脏外科每天晨交班后都会进行手术术前讨论和疑难病例讨论。肝脏外科拥有肝脏移植、肝切除术、射频消融术、TACE/HAIC、靶向治疗和免疫治疗等所有肝癌治疗资质和临床治疗技术,几乎是一个多学科协作诊疗(MDT)团队。
2015年,华西医院开设规范的肝癌MDT,本院肝癌MDT团队理顺了临床医师对肝癌患者诊治的思路和环节,集中研究证据与经验,撰写了《肝细胞癌切除术后复发转移的防治:华西医院多学科专家共识》[2],随后联合国内其他中心专家和欧美、日、韩专家反复讨论修改,发表了肝癌切除术后复发转移多学科诊治的国际共识[3]。
肝癌的全程规范化管理可以从四个阶段来看:门诊与术前、肝癌围术期、肝癌手术后、复发与转移。在复发和转移阶段,华西医院提出的复发性肝癌治疗路线图得到了英国专家的高度评价:是第一次收集复发性肝癌的证据并以指南方式推荐[4]。
二、肝癌5年生存率提高15%的关键1-肝癌转化切除体系的完善
肝癌5年生存率提高15%的关键在于70%的不可切除的中晚期肝细胞癌患者,而不在于30%的可切除的早中期患者。
到目前为止,手术切除仍然是肝细胞癌首选和最可能治愈的治疗方法。肝癌患者初诊时不能切除,经过一种或联合多种治疗后,达到R0切除标准并进行第二步切除,称为转化切除。转化切除是提高肝细胞癌切除率的重要途径。
1. 经导管肝动脉化疗栓塞(TACE)是目前最常用的肝癌局部治疗方法,可以降低肿瘤负荷。
1)病例一:肝细胞癌患者经TACE后转化切除。如图1所示,患者于2010年4月和6月分别进行2次介入,甲胎蛋白从大于1210ng/ml逐渐下降到正常,到2012年7月依然正常。2013年4月,患者AFP又大于1210ng/ml,CT发现左外叶肿块,评估后手术切除,至今存活。
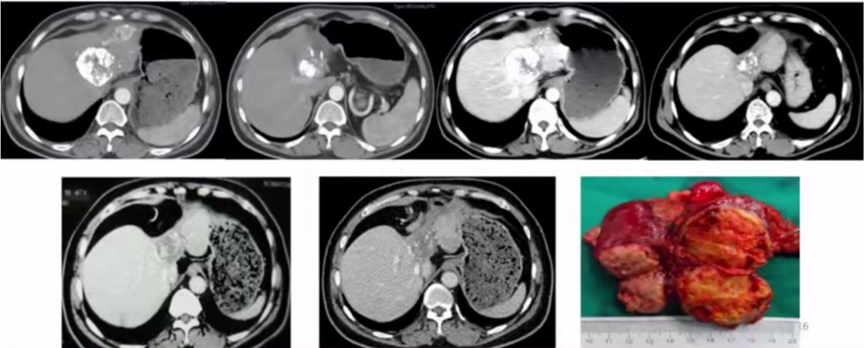
图1. 肝细胞癌患者经TACE后转化切除
2)病例二:肝细胞癌合并门静脉癌栓的患者经TACE后转化切除(图2)。2016年,文天夫教授团队总结临床队列的数据发现,适当增加TACE的次数可以增加转化后的切除率,从而改善预后[5]。
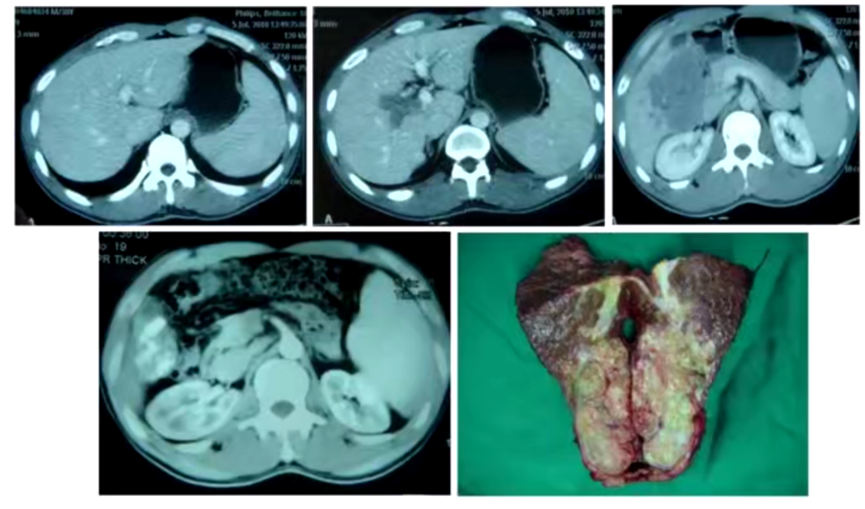
图2. 肝细胞癌合并门静脉癌栓的患者经TACE后转化切除
3)病例三:伴门脉主干癌栓肝细胞癌患者经靶向联合TACE转化切除。如图3所示,一例伴门脉主干癌栓肝细胞癌患者经仑伐替尼联合TACE治疗3个月后,甲胎蛋白332ng/ml降到49ng/ml;异常凝血酶原1486μg/L降到344μg/L;左肝癌缩小,门脉癌栓明显回缩。随后进行左半肝及尾叶切除,至今仍在随访中。
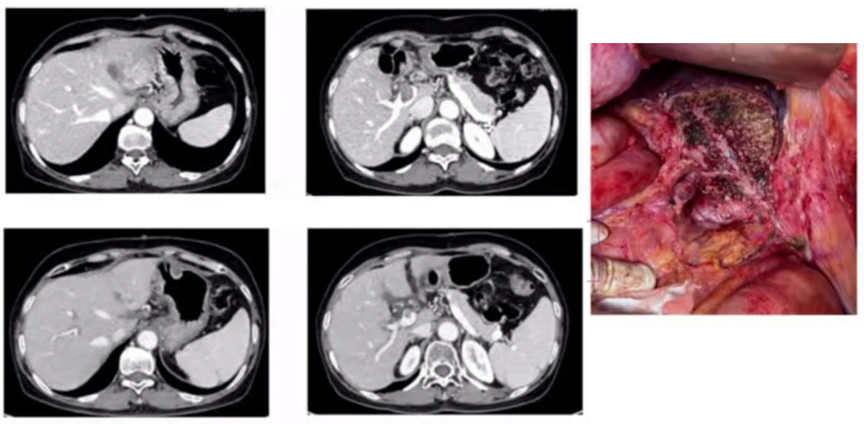
图3. 伴门脉主干癌栓肝细胞癌患者经靶向联合TACE转化切除
1997年,Bismuth团队提出“降期”的概念,但至今广泛应用的BCLC肝癌分期的初次提出是于1999年,因此用“降期”的概念值得商榷,可能用“转化”的概念更符合肿瘤学情况。随着药物和放疗技术的进步,转化治疗还表现出具有转化肿瘤的生物学行为的作用,可以让不可控的生物学行为转化为可控,最后甚至治愈肿瘤。
2. 肝静脉系统栓堵术(LVD)可以增加剩余肝体积达到转化切除
1位术前诊断为中央型肝癌(Ⅴ、Ⅷ段交界处)的53岁男性患者,因剩余肝脏体积(FLR)不足,无法行标准右半肝切除术,而行LVD术诱导FLR增生。LVD术后1、2及3周评估患者一般情况并复查腹部CT,评估FLR体积和剩余肝脏/体质量比。结果显示,患者LVD术前FLR为24.2%,剩余肝脏/体质量比为0.459%;LVD术后第1、2及3周复查FLR,分别为29.5%、38.3%和44.4%,剩余肝脏/体质量比分别为0.545%、0.707%和0.820%。患者于LVD术后第25天顺利施行了标准右半肝切除术,术后安全康复出院。
由此可见,LVD可使剩余肝脏体积快速增大,可让预计FLR不足的肝癌患者有接受第二阶段根治性手术治疗的机会,是一项有效诱导FLR增生的新技术。
3. 仑伐替尼联合TACE和PD-1单抗(LEN-TAP)可提高中晚期肝癌转化切除率
本研究团队牵头了一项LEN-TAP方案对比TACE在中晚期不可切除肝癌转化切除的安全性和有效性的多中心、开放、前瞻性队列研究。这项研究将起始不可切除的中晚期肝癌患者(BCLC B期和C期)分成试验组(转化治疗方案为LEN-TAP方案)和对照组(转化治疗方案为单TACE治疗)。自2020年10月至2022年3月,共有来自国内8家医院142名患者被纳入到本项研究。
结果显示LEN-TAP组和单TACE组的转化切除率分别为50.7%(36/71)和15.5%(11/71),P<0.001。LEN-TAP组和单TACE组客观缓解率和疾病控制率分别为78.9%和16.9%(P<0.001)、94.4%和43.7%(P<0.001)。在安全性方面,两组均无4级及以上不良事件(AE)发生。截止2022年4月,LEN-TAP组的3级AE发生率高于单TACE组(P<0.001),最常见的AEs为腹痛、血小板减少、转氨酶升高、高血压、食欲下降、恶心和蛋白尿,均为可以处理的不良反应。
由此可见,LEN-TAP方案用于不可切除中晚期肝癌患者的转化切除是安全有效的,可显著提高不可切除中晚期肝癌的可切除率,延长患者的总体生存时间。
4. 肝癌转化治疗待明确的问题
在肝癌转化治疗上,目前还有一些未解决的问题。如哪些患者适合转化治疗?如何进行转化治疗的疗效预测?转化治疗深度及手术时间窗怎么确定?转化治疗效果好的病人,哪些不做手术就可长期生存?转化切除病人辅助治疗的方案与时间如何确定?目前,现有的证据还不能完全回答这些问题,因此还需要更多临床试验、更大样本量、更长时间的随访结果来逐渐阐明。
三、肝癌5年生存率提高15%的关键2-识别高危人群与筛查
在我国,肝癌高危人群主要包括:具有乙型病毒性肝炎(HBV)和/或丙型病毒性肝炎(HCV)感染、过度饮酒、非酒精性脂肪性肝炎、其它原因引起的肝硬化,以及有肝癌家族史等人群,尤其是年龄>40岁的男性风险较大。尽管抗HBV和抗HCV病毒治疗可以显著降低肝癌的发生风险,但是仍然无法完全避免肝癌的发生[6]。
由我国学者研发的适用于多种慢性肝病和各种族的肝癌风险评估模型aMAP评分,可以便捷地将肝病人群分为肝癌低风险(0-50分)、中风险(50-60分)和高风险(60-100分)组,各组肝癌的年发生率分别为0%~0.2%、0.4%~1%、1.6%~4%,有助于确定肝癌的高风险人群[7]。
据Polaris国际流行病学合作组织推算,2016年我国HBsAg流行率为6.1%,慢乙肝患者有8600万,而我国慢乙肝诊断率仅为有22%,治疗率仅有15%,2030消除病毒性肝炎公共卫生危害挑战巨大。基层医院相关医生需要明确任务和责任,做好乙肝/丙肝/代谢性肝病患者的注册和督促工作;要创新医疗卫生服务供给模式,坚持以基层为重点,以改革创新为动力,预防为主;要建立专业公共卫生机构、综合和专科医院、基层医疗卫生机构“三位一体”的重大疾病防控机制,建立信息共享、互联互通机制,推进慢性病防、治、管整体融合发展,实现医防结合。我们期望,经过未来的探索和努力,可以大大提高肝癌患者的生存率。
参考文献
[1] Zhong J H, Peng N F, You X M, et al. Tumor stage and primary treatment of hepatocellular carcinoma at a large tertiary hospital in China: A real-world study[J]. Oncotarget, 2017, 8(11): 18296-18302.
[2]四川大学华西医院肝癌mdt团队. 肝细胞癌切除术后复发转移的防治:华西医院多学科专家共识[J]. 中国普外基础与临床杂志, 2017, 24(8): 927-939.
[3] Wen T, Jin C, Facciorusso A, et al. Multidisciplinary management of recurrent and metastatic hepatocellular carcinoma after rep: an international expert consensus[J]. Hepatobiliary Surg Nutr, 2018, 7(5): 353-371.
[4] Erridge S, Sodergren M H. The Chengdu system for recurrent hepatocellular carcinoma: A step in the right direction[J]. Hepatobiliary Surg Nutr, 2019, 8(3): 298-300.
[5] Lei J Y, Zhong J J, Yan L N, et al. Response to transarterial chemoembolization as a selection criterion for rep of hepatocellular carcinomas[J]. Br J Surg, 2016, 103(7): 881-890.
[6] 中华人民共和国国家卫生健康委员会. 原发性肝癌诊疗指南(2022年版)[J]. 肿瘤综合治疗电子杂志, 2022, 8(2): 16-53.
[7] Fan R, Papatheodoridis G, Sun J, et al. aMAP risk score predicts hepatocellular carcinoma development in patients with chronic hepatitis[J]. J Hepatol, 2020, 73(6): 1368-1378.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肝癌# #生存率#
10