常用来煲靓汤的ta,居然可能多机制调血脂,并减少脂肪细胞分化!
2021-12-17 LILYMED MedSci原创
Lipids in Health and Disease:虫草多糖CM1抑制LDLR(+/−)仓鼠脂肪细胞分化,减轻高脂血症。
高脂血症是心血管疾病(CVD)的致病因素。目前,降胆固醇药物,如他汀类药物和PCSK9抗体,在CVD的预防和治疗中起重要作用。此外,依折麦布已用于抑制肠道中胆固醇的重吸收。然而,目前的降脂药物无法完全延缓CVD的进展。近年来,已有大量研究旨在将食品中的天然化合物用于降脂,而它们的毒性水平也可能较低。
食用菌虫草主要在亚洲国家食用,在华南地区经常用作汤料。与中国北方地区相比,中国这一地区的每10万人动脉粥样硬化性CVD死亡率也较低(65.0 vs 121.2)。虽然没有直接证据表明虫草的子实体可以降低人类的动脉粥样硬化性CVD,但动物实验大量证据表明冬虫夏草属的水提取物具有各种生物活性,包括抗高脂血症和抗动脉粥样硬化作用。但现有数据,通常使用冬虫夏草物种的粗提取物而不是纯化的多糖,此外,小鼠的脂质代谢与人类不同,先前研究中的治疗时间也通常少于2个月。由于高脂血症需要长期干预,因此有必要厘清这些多糖在脂质谱更接近人类的动物中的降脂作用和机制,并基于更长的干预时间。

在本研究中,LDLR(+/−)仓鼠的脂质谱与人类相似,用于探索长期使用虫草多糖CM1在减轻高脂血症和调节脂质代谢相关基因和蛋白质方面的作用。


1、CM1干预缓解高脂血症
LDLR(+/−)仓鼠有常染色体遗传性高胆固醇血症。NC、HFD、依折麦布和CM1组仓鼠的体重在进食5个月后分别增加了约29.1%、40.4%、41.0%和32.1%(图1C, P < 0.01)),虽然各组之间的平均食物摄入量没有明显差异(图1D),CM1干预显著降低了仓鼠的最终体重(图1C, P < 0.05)。值得注意的是,HFD显着增加了仓鼠平均血浆TC(图。2A,128.8 vs 393.9 mg / dL)和TG(图2B, 104.6 vs 238.5 mg/dL) (P < 0.01).与先前的研究一致,依折麦布还显着降低了升高的血浆TC水平约72%,TG水平降低了约49%(P<0.01)。 CM1干预显着降低了血浆TC水平约28%(图2A,283.2vs393.9 mg / dLP<0.05,),TG水平约为16%(图2B,201.2 vs 238.5mg / dL)。此外,CM1干预显著降低低密度脂蛋白(LDL)和高密度脂蛋白(HDL)胆固醇水平(图2C),它还降低了极低密度脂蛋白(VLDL)组分中的TG水平(图2D)。
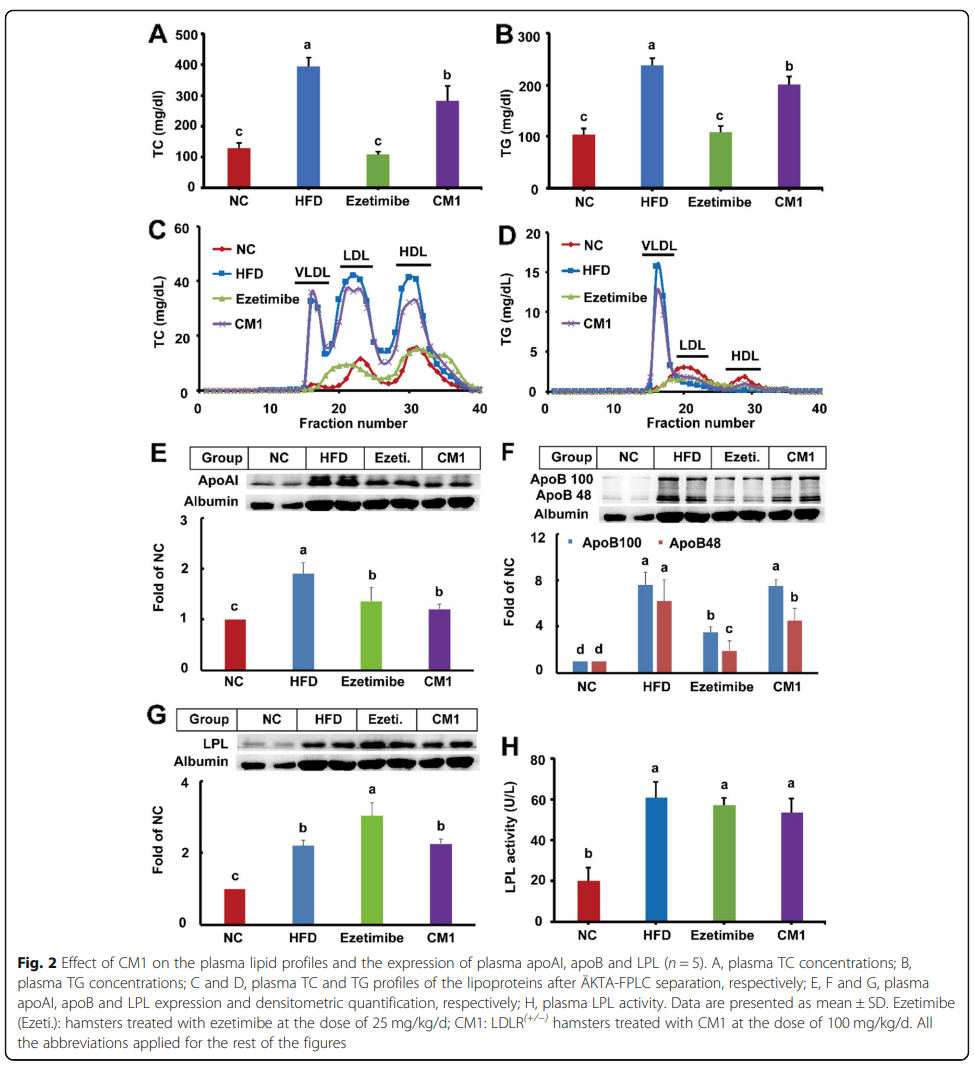
与高密度脂蛋白胆固醇一致,HFD显着提高了血浆apoAI水平(图2E, P < 0.01)。值得注意的是,依折麦布和CM1干预分别使升高的血浆apoAI水平降低了约29%和〜36%(图2E, P < 0.05)。仓鼠具有apoB100和apoB48,它们主要由非HDL粒子携带。 依折麦布使升高的血浆apoB100和apoB48水平分别降低了约54%和69%(图2F,P <0.01)。虽然CM1干预对apo100的血浆水平没有影响,但该分子显着降低了apoB48的血浆水平27%(图2F, P < 0.05)。血浆apoB48的改变与TG的血浆水平一致。HFD还将血浆LPL水平提高了119%(图2G, P < 0.01)。值得注意的是,依折麦布干预显着使血浆LPL蛋白的水平升高了近38%(P<0.05)。然而,CM1干预不影响血浆LPL水平(图2G)。此外,HFD显著提高血浆LPL活性(图2H, P < 0.01)。在这项研究中,依折麦布和CM1干预均影响血浆LPL活性(图2H)。
2、CM1干预调节肝脏基因
SREBP-2调节PCSK9和LDLR等多个基因的表达,这些基因在转录水平参与胆固醇代谢。 HFD使SREBP-2和PCSK9的基因表达分别显着降低了约26%和78%(图3A 和B,P < 0.01)。与HFD组相比,依折麦布使SREBP-2的基因表达增加了约2.8倍(图3A,P<0.01)和PCSK9增加〜3.8倍(图3B,P<0.01)。 值得注意的是,CM1干预分别使SREBP-2和PCSK9的mRNA水平降低了约88%和80%(图3A 和B,P < 0.01)。此外,与依折麦布治疗相比,CM1干预也显着降低了这些基因的表达(图3A 和B,P < 0.01)。因此,CM1可能在转录水平上降低胆固醇合成。

LXRα是胆固醇代谢的重要调节剂。HFD不影响本研究中LXRα的基因表达(图3C。)然而,HFD使SREBP-1c的mRNA水平显着提高了约32倍(图3D, P < 0.001)。依折麦布处理显著降低了LXRα的基因表达28%(P<0.05)和SREBP-1c的基因表达降低了80%(P < 0.01)(图3C和D)。CM1使SREBP-1c的基因表达降低了约61%(图3D,P <0.05),但为降低LXRα(图3C)。
3、CM1干预改善了CYP7A1和ABCG5的水平
HFD显著提高了LDLR蛋白1.6倍和PCSK9蛋白53%,但对SR-BI和SREBP-2无显著影响(图4A-D)。然而,依折麦布或CM1对SR-B1没有影响(图4A)。值得注意的是,依折麦布使LDLR的蛋白表达降低了64%(图4B, P < 0.01)。与依折麦布相比,CM1显着增加了LDLR蛋白量(图4B, P < 0.05)。如图4D所示,CM1显著降低PCSK9的表达(38%,P<0.05),可促进LDLR降解。依折麦布和CM1干预组LDLR蛋白的变化与PCSK9的变化一致。此外,SREBP-2的表达在依折麦布或CM1干预组中没有显着差异(图4C)。
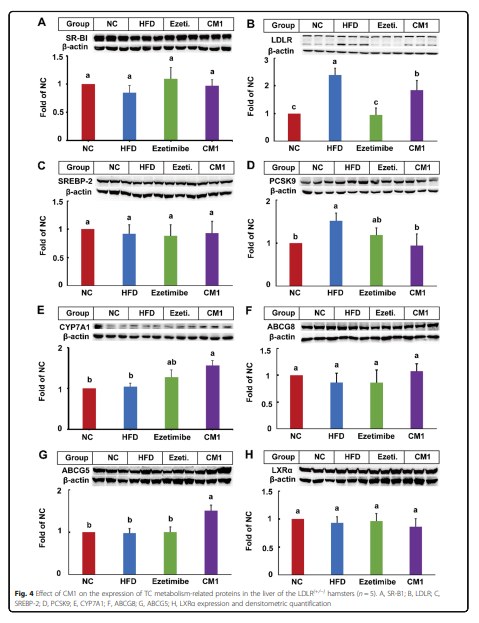
CYP7A1是胆汁酸合成的关键酶。CM1处理,但不是依折麦布,显着提高了CYP7A1蛋白的数量(图4E, P < 0.05)。肝脏中一部分胆固醇代谢物被运输到胆囊排泄。 在本研究中,HFD和CM1对ABCG8和LXRα蛋白没有影响(图4F 和 H)。然而,与HFD或依折麦布治疗组相比,CM1治疗显着提高了肝ABCG5蛋白的量(图4G, P < 0.05)。在肝脏中,CM1干预未影响NPC1L1蛋白水平(图5A),而NPC1L1蛋白介导了胆道胆固醇的再吸收。
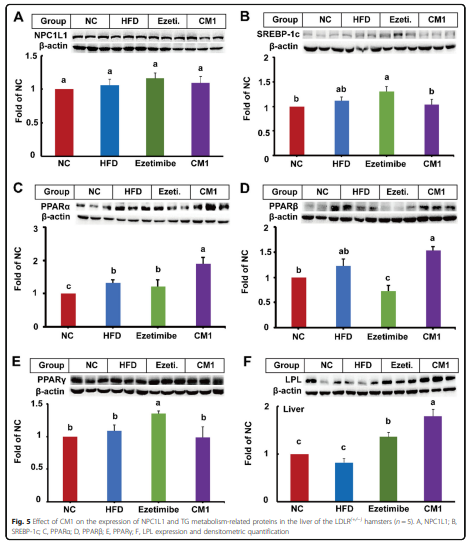
4、CM1干预调节LDLR(+/−)仓鼠肝脏中TG代谢相关蛋白
与NC组相比,HFD提高了PPARα蛋白的水平(图5C, P < 0.05)。与HFD组相比,依折麦布对SREBP-1c和PPARα蛋白没有影响(图5B 和 C)。然而,依折麦布使PPARβ的表达降低了约40%(图5D,P<0.05),PPARγ和LPL蛋白的水平分别提高了35%和43%(图15E 和F,P < 0.05)。值得注意的是,CM1干预使PPARα蛋白的水平提高了约43%(图5C,P<0.05),但不是SREBP-1c,PPARβ或PPARγ(图5B、D 和 E)。此外,与依折麦布干预相比,CM1干预显着增强了PPARβ蛋白的表达(图5D, P < 0.01)。再者,CM1还将LPL蛋白的表达提高了70%(图15F,P<0.01)。
5、CM1干预抑制了NPC1L1和SREBP-2的蛋白表达,增强了肠道中的LXRα/ABCG8
HFD使NPC1L1的mRNA表达增加了约74%(图6A, P < 0.05)。然而,依折麦布或CM1干预对NPC1L1的mRNA表达没有影响。此外,HFD显著降低了LXRα和ABCG8的mRNA表达,分别降低了92和41.5%(图6B和C)。与高脂肪饮食组相比,依折麦布降低了73.8% ABCG8的mRNA水平,但没有降低LXRα的mRNA水平(图6c)。相反,与HFD组比较,CM1干预使LXRα和ABCG8 mRNA表达量分别增加15.8倍和1.6倍(图6B和C, P< 0.01)。与依折麦布相反,CM1干预还增强了LXRα和ABCG8的mRNA表达(P <0.01,图6B 和 C)。

与NC组相比,HFD使NPC1L1蛋白的表达增加了约4.6倍(图6D, P < 0.01)。在本研究中,依折麦布干预对NPC1L1蛋白没有影响。依折麦布可防止甾醇诱导的NPC1L1内化。值得注意的是,CM1治疗降低了升高的NPC1L1蛋白约39.5%(图6D, P < 0.05)。HFD还能提高ABCG8蛋白水平(P<0.01)并降低LXRα蛋白(P <0.05)(图6E 和 F)。与HFD组相比,CM1干预显着提高了ABCG8蛋白的水平(图6F,P<0.05)。 此外,与NC组相比,此外,HFD 干预使SREBP-2蛋白水平提高了48%(P<0.05)(图16G)。依折麦布显着降低了升高的SREBP-2达42%(图6G, P < 0.05)。同样,与HFD组相比,CM1干预使SREBP-2的表达降低了64%(图6G,P<0.01)。 CM1对SREBP-2的抑制作用大于依折麦布(降低38%,图6G, P < 0.05)。
6、CM1调节附睾脂肪中的脂质代谢
在本研究中,HFD使LDLR(+/−)仓鼠的脂肪垫指数提高了约74%(图7A, P < 0.01)。CM1处理使脂肪垫指数升高约39%(P<0.05)。HFD还使脂肪细胞的直径增加了28.3%(P<0.01),而CM1处理使脂肪细胞的直径直径降低34.9%(图7B 和C,P < 0.01)。此外,HFD使附睾脂肪中PPARα和SREBP-1c蛋白的表达分别降低了约48和38%(图7D和F, P < 0.05)。值得注意的是,ezetimibe显著降低了37%的SREBP-1c表达(图7F),提高了58%的PPARα和75%的PPARγ表达(图7D和E)。同样,与HFD组相比,CM1干预使SREBP-1c的表达降低了49%(P<0.05),PPARα水平提高了46%(P<0.05),降低了PPARγ蛋白水平约67%(图7E, P < 0.01)。在脂肪组织中,ATGL促进TG的水解和脂肪酸的产生,从而在能量稳态中起重要作用。如图7G所示,HFD较常规饲料显著降低了ATGL蛋白约38%。与HFD组相比,依折麦布或CM1干预分别使ATGL蛋白水平分别提高了50和65%(图7G,P < 0.05)。

7、CM1降低了体外脂滴的形成
如图8A所示,胰岛素成功诱导了3T3-L1细胞脂滴的形成,而CM1干预明显降低了脂滴形成。本研究空白组未见脂滴形成。因此,仅与分化组比较CM1干预的效果。
统计表明,CM1干预平均减少了54.2%的脂滴数量(P<0.01)。它还使脂滴的平均直径减少了29.7%(图8C, P< 0.01)。在分化组中,PPARγ的mRNA表达增加了13.7倍(图8E, P < 0.01)。此外,与空白组相比,硬脂酰辅酶A去饱和酶1(SCD1),二酰基甘油酰基转移酶(DGAT)1和2的水平分别增强了1.4倍(P <0.01),55.8%(P<0.05)和1.4倍(P <0.01)(图8H、I和J)。PPARα siRNA显着降低了PPARα的mRNA表达约59%(P <0.05),而CM1干预使PPARα的mRNA表达增加了约72%(P <0.05,图8 d)。与空白组相比,分化组脂肪酸合酶(FAS)和乙酰辅酶A羧化酶1(ACC1)的基因表达下降约29%(图8F和G,P < 0.05)。上述结果进一步证明,PPARγ对脂肪细胞分化具有重要意义。值得注意的是,CM1干预使PPARγ,DGAT1和DGAT2的mRNA表达降分别低了83.8%(图8E, P < 0.01), 43.8% (图8I,P<0.05)和74.7%(图8J,P< 0.01)。此外,与分化组相比,CM1干预不影响PPARα,SCD1,FAS和ACC1的mRNA表达。

综上,从图9中可以看出,这种生物活性多糖CM1可以通过几种可能的机制缓解LDLR(+/−)仓鼠体内的高脂血症和脂肪细胞分化:
- 增加CYP7A1和ABCG5/8的水平,这可能分别有助于胆固醇的潜在转化和排泄。
- CM1降低了肠道内NPC1L1和SREBP-2蛋白的表达,这可能导致胆固醇吸收和合成的潜在减少。
- 通过提高肝脏中LPL和PPARα的水平,并降低小肠中apoB48的产生,来降低TG。
- CM1干预通过调节附睾脂肪中的多个分子,潜在地导致脂肪细胞分化的减少。

总的来说,这项长期研究首次证明,来自虫草子实体的多糖CM1通过多种途径对LDLR(+/−)仓鼠的高脂血症显著的降低作用。这些研究结果表明,虫草多糖CM1可作为单药或与其他降脂化合物联合用于治疗脂质异常患者,也可补充CM1作为食品添加剂用于高脂血症患者的日常护理。本研究虫草多糖在食品和制药领域具有潜在应用前景。
原文来源:
Yu et al. Polysaccharide CM1 from Cordyceps militaris hinders adipocyte differentiation and alleviates hyperlipidemia in LDLR(+/−)
hamsters. Lipids in Health and Disease (2021) 20:178
https://doi.org/10.1186/s12944-021-01606-6.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#脂肪细胞分化#
87
虫草买起来!!!!!!
86
学习#心血管#
140
#脂肪细胞#
121
#细胞分化#
100
学习
97
学习
2