Circ Res:SNAIL 对 LRP1 的抑制导致血管疾病遗传风险中的 ECM 重塑
2024-10-13 刘少飞 MedSci原创 发表于上海
研究背景:全基因组关联研究(GWAS)表明,LRP1(低密度脂蛋白受体相关蛋白1)基因位点中的常见遗传变异与多种血管疾病和相关特征的风险有关。然而,潜在的生物学机制仍不清楚。

研究背景:全基因组关联研究(GWAS)表明,LRP1(低密度脂蛋白受体相关蛋白1)基因位点中的常见遗传变异与多种血管疾病和相关特征的风险有关。然而,潜在的生物学机制仍不清楚。
研究方法:通过精细定位分析,包括贝叶斯共定位,确定最可能的致病变异。利用CRISPR-Cas9对人类诱导多能干细胞进行基因编辑,删除或修改候选增强子区域,并生成LRP1敲除细胞系。这些细胞通过中胚层谱系分化为平滑肌细胞。使用荧光素酶报告基因检测、转录因子敲低和染色质免疫共沉淀(ChIP)来评估转录调控。通过细胞实验、大规模RNA测序和质谱分析来评估细胞表型的变化。
研究结果:多特征共定位分析显示rs11172113是与纤维肌发育不良、偏头痛、脉压和肺功能特征相关的LRP1最可能的致病变异。我们发现rs11172113-T等位基因与更高的LRP1表达相关。通过诱导多能干细胞来源的平滑肌细胞的基因组删除实验,支持rs11172113位于调控LRP1表达的增强子区域。我们发现转录因子MECP2(甲基CpG结合蛋白2)和SNAIL通过等位基因特异性机制抑制LRP1表达,涉及SNAIL与疾病风险等位基因的相互作用。LRP1敲除导致诱导多能干细胞来源的平滑肌细胞增殖和迁移能力下降。差异表达基因富集于含有胶原的细胞外基质、结缔组织发育和肺发育。LRP1敲除以及rs11172113增强子删除显示TGF-β(转化生长因子β)信号通路的增强,表现为SMAD2/3的磷酸化水平升高。脱细胞提取物的蛋白质成分分析显示部分细胞外基质重塑,涉及已知与LRP1结合并参与血管完整性的配体CYR61的分泌增加,以及与细胞外基质维持相关并与LRP1相互作用的TIMP3的分泌增加。
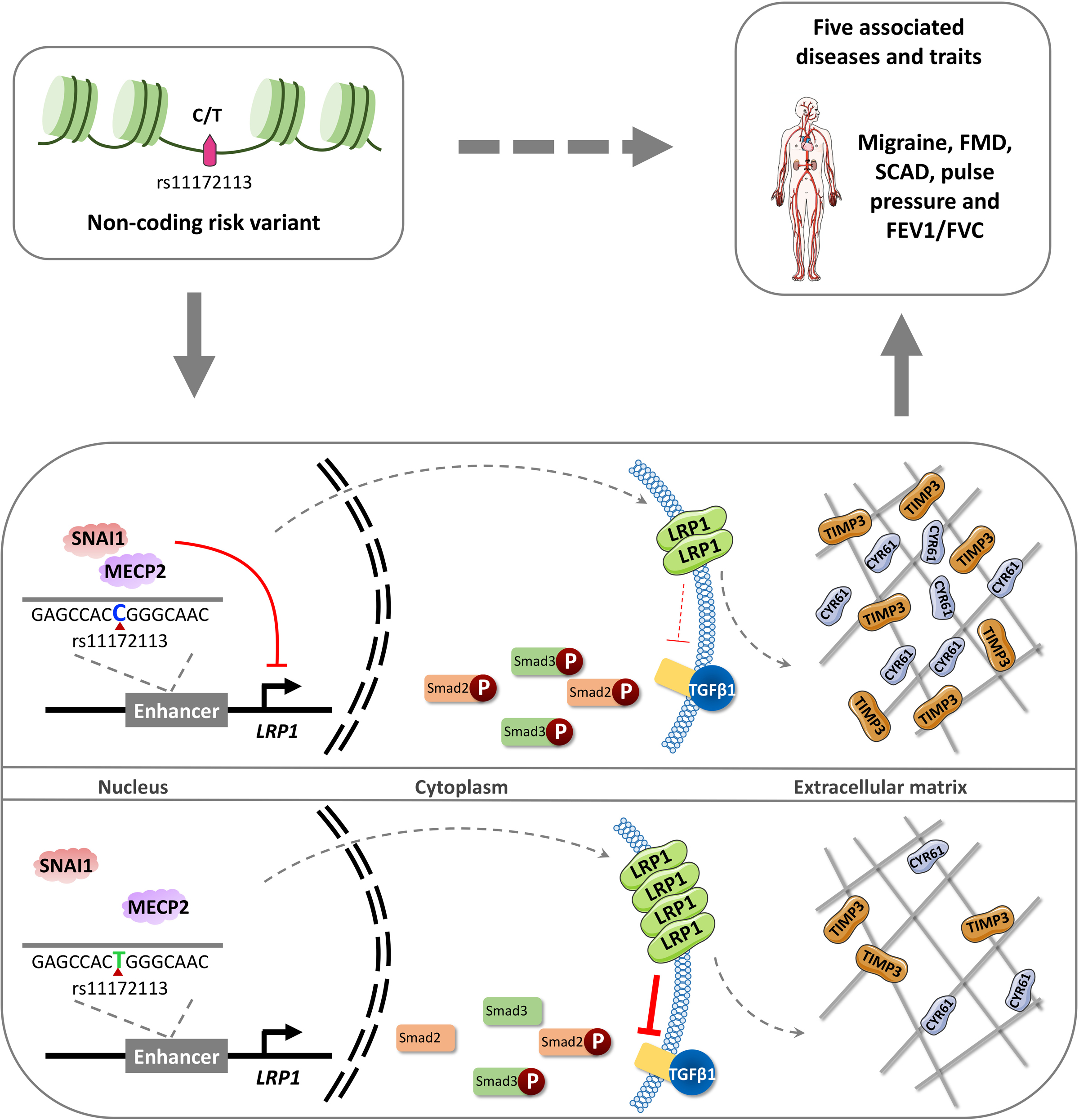
研究结论:我们的研究结果支持由内皮-间质转化调节因子SNAIL介导的等位基因特异性LRP1基因抑制。我们提出,平滑肌细胞中LRP1表达的降低通过TGF-β信号通路增强的细胞外基质重塑,可能是该多效性基因位点与血管疾病相关的潜在机制。
参考文献:
Liu L, Henry J, Liu Y, Jouve C, Hulot JS, Georges A, Bouatia-Naji N. LRP1 Repression by SNAIL Results in ECM Remodeling in Genetic Risk for Vascular Diseases. Circ Res. 2024 Oct 2. doi: 10.1161/CIRCRESAHA.124.325269. Epub ahead of print. PMID: 39355906.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#血管疾病# # LRP1 #
27