神经科学顶级期刊《NEURON》重磅综述:糖尿病神经病变新视角
2023-06-21 代谢网 代谢网 发表于上海
改为文章为理解高血糖和血脂异常如何共同诱发DPN的生物能量衰竭建立框架,并总结了基于最新机制的靶点研究,为DPN潜在的治疗开辟了新道路。
糖尿病周围神经病变(DPN)是糖尿病最常见的微血管并发症,目前国内外对其筛查率、诊断率和治疗率均处于较低水平。几十年来葡萄糖代谢一直是探索DPN病理生理的研究重点,而脂质异常作为其病理生理改变的关键因素在近期也受到极大的关注。
越来越多新兴研究表明血脂异常是DPN的主要发病机理,其中血浆甘油三酯水平升高与2型糖尿病神经病变进展有关,而肥胖和全身性血脂异常则与神经病变的风险增加独立相关。
2023年5月19日,“神经科学”子行业的顶级杂志《NEURON》在线发表一篇题为“New perspectives in diabetic neuropathy”的重磅综述,为理解高血糖和血脂异常如何共同诱发DPN的生物能量衰竭建立框架,并总结了基于最新机制的靶点研究,为DPN潜在的治疗开辟了新道路。

1.DPN病理生理学
基于近年来关于DPN的机制研究,总结出高糖与高脂参与糖尿病神经病变的机制代谢通路如下(图1)。在DPN期间,周围神经出现胰岛素抵抗,施旺细胞和轴突的胰岛素受体不再对胰岛素作出反应。胰岛素抵抗破坏了施旺细胞和轴突的新陈代谢,例如,mTORC1信号传导迟钝。在施旺细胞中,mTORC1信号的迟钝可能会影响乳酸通过单羧酸盐转运器向轴突的穿梭。过量的长链饱和脂肪酸增加了施旺细胞中的脂毒性酰基肉碱,它可能转移到轴突。高血糖会引发ROS的氧化应激和施旺细胞的病理性细胞外囊释放,从而加速DPN的发展。
在轴突中,高血糖将糖酵解的中间能量代谢物分流到多元醇和己糖胺途径。高血糖和血脂异常使线粒体膜去极化,减少ATP的产生,并产生ROS。长链饱和脂肪酸损害了线粒体的移动。ATP水平降低加上线粒体数量减少导致生物能量衰竭,引发远端-近端神经损伤,在临床上表现为DPN。
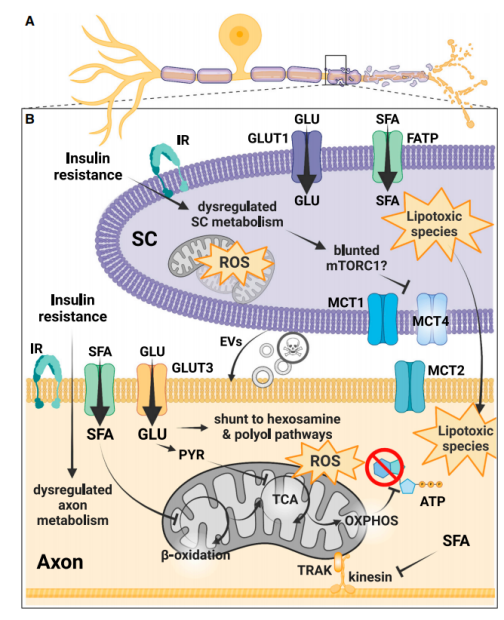
图1. DPN病理生理学和生物能量学衰竭
2.靶向性治疗DPN的新兴方法
2.1. 能量和线粒体途径
前面已经提及,由于生物能量衰竭是DPN的一个重要特征,至今为止人们已经做了许多伟大尝试来提高周围神经系统的能量途径。包括AMPK激动剂和PPAR的激动剂,后者激活了脂肪酸的摄取和分解代谢。另一个靶点是SARM1,这是一个具有NADPase活性的代谢压力传感器,是神经轴突变性的关键媒介。尽管SARM1敲除后能改善一些神经指标,但SARM1对DPN进展的作用仍不确定。
线粒体解偶联也被作为一种潜在的方法来研究,通过使线粒体呼吸脱离能量生产,扩大可用于脂肪酸氧化和TCA循环的NADH和FADH2的储备,来减轻DPN。然而,最新的研究却发现解偶联剂烟酰胺乙醇胺并不能改善小鼠的DPN。靶向脂质能量代谢和线粒体途径改善DPN的相关研究的效果尚缺乏一致性。
2.2 降脂
预防DPN的一个可能途径是管理胆固醇和TG水平。他汀类药物是3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂,它可以阻断胆固醇的合成,通过发挥降脂和多生物效应(如内皮激活、抗炎效应和抗氧化效应)降低DPN的风险。但研究报告显示,使用他汀类药物对神经功能会同时产生有益和有害的影响,可能的原因为过度调脂后导致体内胆固醇合成减少,而胆固醇又是髓鞘的重要组成部分,反过来对神经功能产生损害。
2.3 抗炎和/或抗氧化剂
一般的抗氧化剂对DPN的具有疗效,如α-硫辛酸,但由于临床试验结果不一,长期疗效仍不确定。近年来研究的重点是有针对性的抗炎药物,如米诺环素,或抗氧化剂如Noxs和黄嘌呤氧化酶的抑制剂。
总的来说,对于迄今为止研究的很多DPN候选靶点,在啮齿动物中的有效性还没有在人类中得到进一步验证。值得注意的是,基于机制目标在小鼠和人类DPN中并不完全一致,这对潜在疗法的临床转化构成了挑战。可能存在几个原因:
1)药物不是组织特异性的,由于不同的潜在病理生理学和代谢状态,对容易发生并发症的组织产生不同的影响。这说明有必要确定葡萄糖和脂肪毒性的细胞和亚细胞目标,以达到充分的疗效;
2)药物可以发挥独立于其能量调节或降糖和降脂特性的多效作用,这可能对神经有害;
3)最后,由于多因素的DPN病理生理学,单一靶向药物可能不足以减轻神经损伤。
2.4 生活方式干预
目前对于DPN的预防和管理已经从单纯的以葡萄糖为中心转向多因素的方法,也包括肥胖和血脂异常。美国糖尿病协会推荐用饮食和运动来控制2型糖尿病和代谢综合征,并将其视为DPN的一线治疗。尽管大多数非随机研究的早期临床证据表明运动能够带来获益。但目前大型的随机对照试验还很稀少。值得注意的是,DPN可以通过运动得到改善,并与明显的体重减轻或血糖状况的改善无关,这表明除了系统性的变化外,运动后神经微环境的改变对DPN起到重要作用。
3.DPN未来发展方向
过去十余年的研究探索使DPN的病理生理学展现出了全新的视角。虽然高血糖是仍然主要焦点,但最近的研究阐明了血脂异常对神经功能障碍的重要影响,这与独特的周围神经解剖结构中生物能量衰竭的类似主题相一致。越来越多的代谢组学和人工智能可能有助于阐明DPN的多因素和复杂的病理生理学。高血糖和血脂异常参与DPN的病理生理学,导致了对潜在治疗方法的重新定位,对患者的治疗产生极大影响。另外,人们对通过饮食干预、药物或手术减重以及运动干预对DPN疗效的随机临床试验抱有很大兴趣,这也将是DPN治疗的未来发展方向。
文献来源:
Eid SA, Rumora AE, Beirowski B, et al. New perspectives in diabetic neuropathy [published online ahead of print, 2023 May 19]. Neuron. 2023;S0896-6273(23)00345-8. doi:10.1016/j.neuron.2023.05.003
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言