Nature:过氧化物酶体介导肿瘤对铁死亡的敏感性
2020-09-17 haibei MedSci原创
研究人员在Nature杂志发文,其使用全基因组的CRISPR-Cas9抑制剂筛选,发现氧化性细胞器过氧化物酶体是人类肾癌和卵巢癌细胞的铁死亡敏感性的关键贡献者。
铁死亡是一种铁依赖性,区别于凋亡的细胞死亡过程,其参与各种退行性疾病,并代表了某些癌症的可靶向的易感性。铁死亡易感性细胞状态可以预先存在于某些谱系的细胞中,并在细胞状态转换过程中获得。然而,确切地说,至今为止,我们对于铁死亡易感性的动态调节仍然是不太了解。

最近,研究人员在Nature杂志发文,其使用全基因组的CRISPR-Cas9抑制剂筛选,发现氧化性细胞器过氧化物酶体是人类肾癌和卵巢癌细胞的铁死亡敏感性的关键贡献者。
在该研究中,为了确定调节铁死亡易感性的因素,研究人员在铁死亡易感性透明细胞肾细胞癌(ccRCC)模型786-O3和高等级血清卵巢癌模型OVCAR-8中进行了两个独立的全基因组CRISPR-Cas9抑制剂筛选。
在这两个模型中,通过使用ML210或1S,3R-RSL3(RSL3)抑制脂质过氧化修复酶谷胱甘肽过氧化物酶4(GPX4),诱导铁死亡。这两个筛选揭示了已知的铁死亡调节器-包括酰基-CoA合成酶长链家族成员4(ACSL4),证实了该筛选识别铁死亡敏感性的介质的可信度。
在以前未被表征的促进铁死亡的基因中,使用STRING(蛋白质网络数据库)和研究人员开发的名为基因列表网络富集分析(GeLiNEA)的路径分析算法,过氧化物酶体成分被发现是最丰富的基因簇。
在这两个筛选中确定的过氧体基因包括过氧化物酶体生物发生基因PEX10和PEX3,以及编码过氧化物酶体中酶类的烷基甘油酯磷酸合成酶(AGPS)和脂肪酰基-CoA还原酶1(FAR1)。其他富集的过氧化物酶体基因包括甘油磷酸O-乙酰转移酶(GNPAT),PEX12和PEX7。
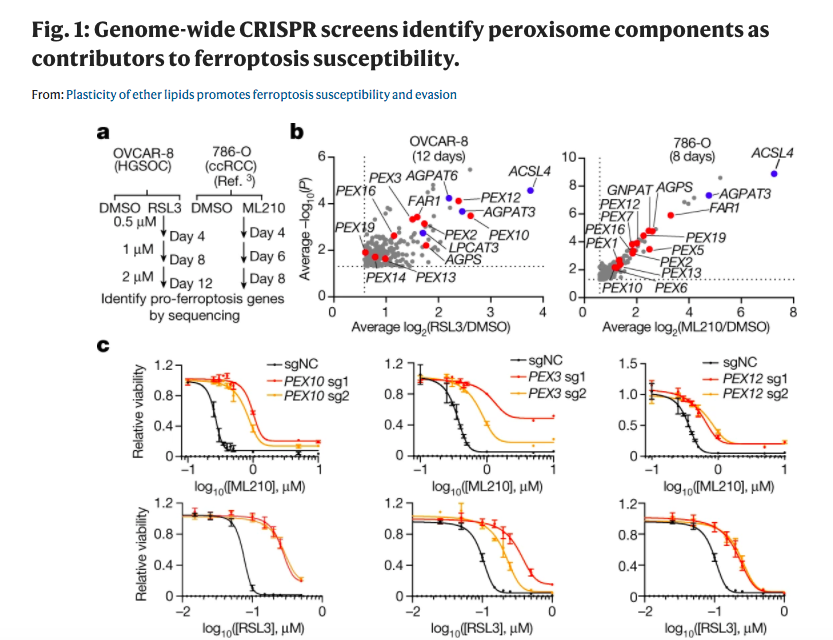
由于过氧化物酶体以前没有牵涉到铁死亡过程中,因此研究人员专注于阐明它们在这个过程中可能的作用。
使用脂质组分析,研究人员表明,过氧化物酶体通过合成多不饱和醚磷脂(PUFA-ePLs),作为脂质过氧化的底物,反过来,导致铁死亡的诱导。
最初对铁死亡敏感的癌细胞在小鼠体内可切换到铁死亡抵抗状态,这与PUFA-ePLs的广泛下调有关。
研究人员进一步发现,PUFA-ePLs的促铁死亡作用可以从肿瘤细胞扩展到其他细胞类型,包括神经元和心肌细胞。
总之,这项工作揭示了过氧化物酶体-醚-磷脂轴在驱动铁死亡易感性和逃避铁死亡方面的作用,突出了PUFA-ePL作为一种独特的功能性脂质类别,在细胞状态转换过程中受到动态调节,并提出了在涉及铁死亡的疾病中进行治疗干预的多个调节节点。
原始出处:
Yilong Zou et al. Plasticity of ether lipids promotes ferroptosis susceptibility and evasion. Nature (2020).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#Nat#
58
#敏感性#
55
#铁死亡#最近特别火,包括在#肿瘤#领域,很多国自然基金都申请这个,但是,它离临床还十分远,未必能上临床。
223
666
121