Cell子刊:中国医学科学院王利团队揭示了在哺乳动物出生后心脏发育中RNA剪接控制的重要作用!
2024-10-16 iNature iNature 发表于上海
该研究表明RNA剪接控制小鼠出生后心脏全器官成熟。
出生后心脏发育需要多种细胞成分的协调成熟,而统一的控制机制仍然缺乏。
2024年10月14日,中国医学科学院王利团队在Developmental Cell在线发表题为“RNA splicing controls organ-wide maturation of postnatal heart in mice”的研究论文,该研究表明RNA剪接控制小鼠出生后心脏全器官成熟。
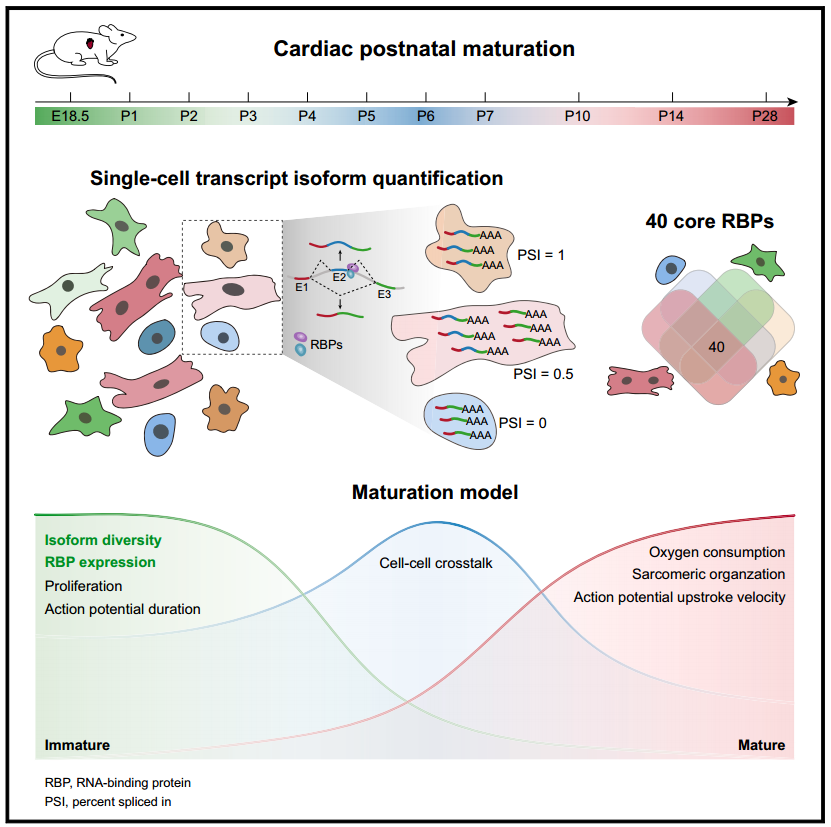
使用全长测序,研究人员在单细胞和转录异构体分辨率下检测了成熟小鼠心脏(E18.5-P28)的转录组学景观。研究发现动态变化的细胞间网络是成熟心脏的分子基础,而选择性剪接(AS)是区分发育年龄的共同机制。RNA结合蛋白(RBPs)的操作通过剪接靶点的直接结合重塑了AS景观,心脏细胞成熟和细胞间通讯,这些剪接靶点丰富了与一般以及细胞类型特异性成熟相关的功能。新生儿心脏中RBP核帽结合蛋白亚基2 (NCBP2)的过度表达抑制心脏成熟。总之,该研究表明,在哺乳动物出生后心脏发育中,RBPs对AS的调节是一种器官水平的控制机制,并为操纵RBPs用于治疗目的的可能性提供了见解。

出生后,哺乳动物的心脏经历剧烈的细胞和分子变化,以达到完全成熟和体内平衡。据报道,许多分子和信号通路控制心肌细胞(CM)的成熟度,进一步利用心脏再生。然而,其他类型的细胞,包括成纤维细胞(FBs)、内皮细胞(ECs)和巨噬细胞(MPs),在出生后(P)心脏发育过程中也发生了显著的变化。然而,关于它们对心脏成熟的贡献的证据仍然很少。
选择性剪接(AS)是一种普遍存在的基因表达调控机制。大约90%-95%的人类基因参与AS。在心脏中,AS越来越被认为在心脏发育、体内平衡和疾病中起着重要作用。例如,CM特异性剪接因子丝氨酸/精氨酸丰富剪接因子1 (SRSF1)、SRSF2和HNRNPU的消融都会导致扩张型心肌病(DCM)。Rbfox1的异位表达促进了新生大鼠CMs和人诱导的多能干细胞源性CMs的成熟。然而,尚不清楚其他类型的心脏细胞是否配备了类似的AS程序。因此,在转录组尺度上评估剪接因子和解剖不同细胞类型的全器官AS调节是解决这些问题的必要条件。
机理模式图(图源自Developmental Cell)
在这里,作者报告了出生后心脏成熟是由心脏转录组的动态AS定义的。时间过程分析表明,从器官水平的角度来看,心脏中各种细胞类型之间复杂而动态的相互作用是心脏成熟的核心。利用全长转录组测序,研究人员确定了所有主要心脏细胞类型中AS的统一调控模式,该模式与出生后年龄密切相关。
RNA结合蛋白(RBPs)通过结合其直接剪接靶点来操纵心肌细胞成熟。在体内,RBP NCBP2的异位表达显著阻碍了出生后心脏成熟,提示临床转化潜力。总之,该研究发现心脏的出生后成熟阶段是由全局AS模式优雅地指定的,RBPs通过AS协调整个心脏的成熟。单个RBP的OE导致全器官心脏成熟的抑制,这一发现为实现心脏再生开辟了潜在的新可能性。
参考消息:
https://www.cell.com/developmental-cell/abstract/S1534-5807(24)00546-X
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#心脏发育# #RNA剪接控制#
44