NSMB:东北师范大学冯云鹏团队揭示组蛋白 O-GlcNAc 修饰调节 DNA 复制原点激活的新机制
2023-05-24 iNature iNature 发表于上海
该研究结果表明H4S47 O-GlcNAc修饰通过促进MCM磷酸化来指导原点活化,这可能揭示了染色质环境对复制效率的控制。
真核细胞中遗传信息的传递和维持依赖于整个基因组的忠实复制。在每一轮分裂中,过量的复制起始被许可,只有一小部分被激活,在染色质的背景下产生双向复制叉。然而,真核生物的复制原点是如何被选择性激活的,这一点仍然难以捉摸。
2023年5月18日,东北师范大学冯云鹏团队在Nature Structural & Molecular Biology 在线发表了题为“H4S47 O-GlcNAcylation regulates the activation of mammalian replication origins”的研究论文,该研究证明了O-GlcNAc转移酶(OGT)通过催化H4S47 O-GlcNAc修饰来增强复制起始。
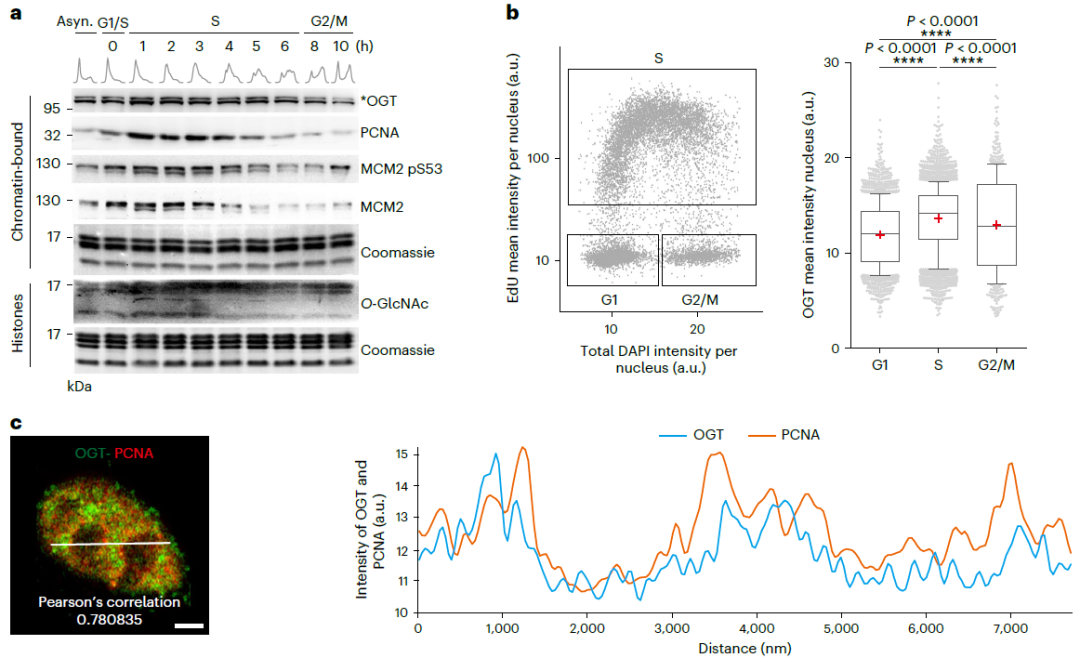
H4S47突变会损害DBF4依赖性蛋白激酶(DDK)在染色质上的募集,导致DNA 解旋酶 MCM 复合物(mini-chromosome maintenance complex)磷酸化降低和DNA解绕受损。短新生链测序结果进一步证实了H4S47 O-GlcNAc修饰在原点激活中的重要性。总之,该研究结果表明H4S47 O-GlcNAc修饰通过促进MCM磷酸化来指导原点活化,这可能揭示了染色质环境对复制效率的控制。

整个基因组必须精确地复制一次,以确保在每一轮细胞分裂中将遗传信息忠实地遗传给子细胞。复制中的错误会引起突变和染色体畸变的积累,这可能导致基因组不稳定,并最终导致肿瘤的发生。真核生物的DNA复制开始于不同的基因组位置,称为复制起点,每个复制起点产生两个相反方向的复制分叉。在细胞周期的S期,成千上万的复制分叉协同工作完成基因组的复制。
在不同的生物体中,复制起点的数量差别很大。真核生物中有许多复制原点,而不是像大肠杆菌那样在特定序列中有一个单一的复制原点,但在每个细胞周期中只有一小部分被激活以启动DNA复制。真核生物复制起始点的激活遵循“复制定时程序”,是处理DNA复制过程中各种挑战以保持基因组完整性的重要机制。然而,关于在DNA复制过程中如何选择性激活许可原点的基本问题仍然知之甚少。
复制起始的逐步控制已经很好地建立,包括原点的认证(licensing)和激活(activation)。原点的认证始于原点识别复合体的装载,随后是细胞分裂控制蛋白6和CDC10依赖性转录物1蛋白的募集。一旦将复制解旋酶MCM复合体装载到染色质上,复制前复合体的组装就完成了,并获得了原点的认证。原点激活需要DBF4依赖性蛋白激酶(DDK)和周期蛋白依赖性激酶(CDKs),它们通过直接磷酸化一系列关键因子,包括真核生物中的MCM亚基、RECQ样解旋酶4 (RECQL4)和Treslin(也称为TICRR),促进CDC45-MCM-GINS复合物的形成,从而进行DNA解绕。
与复制原点相关的序列特征已被深入研究。全基因组研究表明,出芽酵母的复制原点具有一些优先序列基序,称为自主复制序列。相比之下,除了最近报道的与小鼠和人类细胞中的许多原点同时发生的共享的富含G的DNA序列特征外,没有一致的序列可以全面预测高等真核生物的复制原点。值得注意的是,局部染色质环境,特别是组蛋白上的转录后修饰(PTM),已被发现对复制起始的调控很重要。
OGT通过H4S47 O-GlcNAc修饰调节DNA复制(图源自Nature Structural & Molecular Biology )
例如,组蛋白上的乙酰化与酵母、果蝇和人类细胞的原点活性有关。组蛋白乙酰转移酶HBO1(也称为KAT7)上调组蛋白乙酰化以促进原点许可,而人工将催化失能的HBO1拴在哺乳动物原点上则抑制了MCM的装载,从而抑制了原点许可。组蛋白H4上的甲基化也被发现参与了原点活性的控制。由PR-Set7(也称为KMT5A)催化的H4赖氨酸20甲基化调节了复制起始点的起始-识别复合体装载。在S期不成功去除该标记导致基因组在同一细胞周期内重复复制。
该研究证明了H4S47 O-GlcNAc修饰是有效的DNA复制所必需的,并且对细胞对营养应激的反应很重要。在S期染色质中富集的OGT似乎定位于复制位点,并通过催化H4S47 O-GlcNAc修饰来增强DNA复制。研究结果表明,一旦H4S47发生突变,复制起始激活、染色质上的DDK装载、MCM磷酸化(如MCM2的S53的磷酸化)以及H4-DDK-MCM复合物的形成都会受到影响,但复制叉的进展基本上不受影响。此外,短起始链(SNS)测序(SNS-seq)和序列染色质免疫沉淀(ChIP)验证了复制起点的“H4S47 O-GlcNAc修饰- MCM磷酸化”轴。总的来说,该研究结果揭示了H4S47 O-GlcNAc修饰选择性激活复制原点的一个以前未被认识的机制。
原文链接:
https://www.nature.com/articles/s41594-023-00998-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







