中国首个眼科生物类似药——卓初明®在中国正式获批!
2023年12月18日,国家药品监督管理局(NMPA)批准卓初明®(阿柏西普眼内注射溶液)在中国上市,用于治疗成人的:新生血管(湿性)年龄相关性黄斑变性(nAMD); 糖尿病性黄斑水肿(DME)。据悉,卓初明®是国内首款报产的阿柏西普生物类似药。
 眼底疾病给患者带来巨大负担,现有治疗方案仍无法满足临床治疗需求
眼底疾病给患者带来巨大负担,现有治疗方案仍无法满足临床治疗需求
包括nAMD、DME等疾病在内的诸多眼底疾病是导致患者视力障碍甚至失明的主要原因,给患者带来巨大的身心痛苦1,2。而多个国际权威指南推荐抗血管内皮生长因子(VEGF)药物作为nAMD和DME的一线治疗选择3-12。目前国内市场上以雷珠单抗、阿柏西普和康柏西普3种抗VEGF药物为主。虽然目前眼底疾病药物治疗的选择越来越多,但仍有不少眼底疾病的药物治疗由于各种原因无法满足临床需求13,存在很多问题,比如目前药物价格较高导致普及性差,虽然眼底疾病治疗药物价格多次下调,且已纳入医保,但其价格仍在4000元左右,患者每年仍需承担上万元,作为慢性病需要长期用药,以及考虑到眼底病以老年群体为主,价格更为敏感。同时,还存在其他一些问题,如药物区域不均衡(国内外药物无法顺利流通)、药物研发难度大、治疗方式痛苦导致患者依从性差、复杂的给药方式导致基层医院难以开展。
生物类似药在安全性和有效性方面与原研药不存在有临床意义的差别
当前,生物类似药的研发已经成为全球热点,各国结合国情国力均制定出台相关政策法规,加快生物类似药的生产制造14-20,如2010年,美国颁布了《生物制品价格竞争和创新法案》18,2014年,韩国制定了《生物制药产业的前景及发展战略》19,2015年,我国NMPA发布了《生物类似药研发与评价技术指导原则(试行)》20。

图1 国内外均颁布相关政策法规和技术指南促进生物类似药的发展14-20
KFDA:韩国食品药品管理局;EMA:欧洲药品管理局;PMDA:日本医疗器械审评审批机构;NMPA:国家食品药品监督管理总局
生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。生物类似药候选药物的氨基酸序列原则上应与参照药相同。对研发过程中采用不同于参照药所用的宿主细胞、表达体系等的,需进行充分研究20。生物类似药与原研药高度相似但更为复杂,在安全性和有效性方面与原研药不存在有临床意义的差别21。
生物类似药的研发过程与原研药相似,需要通过严格的I期、III期研究保证与原研药的临床相似性。生物类似药的临床研究不是为了探索有效性和安全性,而是尽可能的排除差异,所有的试验设计均围绕“差异”展开20,22-25,而且其研究设计是以证明候选药与参照药的相似性为目的,进行科学合理的研究设计20。其I期研究是关于临床药理学的比对研究,证明与原研药的药代动力学(PK)生物等效,III期研究是临床比对的研究,证明与原研药的疗效、安全性、免疫原性无临床意义差别。
生物类似药不能被称为仿制药,生物类似药分子量更大,结构更复杂,平均需要8-10年的时间和1亿-2亿美元研发成本,不仅需要进行较为广泛的比对研究(这一点与原研品相似),还需开展相对简化的非临床实验,进行严格的I期、III期临床比对研究。所以相比仿制药,生物类似药对研发技术要求更高,研发周期更长,投入更高(图2)26。
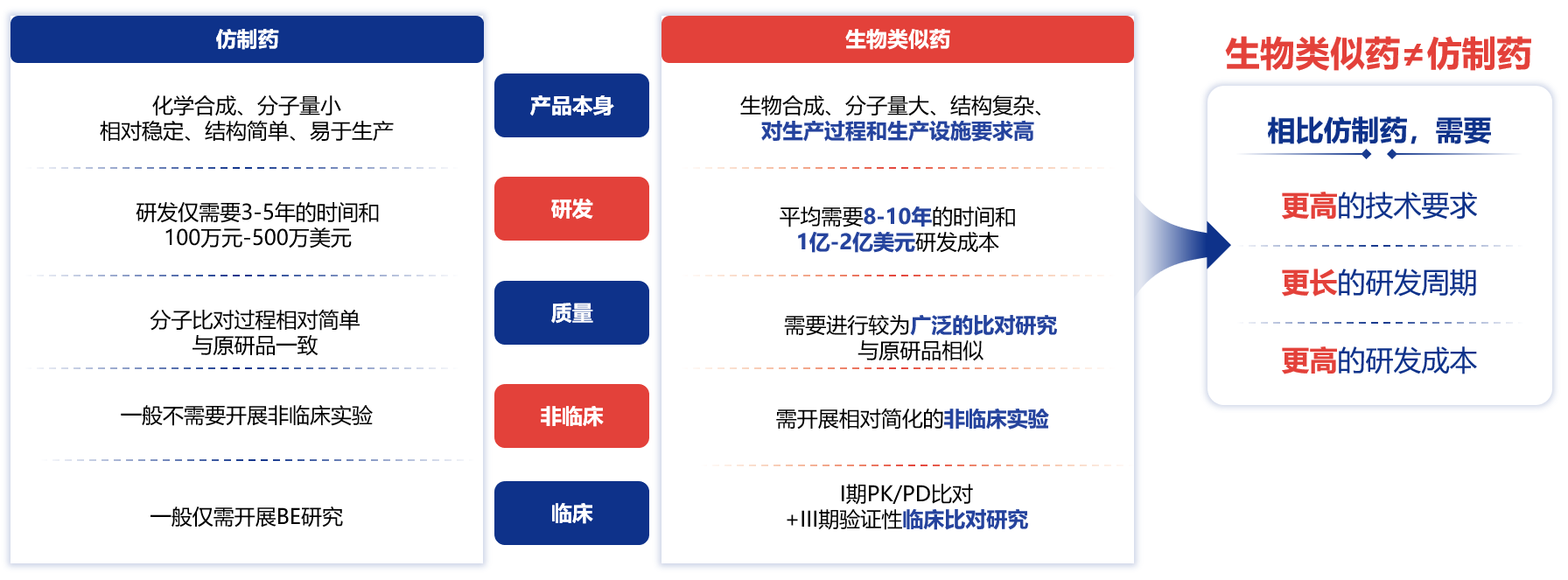
图2 仿制药和生物类似药的对比
有四大原则指导生物类似药的研发和评价,从而保障生物类似药的临床疗效。在整个生物类似药的研发过程中,与参照药的比对贯穿始终(比对原则),开发过程中所采用工艺、处方和分析方法等应与参照药保持一致(一致性原则),药学、非临床和临床的研发逐步递进,只有前面取得相似性的结论,后面的研究才能继续相似性评价(逐步递进和相似性原则),不需独立验证其安全性和有效性,只需用分析方法逐步从结构和功能上阐明其与原研药高度相似性20,21,27。
卓初明®的有效性和安全性与艾力雅®相似,纯度、杂质含量和经济性优于艾力雅®
阿柏西普是抗VEGF的一种,相比雷珠单抗,阿柏西普由人VEGF受体1和受体2构成2个结合臂,可与VEGF-A、VEGF-B、胎盘生长因子(PlGF)二聚体结合,靶点更广28,29,亲和力更强(是雷珠单抗的100倍29),抑制眼内VEGF-A时间平均为71天30(雷珠单抗仅为36天31),抑制时间更持久,作用时间更长。阿柏西普的生物类似药可增加患者临床用药的可及性和可负担性,使患者获得更多治疗机会。
此次卓初明®(阿柏西普眼内注射溶液)在中国的获批上市主要基于一项随机、双盲、平行、阳性对照研究32的结果,该研究旨在比较阿柏西普生物类似物卓初明®与原研阿柏西普艾力雅®治疗nAMD的疗效和安全性。
这项研究在中国的35个中心进行,年龄≥50岁、继发于nAMD的中央凹下脉络膜新生血管(CNV)、最佳矫正视力(BCVA)字母评分为73-34的未经治疗患者符合纳入条件。患者在前3个月每4周接受玻璃体内注射卓初明®或艾力雅® 2 mg(0.05 ml),然后每8周注射2 mg,直到第48周,按基线BCVA≥或≤45个字母分层(图3)。主要终点是第12周时BCVA值较基线水平的变化,其他终点包括中央视网膜厚度(CRT)、CNV渗漏面积、治疗后出现的不良事件(TEAE)、免疫原性、PK特征。
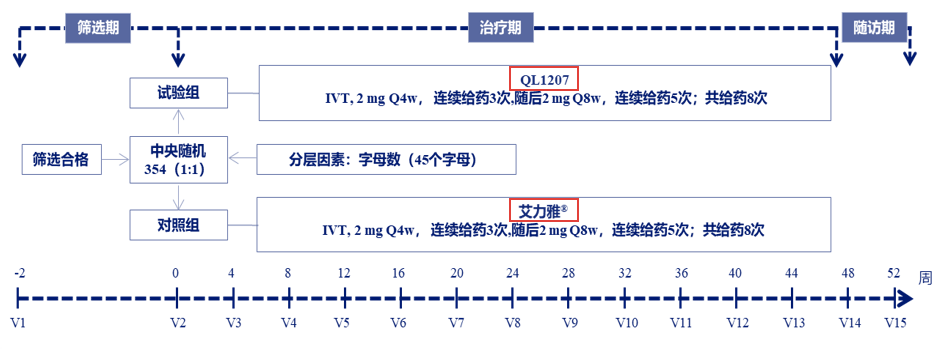
图3 试验流程图
IVT:玻璃体内注射
结果发现,第12周时研究眼BCVA字母数较基线增加>10个字母,最小二乘均值的组间差值95% CI为(-3.0,0.7),落在预先设定的(-5,+5)等效性范围内,P值为0.2275,大于0.05,无统计学显著性差异(表1),表明两组第12周BCVA字母数较基线变化无显著性差异,两个产品的有效性结果等效。
表1 第12周BCVA字母数较基线变化的分析 ‒ FAS集
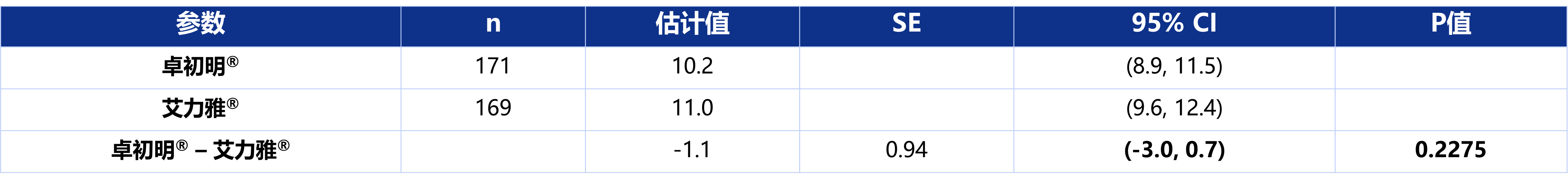
FAS:全分析集;SE:标准差
次要终点结果显示,卓初明®给药后BCVA字母数平均增加>10个字母,较基线增加的字母数变化与原研药趋势基本一致(图4A);给药后CRT平均下降>180 mm,且随时间变化趋势与原研药一致(图4B);给药后CNV渗漏面积下降,且随时间变化趋势与原研药一致(图4C)。
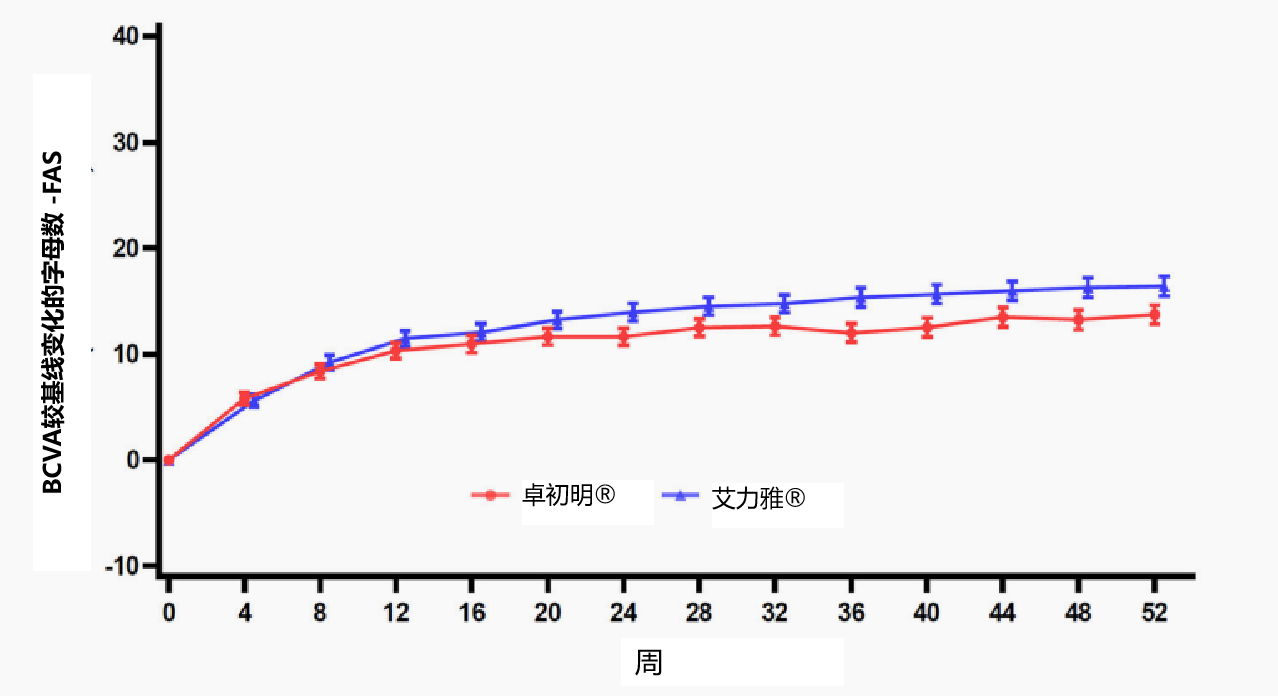
图4A BCVA较基线变化的字母数-FAS
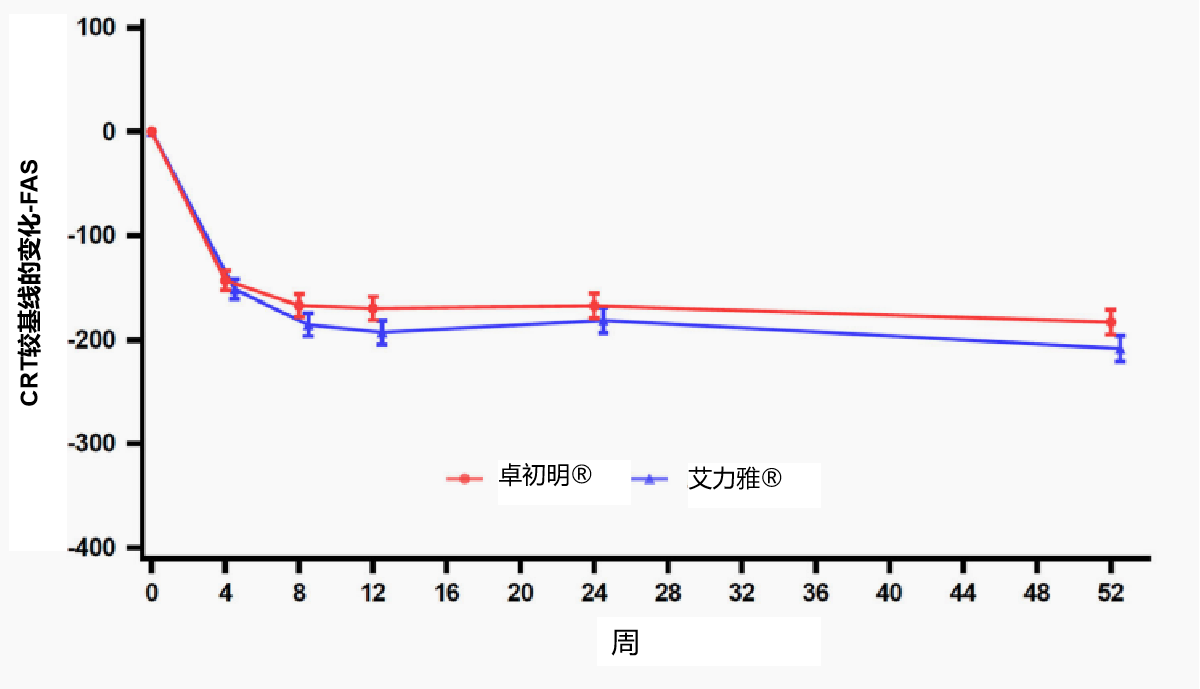
图4B CRT较基线的变化-FAS

图4C CNV渗漏面积较基线的变化-FAS
安全性方面,卓初明®相比艾力雅®不良事件发生率数值更低,纳入的所有患者均未发生眼内炎(图5,表2)。卓初明®的与试验药物有关的TEAE发生率更低,与IVT有关的TEAE发生率与艾力雅®相似(图6,图7)。
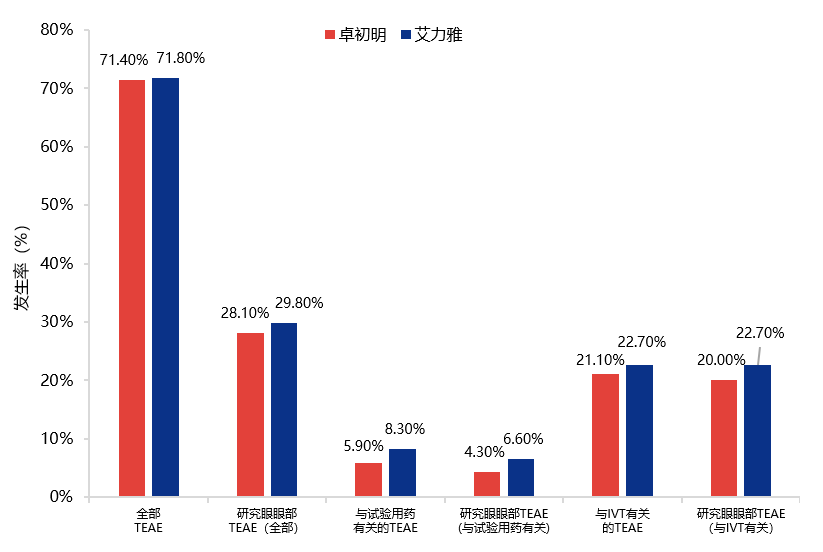
图5 卓初明®的不良事件发生率数值更低
表2卓初明®的整体安全性结果
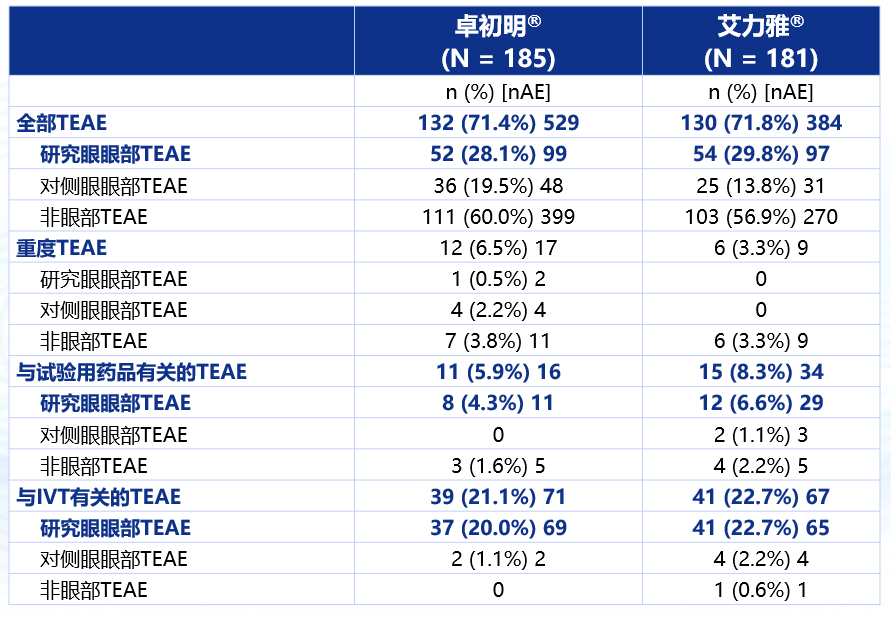
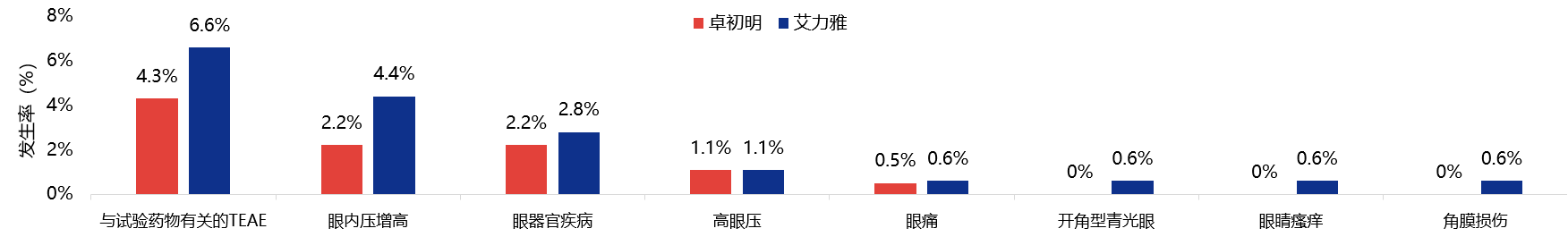 图6 与试验药物有关的TEAE
图6 与试验药物有关的TEAE

图7 与IVT有关的TEAE
卓初明®的免疫原性与原研产品艾力雅®相似,不会引起过多的免疫相关事件。两个治疗组的整体抗药抗体(ADA)发生率相似:卓初明®:7.1% vs. 艾力雅®:7.7%;两个治疗组的整体中和抗体(Nab)发生率同ADA发生率一致;ADA的发生对有效性、安全性和PK特征无影响(表3)。
表3 卓初明®和艾力雅®的免疫原性比较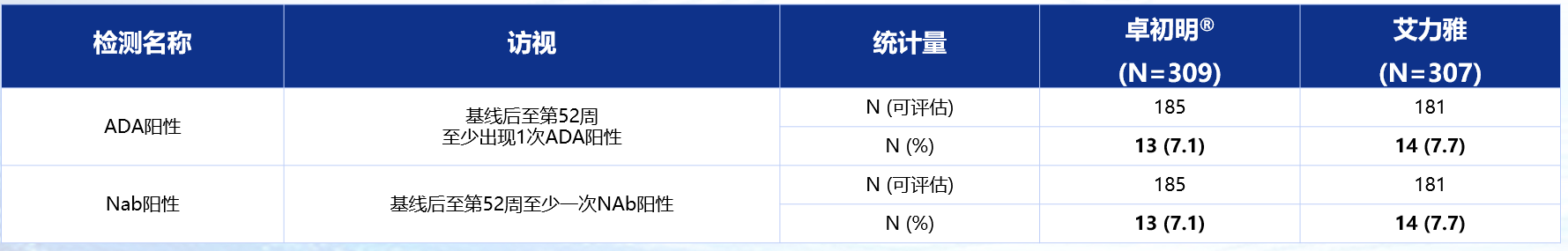
卓初明®和艾力雅®的PK特征相似,表明两者在体内的吸收、分布、代谢和排泄过程相似(表4)。
表4 卓初明®和艾力雅®的PK比较
该研究提示,卓初明®和艾力雅®治疗nAMD的疗效相当,具有类似的安全性特征。除此之外,卓初明®与原研药艾力雅®结构、理化、活性及功能进行了全面对比,质量高度相似,卓初明®在纯度和杂质含量方面优于艾力雅®,表明卓初明®更安全、更稳定。
卓初明®是国内首款报产的阿柏西普生物类似药,已有研究证实,生物类似药的最大优点是节约费用,可减轻患者经济负担、降低医保负担,提高治疗依从性,并最终改善健康结果33,34。在中国,生物类似药较原研药价格降低20%-30%,导致整体生物药品市场费用降低,使治疗的可及性显著提高,从而减轻了医保经济负担35,36,如2019年12月,齐鲁制药安可达®在国内获批上市,是我国获批的首个贝伐珠单抗生物类似药,安可达®进入临床使用后,促使贝伐珠单抗的医保费用及患者自付费用下降20%,极大提高了生物制品的用药可及性35。可以预见的是,卓初明®可以增加患者对阿柏西普的可及性和可负担性,患者因此拥有更多的治疗选择和治疗机会,医保负担也会降低,其社会经济效益突出。
齐鲁制药致力于实现眼科全覆盖、全对标
齐鲁制药始终秉承“大医精诚、家国天下”的核心价值观,为人类健康保驾护航。其中,齐鲁制药在眼科方面有众多产品,努力把光明带给更多中国家庭,为解决眼科医生和患者的临床需求,致力于实现眼科全覆盖、全对标。齐鲁制药在外眼部及前眼部的炎症性疾病领域有代表药物卓立平®(溴酚酸钠滴眼液),在干眼症领域有代表药物润立明®(地夸磷索钠滴眼液),在对肾上腺皮质激素敏感的眼部疾患及外眼部细菌感染领域有代表药物典舒®(妥布霉素地塞米松滴眼液/眼膏),后续也有多个眼科产品即将上市。
卓初明®是齐鲁研发的艾力雅®生物类似药,是眼底疾病治疗的新型武器,III期临床试验表明卓初明®的有效性和安全性与艾力雅®相似,是抗VEGF药物优选,而且卓初明®药代动力学与艾力雅®相似,纯度和杂质含量优于艾力雅®,是患者的安心之选。卓初明®的上市增加患者临床用药的可及性和可负担性,使患者获得更多治疗机会,降低国家医保负担,带来多重获益。
参考文献
- Jingfa Zhang, et al. Cells 2022, 11(21):3362.
- Wong WL, et al. Lancet Glob Health 2014, 2(2):e106‑e116.
- 中华医学会眼科学分会眼底病学组, 等. 中华眼底病杂志, 2023, 39(2).
- Schmidt-Erfurth Ursula, et al. Ophthalmologica, 2017, 237: 185-222.
- Solomon Sharon D, et al .Diabetes Care, 2017, 40: 412-418.
- International Council of Ophthalmology. Updated 2017 ICO Guidelines for Diabetic Eye Care.
- Cheung G C , et al. Clinical & Experimental Ophthalmology, 2017.
- 中华医学会眼科学分会眼底病学组, 等. 中华眼科杂志, 2023, 59(5).
- NICE guideline.2018.
- American Academy of Ophthalmology Retina/Vitreous Panel. 2015.
- Schmidt-Erfurth U, et al. British Journal of Ophthalmology, 2014, 98(9):1144-1167.
- The Royal College of Ophthalmologists, 2013.
- 金恩忠, 等. 眼科疾病药物治疗未满足的需求及展望. 临床药物治疗杂志 2022, 20(9): 1-5.
- 从四家公司看生物类似药的发展. (2017-02-16) [2018-04-26].
- EMA. Guideline on similar biological medicinal products. (2005-10-30) [2019-09-05].
- 刘聿砚, 等. 中、美、日、欧等国家/地区生物类似药监管措施的比较研究. 中国药房 2020, 31(24): 2961-2965.
- PMDA. Guideline for the quality, safety, and efficacy assurance of follow-on biologics. (2009-03-04) [2013-04-19].
- HHS, FDA, CDER, et al. Biosimilarity biosimilars: additional questions and answers regarding implementation of the biologics price competition and innovation act of 2009 guidance for industry. (2015-05) [2019-09-16].
- 2020 世界制药原料韩国展—CPhI Korea 2020. (2016-10-08) [2017-05-16].
- NMPA. 生物类似药研发与评价技术指导原则(试行). (2015-02-28) [2019-08-12].
- 梅丹, 等. 多维度关注生物类似药的管理与临床应用.中国药房 2020, 31(3): 373-378.
- Verrill M, et al. Future Oncol 2019; 15(28):3255-3265.
- Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: nonclinical and clinical issues EMEA/CHMP/BMWP/42832/2005 Rev. 1. (2014).
- US Food and Drug Administration: Scientific Considerations in Demonstrating Biosimilarity to a Reference Product: Guidance for Industry, 2015.
- WHO: Guidelines on Evaluation of Monoclonal Antibodies as Similar Biotherapeutic Products (SBPs), 2017;
- 金春林, 等. 药品供应保障体系视角下的生物类似药发展. 中国卫生资源 2022, 25(6): 675-676.
- 刘升波, 等. 生物治疗药物和生物类似药研究进展. 中国卫生资源 2022, 25(6): 682-687.
- Rudge JS, et al. Proc Natl Acad Sci U S A 2007, 104(47):18363-18370.
- Papadopoulos N, et al. Angiogenesis 2012, 15(2):171-185.
- Fauser S, et al. Am J Ophthalmol 2014, 158(3):532–536.
- Muether PS, et al. Am J Ophthalmol 2013, 156(5):989–993.e2
- Li B, Fan K, Zhang T, et al. Efficacy and Safety of Biosimilar QL1207 vs. the Reference Aflibercept for Patients with Neovascular Age-Related Macular Degeneration: A Randomized Phase 3 Trial [published online ahead of print, 2023 Nov 21]. Ophthalmol Ther. 2023;10.1007/s40123-023-00836-4. doi:10.1007/s40123-023-00836-4
- 朱昶宇,童荣生.生物类似药在我国的用药管理挑战及对策探讨[J].中国医院药学杂志,2020,40(04):364-368.
- Kaiser PK, et al. Retina. 2022;42(12):2243-2250.doi:10.1097/IAE.0000000000003626.
- https://mp.weixin.qq.com/s/cdYgj9PGVa0cEqBxIWO01w,转自“齐鲁制药集团”公众号
- Kaiser PK, Schmitz-Valckenberg MS, Holz FG. Retina. 2022;42(12):2243-2250. doi:10.1097/IAE.0000000000003626.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







