Sci Transl Med:CAR-T对难治或复发性慢性淋巴细胞白血病疗效显著
2015-09-20 Paul Hsu编译 爱康得生物医学技术
难治性或多次复发的慢性淋巴细胞白血病(CLL)的患者预后较差。靶向CD19的嵌合抗原受体(CAR)T细胞对B细胞恶性肿瘤的持续缓解,具有提高常规疗法低缓解率的潜力。我们曾经报道过3例难治性CLL治疗的初步研究结果。现在我们报道使用CAR-T细胞治疗的14例复发性难治性CLL患者的初步试验中成熟的研究结果。用慢病毒载体导入CD19 CAR的自体T细胞(CTL019),输注给复发/难治性CLL患者
难治性或多次复发的慢性淋巴细胞白血病(CLL)的患者预后较差。靶向CD19的嵌合抗原受体(CAR)T细胞对B细胞恶性肿瘤的持续缓解,具有提高常规疗法低缓解率的潜力。我们曾经报道过3例难治性CLL治疗的初步研究结果。现在我们报道使用CAR-T细胞治疗的14例复发性难治性CLL患者的初步试验中成熟的研究结果。用慢病毒载体导入CD19 CAR的自体T细胞(CTL019),输注给复发/难治性CLL患者,输注剂量为0.14×108到11×108 CTL019细胞(平均1.6×108细胞)。对患者体内的CTL019进行毒性,应答,扩增和持续性进行监测。经多次治疗的CLL患者中,总有效率为8/14(57%),其中4名患者完全缓解(CR),4名患者部分缓解(PR)。体内CAR-T细胞的扩增与临床应答相关,前2名获得CR的患者,体内CAR-T细胞功能持久保持超过4年。CR的患者疾病都没有出现复发。所有应答的患者出现B细胞再生障碍和细胞因子释放综合征都与CAR-T细胞的扩增相关。在获得CR的患者身上检测不到微小残留病灶,这表明了治愈晚期CLL患者成为可能。
前言
慢性淋巴细胞白血病(CLL)是成人白血病中最常见的类型。CLL的病程变化很大,总生存期为2年到20年。尽管有很多有效的疗法,但传统疗法CLL无法被治愈,病情恶化亦不可避免。虽然可通过同种异体造血干细胞移植来治愈部分患者,但这也有较高的发病率和死亡率,并且有许多CLL患者不适合移植治疗。难治性或多次复发的CLL患者预后较差,其总生存期由前期的无进展生存期决定。
CD19嵌合抗原受体(CAR)修饰的T细胞是CLL和其他B细胞恶性肿瘤的一个不错的治疗方法。CAR是通过基因改造,由结合靶向抗体的单链可变区(scFv)与胞内信号和共刺激域组成的分子。早期尝试使用的CAR修饰的T细胞靶向恶性肿瘤,受到体内扩增和最低持续时间不足的限制,或因正常组织表达靶向抗原引起脱靶毒性。CTL019(以前称CART19)表达的CAR,由抗-CD19 scFv与CD3ζ信号区和4-1BB(CD137)共刺激域构成,在小鼠模型中,这种CAR分子修饰的T细胞能持久表达并保持抗肿瘤活性。由于CD19只表达在正常和恶性B细胞表面,不表达于其他细胞,所以靶向正常细胞的毒性有限。
我们和其他的研究者在之前的研究中发现,有少数患有复发或难治性CLL,急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL)的患者,在接受CD19 CAR-T治疗后能保持长时间的完全缓解(CRs)。现在我们报告CTL019临床试验中14例患者成熟的结果。从我的研究中可以看出,CTL019在体内强力扩增后,表现出长期稳定的活性,部分复发性/难治性CLL患者获得深度缓解,持续缓解与活性的持久稳定相关。
材料和方法
研究的设计与监管
成人年满18周岁,至少经过2次治疗方案后失败的复发性或难治性CD19+CLL患者;最后一次二线化疗和进展之间不超过2年,不适合或主动放弃异基因造血干细胞移植。如果之前的治疗方案中没有获得CR或者治疗后不足2年疾病进展,17p染色体缺失或TP53突变的高危患者亦可入选。肿瘤重新分期后,单采收集外周血T细胞用于制备CTL019。受试者均给予一个疗程的常规化疗进行淋巴细胞删除,在细胞输注前4天完成。淋巴细胞删除性化疗包括CLL常规治疗方案和主治医师自行选择方案。这项试验的主要目的是确定治疗的安全性和从分离患者血液制备CTL019的可行性。次要目的包括评价输注的基因修饰的T细胞功能和持久性,应答率,患者生存率和其他相关点。该方案通过宾夕法尼亚大学伦理审查委员会,美国食品和药品监督管理局(FDA)和重组DNA咨询委员会批准,并在FDA批准的新药研究申请下进行。按照赫尔辛基宣言所有患者给予知情同意。 这项研究已在ClinicalTrials.gov上注册(标识号NCT01029366)。
随访截止2014年12月31号。所有作者讨论解释了研究结果,并对数据进行了证实和分析。所有图的源数据补充材料可提供(表S6到S11)。
载体生产
CD19-BB-ζ转基因(GeMCRIS 0607-793)的设计与构造已作介绍。慢病毒载体按照目前Lentigen公司或费城儿童医院三质粒制作方法的生产程序制备。
T细胞采集和CTL019细胞代数
通过白细胞分离收集自体T细胞,通过CD3和CD28单抗磁珠刺激T细胞。用抗-CD19 scFv连接4-1BB和CD3-ζ信号域的慢病毒载体转染T细胞,并在体外扩增10~12天。平均转染效率20.1%(范围4.7%到39.2%)。产品标准之前已介绍。
应答评估
在方案设定的时间点,并基于国际研讨会CLL组客观影像学评价疗效标准,完成疾病反应的评估。此外用深度测序分析进行MRD研究性评估。
相关性研究
如上所述,进行了样本处理,流式细胞术,细胞因子和细胞因子受体分析,qPCR分析。此外还进行了以下研究。
免疫球蛋白重链重排的下一代测序。利用iPrep(Invitrogen)从制备的细胞产品和输注后外周血中提取基因组DNA。对IGH位点的第三互补决定区进行扩增,并利用特异性引物和插入基因片段进行深度测序(Adaptive Biotechnologies)。利用免疫组化SEQ对序列数据进行审查。每例患者的白血病克隆经过基准校正,并通过随访患者的骨髓和外周血样本来评估白血病克隆对CTL019的应答。每个样本检测值都建立统一独立的编码,并对每个样本白血病克隆频率进行计算。
IGHV突变状态。在输注CTL019之前,收集外周血提取基因组DNA,用来评估IGHV位点的突变状态(Cancer Genetics公司)。
多色流式细胞术
抗体。购买使用对应下列抗原的抗体:(i)购自eBioscience:CD3异硫氰酸荧光素(FITC),CD8藻红蛋白(PE)和花青5.5 PE(Cy5.5PE),CD14 Cy7PE,CD16 Cy7PE,CD5别藻蓝蛋白(APC),CD19 Cy7PE和APC, CD20 FITC, CD45 PE, CD10 Cy7PE, CD34 Cy7PE, andTNF–α Alexa Fluor 700;(ii)购自BioLegend:CD4亮紫罗兰色605 (BV605)和BV785, CD8Cy5PE, D45ROBV570以及 IFN-γBV570;(iii)购自Becton Dickinson:CD14 V500, CD3 BV605, IL-2 CF594PE, CD107a Cy5PE, 粒细胞-巨噬细胞集落刺激因子BV421以及巨噬细胞炎性蛋白(MIP)–1b PE;(iv)购自Beckman Coulter:CD27 Cy7PE; (v) 购自R&Dsystems:MIP-1a FITC。用Alexa Fluor 47–conjugatedmAb来检测CAR19 分子已作介绍。研究中所有用到的抗体在使用前都进行了滴定。如前所述,CTL019的扩增与持久性和CLL细胞的例行评估,都是用4色6参数的Accuri C6流式细胞仪进行检测。
CTL019抗-CD19活性。为评估对CD19+靶细胞的响应,将输注的制品和输注后的样品分别加入含有莫能菌素,布雷菲德菌素A和抗-CD107a Cy5PE单抗的表达CD19+的K562细胞中,在37℃下孵育6小时。分别用表达间皮素K562细胞和PMA(佛波醇12-肉豆蔻酸酯13-乙酸酯)/离子霉素作阴性和阳性对照。用死细胞去除染料Aqua Blue(Invitrogen公司)对细胞进行染色,再进行表面染色。然后用Cytofix/Cytoperm和Perm/Wash (BD)进行固定和透化处理,再用抗细胞因子抗体染色。用18色20参量LSR Fortessa流式细胞仪在405,488,532和628纳米波长下检测细胞。使用FlowJo(第10版)对数据进行分析。
CTL019的管理
淋巴细胞删除性化疗应在CTL019输注的前4天左右结束。细胞通过静脉输注,按照3天分散剂量方案(第0天10%,第1天30%,第2天的60%),共有1 × 109到5 × 109 CD3+细胞,至少含有1.5 × 107 CTL019细胞。进行第1或第2天的输注是为了观察发烧或其他毒性。患者接受了为期3天的分量输注方案的全部细胞制品,即使低于目标剂量也会有效。根据最初的设计方案,在允许的情况下患者在第10天可以获得额外一次T细胞输注,只有1例患者(03号受试者)接受了这一输注,其他受试者没进行过第10天额外的T细胞输注。对受试者按计划进行毒性评估(1个月的每周评估,6个月的每月评估,以后每3个月评估),在第1个月,第3个月以及以后每3个月对受试者进行应答评估。
毒性分级
根据通用毒性标准(CTC)3.0版对CTL019输注后毒性进行分级。CTC对CRS分级参照抗体治疗的急性输液反应等级,它不足以描述细胞治疗的后发性或正在发生的CRS。我们制定了一个改良型CRS分级标准,用来表述不良反应的严重程度,并帮助确定是否需要进行医疗干预。修订后的CRS分级标准见表S4,A和B。
统计分析
描述统计学的计算来对变量进行研究。数据以±SD或连续变量(最小值~最大值)和分类变量(n%)的平均数呈现。最准的整体反应率以研究期间精确到95%CI受试者CR和PR的比例来计算。为总生存期和PFS终点预估Kaplan-Meier 曲线和中位生存期。总生存期是指从输注到死亡的时间,截止到最后一次随访或2014年12月31号。10号受试者例外,他初次治疗没有应答,并接受了第二次CTL输注(占60%),他是从第1次输注2个月后的第二次输注开始计算。疾病进展通过标准规范确定,PFS指第一次输注到疾病进展或死亡这段时间。CR和PR的定义已作说明。每例患者,用流式细胞术检测CD3阳性细胞中表达抗-CD19 CAR-T细胞比例,用qPCR测定基因改造的T细胞数(平均标记每个细胞),并分别对时间作图,以确定CTL019的扩增和持久性。用峰值(即最大值)确定扩增的水平,CTL019检测结果大于检测下限(CD3 CAR+百分比0.1%,qPCR:25 copies/mg DNA)来检测CTL019细胞的持久性。使用Wilcoxon rank-sum检验,CRS等级和总体反应与扩增水平相关。用散点图和Wilcoxon rank-sum检验,通过CRS等级(0到1与2到4),对细胞因子水平和输注后的第一个月预先选定的4种细胞因子(IL-6, IFN-g, IL2-RA和IL-2) 峰值的差异进行比较。第一月被评为CRS的相对高发期。
适当情况下,在0.05显著水平上,用双边非参数检验(如Wilcoxon rank-sum检验)进行组之间的统计对比。用R 3.0.1 (R核心开发小组) 或 Stata 13.0 (StataCorp)进行统计学分析。
结果
患者的状况
23例CLL患者纳入本次研究,其中14例患者输注至少一个剂量的CTL019(见图S1)。9例没有进行治疗的患者中,3名在细胞输注前因并发症去世,4名主动退出,2名没有通过筛选。14例接受治疗的患者详情列于表1中。14例患者中,12例男性2例女性,平均年龄为66岁(年龄范围51~78岁)。之前患者平均接受过5次治疗(范围1-11),8例患者染色体17p(TP53)缺失。1例患者接受2次自体干细胞移植,1例患者在ibrutinib治疗后疾病进展。所有患者在输注CTL019时处于疾病进展状态。在10例患者的骨髓活检报告中,淋巴细胞删除性化疗前骨髓中淋巴细胞比例平均为87%(范围40%-95%)。淋巴细胞删除性化疗方案中,氟达拉滨/环磷酰胺3例,喷司他丁/环磷酰胺5例,苯达莫司汀6例。

表1.患者的基本情况摘要(N=14)
CTL019制备的可行性和产品特性
产品特性已在表S1中概括。除了1例患者,其余全部满足总有核细胞(TNCs)靶向制品的剂量范围1.5×107到5×109 ,患者接受TNCs平均剂量是7.5 ×108(范围1.7 × 108到50 × 108)。CTL019细胞是指改造的表达CAR的T细胞,14份制品的平均转导效率为20.1%(范围:4.7-39.2%),输注的CTL019总剂量平均为1.6 × 108细胞 (范围,0.14 × 108- 11 × 108),分3天输完。8例患者(57%)完成了3天分散剂量输注方案;3例患者输注了1天(制备总量的10%),3例患输注了2天(制备总量的40%),而且在输注后不到24小时出现发烧,这跟输注细胞剂量的变化有一些关系。输注的细胞制品中CD4阳性细胞平均占81%(范围:68%~95%),CD8阳性细胞平均占20%(范围:4.6%~34%)。
用流式细胞仪检测12例患者细胞制品靶向CD19阳性靶标的活性,测定脱颗粒来衡量细胞毒性,并检测胞内细胞因子的水平。12份制品都显示了靶向CD19的高细胞毒性,并高表达了大部分细胞因子,这说明了这些患者的CTL019表达了具有功能的CAR(图S2)。
患者的治疗效果:疗效和生存率
疗效评判以国际研讨会CLL组疗效标准为基准。此外,随着时间的推移,对每例患者进行免疫球蛋白重链(IGH)基因位深度测序分析,以用作血液和骨髓的疾病检测。最佳的总体应答率和疗效归纳于表2中。14例接受治疗的患者平均随访期为19个月(范围6~53个月)。8/14例患者(57%;置信区间(CI)精确到95%, 29~82%)出现应答。4例患者完全缓解(CR)。患者获得CR并且没有出现复发平均为40个月(范围, 21 ~53个月,从输注完毕开始计算)。缓解包括清除了微小残余病灶(MRD),对01、02、09号受试者在第1个月和对10号受试者在第三个月进行深度测序分析评估,在其血液和骨髓中没有发现CLL克隆的存在(表3,表S2)。CTL019输注后,其中3位患者仍然健在,保持疾病无复发23到58个月。09号受试者也获得CR,在CTL019输注后第15个月接受小腿基底细胞癌切除术,在CTL019输注后的第21个月,手术部位发生感染并导致了致命的绿脓杆菌败血症和脓包坏疽。
在CTL019输注后的一个月内4例受试者(03, 05, 12和 22)获得部分缓解(PR),4例获得PR的患者平均应答持续时间为7个月(范围5-13个月)。其中2例患者(03和05)血象、骨髓和淋巴结都有好转,但他们在输注后4个月疾病进展。第12号受试者骨髓被广泛浸润,输血依赖,广泛淋巴结肿大,在接受治疗后获得PR。输注后,他体内的CTL019经过2次对数扩增,完全清除了血液和骨髓中的CLL,并且肿大的淋巴结消退>50%。这例患者在T细胞输注6个月后死于大规模肺栓塞并发症,但是他的血液和骨髓中都没检测到CLL存在的证据。
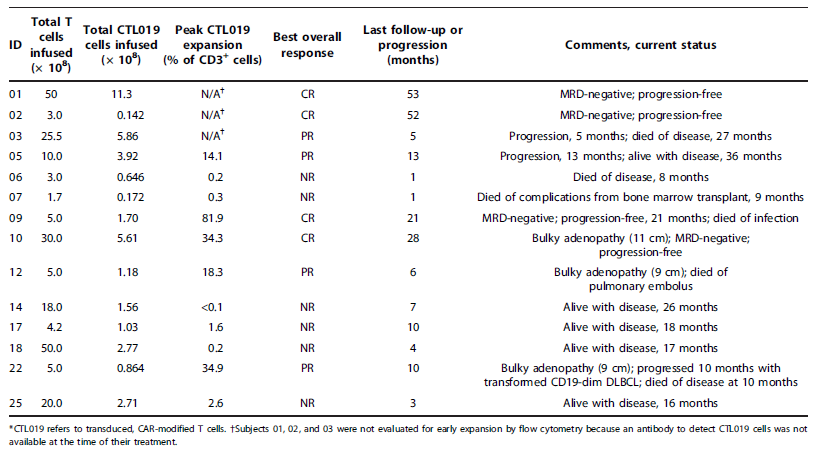
表2.受试者的治疗与临床表现(N=14)。 DLBCL,弥漫大B细胞淋巴瘤; NED,没有疾病的证据; NR,无反应。 MRD通过深度测序分析,在材料和方法中表述。
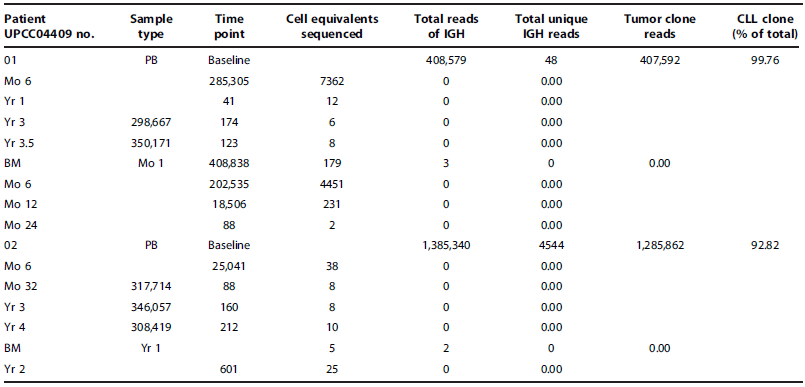
表3. 血液和骨髓IGH深度测序分析显示,受试者01和02CLL细胞和B细胞被清除。BM:骨髓;PB:外周血;Mo:月;Yr:年。
尸检发现,肿大的腹部淋巴结取样中有残余的CLL浸润。22号受试者也存在广泛的骨髓浸润,循环性疾病和严重淋巴结肿大。CTL019输注后3个月,血液和骨髓中CLL被完全清除,肿大的淋巴结消退>50%,获得PR并持续6个月。输注9个月后,其淋巴结迅速肿大,淋巴结活检显示为CD19阴性CLL弥漫大B细胞淋巴瘤(Richter’s转化)。骨髓活检显示约有15%CLL浸润并大量转化为淋巴细胞。虽然在疾病进展时可以在血液和骨髓中通过定量聚合酶链反应(qPCR)可以检测到CTL019,而在发生转化和复发时,通过流式细胞仪在血液,骨髓和淋巴结活检中都检测不到CTL019。
6例受试者在CTL019输注后没出现应答,6例受试者进展期在1到9个月内(平均4个月),这6例患者T细胞扩增受到阻碍(平均420 copies/mg; 范围6.5到13876或总CD3+ T细胞的0.2%)。这些患者的CLL在体外培养不耐受裂解。这6例受试者中有2例已经死亡,1例在CTL019输注8个月后死于CLL并发症和感染,另1例在CTL019输注9个月和进行其他两项CLL治疗方案(ofatumumab和CHOP)后死于同种异体造血干细胞移植的并发症。其他4例受试者在CTL019输注9到15个月后仍然健在,他们都接受了其他替代治疗。
14例患者白血病对CTL019的应答都通过IGH深度测序来评估(表3和表S2),有4例患者被确定产生响应:(i)CTL019输注后白血病克隆快速持续消失,MRD被清除(受试者01,02和09)。在输注后,对受试者01,02和09外周血DNA检测分别长达4年,2年和1年,在任何一次检测中都未发现白血病克隆;(ii)CTL019输注后3个月通过深度测序可确定随着分子水平缓解,CTL019输注会有MRD完全清除的延时性;(iii) 有些患者会出现白血病克隆短暂的完全(受试者22)或不完全(受试者03,05,12,17和25)消失;(iv) 在06,07,14和18受试者中CTL019未能导致IGH序列数和白血病克隆的降低。
14例受试者总生存期平均约为29个月,总生存期18个月占71% (95% CI, 40.6 to 88.2%)。无进展生存期平均约为7个月,无进展生存期18个月占28.6% (95% CI, 8.8 to 52.4%) (图1和表S6).然而1例获得CR的受试者在输注21个月后死于感染并发症,获得CR的患者疾病没有再出现进展。其他所有患者在输注1到10个月后出现疾病进展或死于疾病复发引起的并发症。
如图S1所示,这项研究筛选了23例患者,其中9例未接受治疗。5名患者未能入组,因为他们未能通过筛查或拒绝加入。因此,共18例患者加入,其中4例患者未接受治疗,因为他们在接受治疗前病情迅速恶化和(或)死亡(n=3),或有找到有利的替代治疗主动退出研究(n=1)。因为这种细胞治疗方式从入选到开始治疗会有延时,我们对18例入选者全部进行PFS分析。确认18例受试者中位PFS为9个月(95% CI, 3~13.6)。
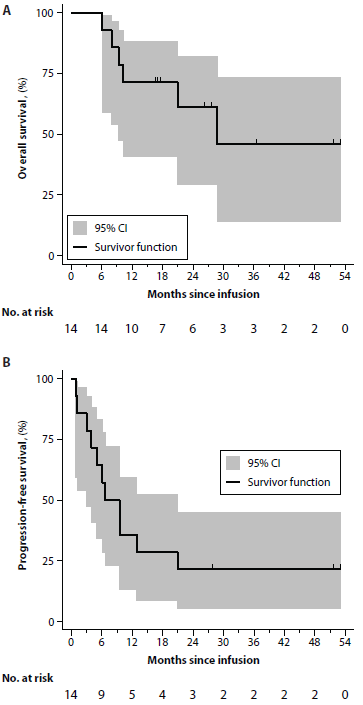
图1:总生存率和PFS。(A和B)总生存期(A)和PFS(B)的Kaplan-Meier曲线评估14例受试者。阴影区表示95CI。受试者风险数每隔3个月标记一次。纵向标刻度表示审查数据的时间点(源数据,表S6。)
患者的年龄,既往治疗的次数,入组阶段,染色体17p的缺失,IGHV突变量和CTL019细胞剂量与应答之间没有明显统计学差异(所有P >0.05,表S3)。因为所有的患者都是晚期,不能确定疾病负荷与应答之间的关联。在治疗前我们对CLL上CD19的表达水平进行了分析,出现应答与没有出现应答的受试者CD19荧光强度均值没有区别,这说明靶标密度不能对应答进行预测。
CTL019在体内的扩增与持久性
用流式细胞术对CTL019细胞的持久性和定量检测(转导和CAR表达)来确定T细胞抗-CD19 CAR的表达,通过qPCR来识别基因修饰的T细胞。扩增的程度和持久性的持续时间与应答呈正相关(图2和表S7)。在大多数情况下CTL019的扩增与细胞因子释放综合征(CRS)相一致(后述),全部有应答的患者CAR-T细胞都扩增到了较高的水平。
4名获得CR的患者,通过qPCR测得CTL019扩增峰值达25070到409645 (均值73237) 拷贝数/mg;在这些受试者中,流式细胞术检测CTL019细胞中CD3+细胞最高比例为34.3%,外周血单个核细胞(PBMCs)中CD3+细胞最高比例为81.9%。通过qPCR检测,4例获得PR的患者细胞扩增度相对要低(范围:1607到130,258; 均值33,453拷贝数/mg),CD3+比例均值为18.3%。没有响应的患者扩增度最低(范围6.5到13876,均值420拷贝数/mg),流式细胞术检测总CD3+比例平均为0.2%。CTL019的峰值与响应有统计学关联(图 3 和表S8) (qPCR,P = 0.013;流式细胞术, P = 0.008)。
通过流式细胞术和qPCR,对4例获得CR的患者进行14到49个月的CTL019持久性的观察(图4A和表S9)。直至最后一次持续性检测,4例患者一直都有B细胞再生障碍,本文编译作者爱康得Paul认为通过B细胞再生障碍可以反映CTL019功能的持续存在。此外,CTL019持久存在的直接证据是,在细胞输注后3年,02号受试者体内提取到了CAR修饰的T细胞;这些CTL019仍然保持对CD19+靶标的特异性和直接杀伤能力,这至少彰显了输注数年后,这些细胞没有耗竭并且仍保持功能。
毒性
CTL019输注的耐受性良好。输液反应罕见并且温和(等级<2),主要包括低烧和轻度寒战。
在CTL019输注过程中没有患者发生显著不适。最常见的相关性事件是中心粒细胞减少并发症(包括发烧)和与体内CTL扩增相关的迟发性CRS。有2例肿瘤溶解综合征记录。1例获得缓解的患者在细胞输注21个月后死亡,皮肤活检显示,伤口感染了假单胞菌引发了致命性脓疮坏疽。
细胞因子释放综合征和巨噬细胞活化综合征
CRS症状从轻微到严重并常有自限性。CRS症状包括发烧,肌肉酸痛和恶心,在严重的情况下会出现低血压,毛细血管渗漏和缺氧。CTCAE(不良反应通用术语标准)3.0版将CRS定义为急性输液毒性反应,但是不能对CTL019给药几天后发生的迟发性CRS进行解释。因此我们设计了一份CRS新评价标准(表S4中,A和B)。此外在CRS中我们也注意到,并发血细胞减少症,凝血功能障碍,CD163染色法病理诊断巨噬细胞高度活化,有1例患者在CRS高峰期,骨髓活检发现噬血现象。在铁蛋白,C-反应蛋白(CRP)和可溶性白介素-2受体(sIL-2R)显著升高的CRS患者中,都会出现巨噬细胞活化综合征(MAS)或噬血细胞性淋巴组织细胞增多症(HLH)。9例患者在CTL019输注1~14天(平均7天)后发生CRS,包括1例1级,2例2级,2例3级和4例4级。在输注后平均9.5天(范围9~55天),有5例患者的CRS需要用抗细胞因子定向治疗,4例患者重症监护病房(ICU)护理CRS相关的并发症,如低血压和缺氧,ICU护理平均6天(范围4~9天)。

图2:qPCR检测头12个月CTL019的扩增。通过qPCR检测14例受试者基因组DNA每微克拷贝数,来衡量外周血中CTL019的扩增。低于检测下限值(<25拷贝数/毫克DNA)用空心圆表示(源数据,表S7)。
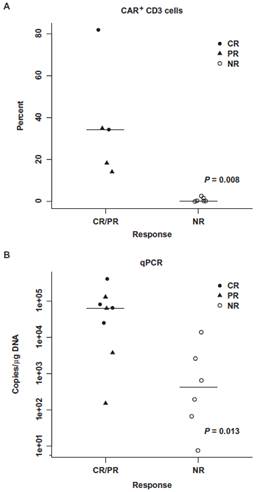
图3:扩增高峰与应答之间的关系。对11例受试者用流式细胞术(A)和对14例受试者用定量PCR(B)测定前3个月CTL019的扩增高峰。未能用流式细胞术对01,02,03号受试者进行检测,因为在他们治疗期间没有可用的抗体。提供非参检验P值(源数据,表S8)。
之前我们曾指出ALL患者在输注CTL019后IL-6显著升高出现严重CRS,可用IL-6受体阻断抗体tocilizumab迅速逆转。在这之前,1名患者(受试者03)接受糖皮质激素治疗后成功逆转CRS。对于后续患者,tocilizumab被纳入对CLL患者严重CRS的处置。4例患者接受tocilizumab治疗(有2名加用类固醇)后,得到迅速退烧,血压回稳以及巨噬细胞活化相关的生化异常(铁蛋白和CRP)迅速改善的效果。使用tocilizumab后铁蛋白的生化指标列于图S3中。
CTL019扩增的峰值与CRS的相关性,CRS与临床应答的相关性(P<0.05)列在图S4中。与没有或者轻微CRS(0~1级)患者相比,有严重CRS(2~4级)的患者IL-6峰值水平更高(平均峰值, 269比34 pg/ml; P = 0.014),2~4级CRS患者的sIL-2R水平更高(平均峰值, 10962比4177 pg/ml; P =0.008),而血清中INF-γ和IL-2无明显统计学差异(图5和表S11)。输注后1个月内的铁蛋白(8例受试者)和CPR(5例受试者)数据有限,这阻碍了对CRS分级的权威性分析。CRS2~4级患者比CRS0~1级患者有更高峰值的铁蛋白均值 21,502比1980)和C-反应蛋白(均值160比42);尽管还有少数患者样本没有进行详细的统计学分析,但这些有限的数据表明铁蛋白和(或)C-反应蛋白可作为CRS活动和对治疗有应答的生物标志物。症状和患者的具体特点不能对CRS进行预测,如年龄,治疗史,遗传风险和细胞剂量(表S5).
所有接受tocilizumab治疗CRS的患者在输注tocilizumab时T细胞正在持续扩增。Tocilizumab使用后,症状迅速改善,尽管至少给药2次,在给药后的几天T细胞扩增达到顶峰,这表明Tocilizumab不能完全抑制T细胞的持续扩增。因为所有患者有持久存在的细胞,很显然tocilizumab不会影响T细胞的长期存活。
与CRS相关的神经系统不良反应有5例患者,包括1或2级幻觉、意识模糊、高烧引发的谵妄,需ICU护理或药物治疗。出现1例持续2天的4度精神错乱,这至少与T细胞治疗部分相关。
B细胞再生障碍和低丙种球蛋白血症
B细胞再生障碍和低丙种球蛋白血症比较常见。全部获得CR的患者和2例获得PR的患者检测不到B细胞。对CTL019没有应答的患者不会出现B细胞再生障碍。根据免疫球蛋白水平静脉注射足量的免疫球蛋白来处置低丙种球蛋白血症。在最初治疗的患者中B细胞再生障碍持续了4年,进一步表明了持续存在的T细胞可保持功能。
讨论
使用CAR改造的T细胞靶向癌症的研究已超过20年,但在初期受限于基因改造的T细胞在体内扩增能力低,持久性差。在早期报告中我们发现,CTL019在3例CLL患者体内有临床活性。我们现在报告入选的18例患者中,总应答率为8/18,这些应答是持久的,并且获得CR的患者没有复发。不需要进一步治疗就能持续清除恶性克隆。CTL019的高度扩增,长期的持久性以及输注后数年的B细胞再生障碍都与应答响应相关。我们尚未发现对患者或疾病进行预先相关分析可以预测哪些患者最可能出现应答反应,尽管这项研究没有涉及这项关联的调查。接受治疗的患者人数有限,但是获得应答与没有应答的患者在年龄,既往治疗和遗传风险因素之间没有关联。通过测定平均荧光强度,应答者与无应答者之间的CD19的表达水平没有差异。T细胞剂量和应答之间没有关联,细胞制品也没有显著的特点可预测应答,如表型,体外抗CD19+靶标的活性或premanufacturing端粒长度。但是我们确定T细胞在体内扩增的水平和应答相关联。另外,无应答者的CLL细胞在体外易受到裂解,为不应答是由于体内T细胞扩增受阻这一假设提供支持。
第二代CARs显示了对CD19+淋巴瘤的强大活性,包括B细胞ALL,据报道成人和儿童ALL完全缓解率达66%到90%。在一些ALL患者中,CAR改造的T细胞在体内高度扩增,消除了大部分白血病负荷,在某些情况下能保持长期的持续性功能。目前还不清楚为什么不同疾病完全缓解率不一样。在我们机构,ALL和CLL使用的CTL019是一样的。本组接受治疗的CLL患者年龄往往大于ALL患者,并且CLL患者和ALL患者既往治疗方案也不一样。CLL和ALL患者的自体T细胞的活性可能会不同。CLL和ALL的肿瘤微环境很可能也不一样。CLL患者局部免疫抑制的许多机制已被确定,包括T细胞识别白血病细胞无能,微环境中免疫抑制细胞因子的产生和免疫检查点过表达,这些都会减弱和阻断免疫反应。这些发现说明使用CTL019和免疫检查点抑制剂或其他方法增强T细胞对肿瘤的识别很合适。
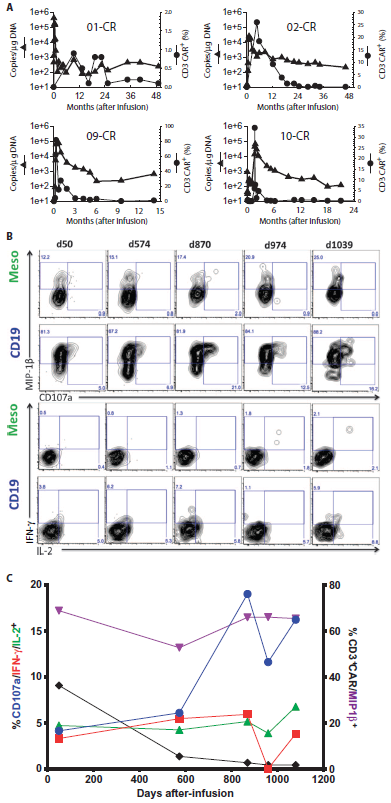
图4:获得CR的患者CTL019细胞的持续性和功能保持。(A)输注12个月后流式细胞术(实心圆)和qPCR(实心三角)检测CTL019的长期持续性。所得结果都高于流式细胞术限定值(0.1%)和qPCR的定量限定值(<25拷贝数/ mgDNA)。(B和C)在输注后纯化患者 UPCC04409-02外周血单个核细胞,与CD19 APC或对照抗原(间皮素)刺激6小时,并检测检查脱粒作用(CD107a)和细胞因子的表达。(B)等值线图显示 CD8+CAR-T细胞受到表达对照抗原或CD19 K562细胞刺激,CD107a相对于MIP-1b (上两行) 或IL-2相对于IFN-g的表达(最下行)。(C)随着时间的推移,CAR19+ CD8 T 细胞在CD19+ 靶细胞刺激下应答功能的概要图。数据来源于(B),并且去除本子集本底频率(源数据,表S9和S10)。
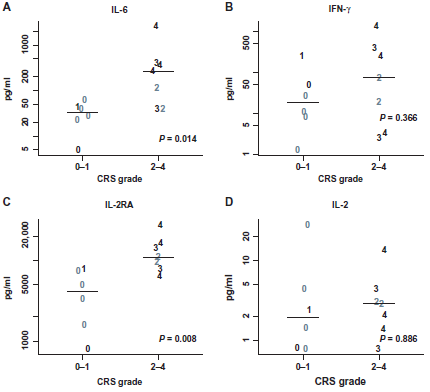
图5:输注后首月细胞因子峰值。(A到D)IL-6的峰值。(A):IFN-γ (B): IL-2受体拮抗剂 (IL-2RA) (C):IL-2 (D):CRS等级显示。灰色符号代表无反应;黑色符号代表取得了完全或部分缓解。个位数表示CRS反应等级(1到4)。Wilcoxon rank-sum检验P值。缺少1例4级CRS获得CR受试者的细胞因子值(n=13)。(源数据,表S11)。
与CAR-T细胞治疗相关的最严重的毒性是CRS。CRS是全身性的炎症反应,由高度增殖和活化的T细胞产生的高水平的炎性细胞因子引起。CRS可能会是温和的有自限性的症状,包括发烧,肌肉痛,关节痛,食欲减退和疲劳。CRS可进展为严重的致命的并发症如高烧,低血压,毛细血管渗漏,缺氧,血细胞减少和凝血功能障碍。肾功能不全很可能与低血压相关。CTCAE评分标准只适用于静脉滴注毒性,对CTL019治疗后产生的CRS不适用。我们和其他人员开发的CRS评分标准对CAR-T治疗引发的CRS产生的临床参数有更好的体现。
CRS患者的临床与生化指标与HLH或MAS一致。MAS临床和生化指标的改变会伴有噬血现象,弥漫性血管内凝血和血细胞减少症,这和我们治疗ALL患者的经历类似。在CRS高峰期至少采集一份骨髓样本,可以看到噬血现象和CD163标记的巨噬细胞活化,铁蛋白,CRP和sIL-2R显著升高是MAS/HLH的标志。2~4级CRS患者的铁蛋白,CRP和sIL-2R峰值显著高于0~1级CRS患者,且与严重CRS相关。这些改变的生化指标是有用的诊断标志物,但不用于确定是否对CRS进行干预;CRS的治疗只基于临床表现。其他研究者也观察到在ALL患者的CRS中CRP的升高,并指出CRP将预测CRS的进展。虽然收集的数据有限,但它表明铁蛋白和/或 CRP可作为CRS和对治疗应答的生物标志物,而不需要不常用的检测方法如对IL-6水平和对CAR改造的T细胞的检测。
CAR-T细胞直接相关的神经系统不良反应不常见。在5例患者中与CRS并发的神经系统不良反应由6项纪录,包括可逆性的1或2级幻觉,精神错乱或与高烧相关的谵妄,一般可通过ICU护理,镇静治疗或其他药物治疗。有1例患者发生3级CRS并持续了2天高烧相关的可逆性4级精神错乱,对其进行了ICU护理和镇静催眠治疗。在这期间对患者进行了计算机断层扫描,未发现明显异常。在其他研究中发现了更严重的CAR-T治疗相关性神经系统并发症,尤其是在ALL和NHL患者中,包括严重迟钝,脑病和癫痫发作。
神经毒性的病因尚不清除,但作者推测它可能与T细胞活化和细胞因子水平增高有关。目前还不清楚CLL患者的毒性和ALL和NHL患者是否不同;在发生CRS的少数接受治疗的患者中可发现有限的神经毒性反应。在出现和没有出现神经系统症状的患者脑脊液中可发现CAR-T细胞,这表明CAR-T细胞不会直接造成神经毒性。中枢神经系统毒性也与其他T细胞增强治疗相关,例如blinatumomab,为T细胞活化可导致神经系统不良反应这一概念提供支持。
有4例患者的CRS为自限性,5例患者血流动力学紊乱,包括低血压和缺氧,需要进行干预。高剂量糖皮质激素对1例严重CRS患者对有效。这例患者让人关注,虽然输注CTL019后获得了部分缓解,但在使用类固醇后检测到了T细胞丢失。在治疗后续的CLL患者之前,我们观察到1例儿童ALL患者IL-6显著升高并且发生严重CRS。该患者接受抗-IL-6受体拮抗剂tocilizumab治疗,严重CRS迅速得到改善,并且T细胞没有受到损失。因此在随后的患者中,使用tocilizumab被纳入了对CRS的处置。未来的研究可进一步确定CRS的预测因子,tocilizumab使用的最佳时机,替代抗细胞因子疗法的作用和是否可以对CRS进行预处理。我们的数据显示即使在使用tocilizumab症状改善后,T细胞依然可以扩增,至少在一些患者中是这样(数据未指明)。例如12号受试者,在使用tocilizumab5天后测到T细胞扩增高峰,尽管不是每天进行检测。在另一个案例中(22号受试者),在tocilizumab使用当天测到T细胞初次扩增高峰,然后降低,在第28天再次扩增。这2例患者都出现了应答。在使用tocilizumab后这些细胞能否保持功能尚不可知。我们希望在未来能收集更多的数据来证明使用tocilizumab和其他IL-6拮抗后对T细胞增殖的后续活力的影响。目前我们数据的另一个局限就是,还不清楚预防性使用IL-6拮抗剂是否能防止CRS,以及这是否会对临床抗肿瘤效应产生不良影响。
获得CR并出现B细胞再生障碍和低丙种球蛋白血症的患者,可通过静脉注射饱和剂量的丙种球蛋白来处置。1例患者获得缓解,在输注21月后死于伤口假单胞菌感染引发的脓疮坏疽并发症。他曾接受静脉注射免疫球蛋白来治疗低丙种球蛋白血症;目前还不清楚是B细胞再生障碍还是的丙种球蛋白血症导致了他的死亡,但我们提议对所有接受CAR-T治疗的低丙种球蛋白血症患者都需要静脉注射饱和剂量的免疫球蛋白。
我们试图找出入选的没有经过有效治疗的高死亡风险的CLL患者。共有10名患者没有获得CR,在输注后的1到10个月中疾病进展或死亡,这为晚期和高风险患者提供了一个佐证。尽管出现了许多令人振奋的治疗CLL新药,但能出现完全应答的很少见,并且会如预期一样进入进展期;对新的更有效的疗法有迫切的需求。值得注意的是,我们的数据显示,一些患者通过一次CTL019治疗便可获得深度持续性缓解。是否可以利用CTL019治疗更早期的肿瘤患者,或CTL019联合其他疗法如免疫调节,来提高临床应答和远期疗效仍待待确定。
细胞长期可持续性能否超过4年尚不清楚;长期随访的患者数量有限,并且我们不清楚如果CTL019消失会不会引起CLL复发。从我们治疗CLL和ALL经验来看,T细胞的持久性和白血病的无病生存率呈正相关。最终,我们需要更多的长期随访的患者来确定是否CTL019可以完全消除CLL,CAR-T细胞能否被不同的方法消除。这一方法的局限是需要从经过多次治疗的患者身上采集足够量的T细胞,并且要花费2~3周来制备CTL019。在此期间患者必须保持临床稳定以便接受治疗,并且如图S1高亮标出,有些患者想要接受治疗但却不合适这种疗法。
在一部分患者中CTL019清除白血病克隆的能力表示达到深度缓解,这使CTL019有别于其他靶向药物如ibrutinib和idelalisib,MRD的根除只出现在异基因造血干细胞移植后,说明这可能是治疗白血病的唯一方式,尽管非复发死亡率还很高。CTL019能否最终治愈CLL还要通过更久的随访来判断。CTL019治疗CLL的剂量优化研究正在进行,继续研究来明确产生应答的机制也很有必要。
原始出处:
Porter DL, Hwang WT, Frey NV, Lacey SF, Shaw PA, Loren AW, Bagg A, Marcucci KT, Shen A, Gonzalez V, Ambrose D, Grupp SA, Chew A, Zheng Z, Milone MC, Levine BL, Melenhorst JJ, June CH.Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med. 2015 Sep 2;7(303):303ra139
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CAR-#
73
#Transl#
64
#淋巴细胞白血病#
76
#TRA#
55
翻译辛苦了,非常好的文章
139
#复发性#
61
#淋巴细胞#
71
#Med#
65