刘传聚教授,最新Nature,治疗骨关节炎!
2024-01-05 BioMed科技 BioMed科技 发表于陕西省
Nav1.7阻断剂有望作为治疗OA的治疗药物,既能保护软骨免受损失,又能减轻疼痛。
骨关节炎(OA)是一种致残性的、逐渐发展的关节疾病,其主要特征是逐渐进行性的关节功能衰竭。尽管目前尚不清楚OA的主要原因是什么,但OA的病理生理过程通常涉及到关节软骨的破坏和失去正常的基质结构,这是维持关节功能所必需的抗压弹性的丧失。
研究表明,OA病变中的关节软骨细胞扮演着至关重要的角色。这些细胞作为生物力学和生化刺激的靶点,不仅受到外部环境的影响,同时也是调节关节软骨破坏的蛋白酶、细胞因子和介质的主要来源。虽然关节软骨的丧失是OA的主要表现之一,但患者最为突出的临床症状是疼痛。在OA的疼痛机制中,特殊的外周感觉神经元在关节组织中起着重要作用,而这些神经元表达特异性的钠离子通道(VGSCs),如Nav1.7、Nav1.8和Nav1.9等,这些通道在调节外周疼痛信号传导中扮演重要角色。
虽然VGSCs通常被认为存在于可兴奋细胞中,但最新的研究表明它们也存在于一些非兴奋性细胞类型中,例如软骨细胞。然而,至今关于VGSCs在软骨细胞中的存在及其在OA疾病进程和疼痛中的作用尚不为人所知。
2024年1月3日,纽约大学医学院刘传聚教授和耶鲁医学院Stephen G. Waxman合作,通过RNA测序分析鉴定OA中不同表达的基因,发现了Nav1.7作为OA中关键的控钠通道,并证实人类OA软骨细胞表达功能性Nav1.7通道,密度为每平方微米0.1至0.15个通道,每个细胞350至525个通道。连续基因消除Nav1.7在小鼠模型中显示该通道在神经元中参与疼痛传导,而在软骨细胞中调节OA的进展。药理阻断Nav1.7使用选择性或临床泛Nav通道阻滞剂显著改善了结构性关节损伤,并降低了OA疼痛行为。机制研究显示Nav1.7阻滞剂调节细胞内Ca2+信号传导和软骨细胞分泌物,对软骨细胞生物学特性和OA发展产生影响。该研究成果以“Nav1.7 as a chondrocyte regulator and therapeutic target for osteoarthritis”为题,发表在Nature上。第一作者是纽约大学医学院的Wenyu Fu。

【OA软骨细胞Nav1.7电生理学】
在OA患者的软骨细胞中,Nav1.7的表达水平明显升高。通过分子分析、RT-PCR、蛋白水平分析以及组织学检测等多种方法,研究发现Nav1.7在OA软骨中的表达水平显著增加。这表明Nav1.7在软骨细胞中的表达与OA的发展和进展密切相关。
在控制条件下以及加入1微米TTX(可以阻断除Nav1.5、Nav1.8和Nav1.9外的所有Nav通道)的情况下,对-50mV、-30mV、-10mV和10mV测试脉冲的典型电流示踪。右侧显示的是经过TTX减去TTX-R(TTX-抗性)电流后得到的TTX-S(TTX-敏感)电流(图1a)。TTX-S电流显示出在-40mV阈值开始激活,0mV时具有最大峰值电流,并显示钠电流反转电位(Er)为-60.6±2.3mV(图1b)。使用电压为半最大激活(V1/2)= -14.2±0.8mV,斜率系数(k)= 6.1±0.2mV的Boltzmann方程对TTX-S电流的G/Gmax进行了拟合(图1c)。对TTX-S电流进行动力学分析显示,其失活时间常数随膜电压增加而逐渐减少,从-20mV时的3.3±0.8ms降至50mV时的0.3±0.1ms(图1d)。TTX-S电流的峰值出现时间从-20mV时的1.8±0.2ms逐渐减少至50mV时的0.5±0.1ms(图1e)。通过记录钠电流,在20纳米ProTx II应用前后进行比较。蓝色曲线显示了受ProTx II作用的电流(ProTx II-S),红色曲线显示了受1微米TTX作用的电流(图1f和g)。TTX-S和ProTx II-S电流峰值归一化后的重叠图显示了它们相似的时间特性(图1h)。比较了TTX-S和ProTx II-S电流的动力学参数,包括失活时间常数和峰值时间。结果显示两者之间没有显著差异(图1i)。对不同药物(TTX和ProTx II)对电流的影响进行了评估,显示Nav1.7对OA软骨细胞中的钠电流产生重要影响(图1j)。
这些结果表明Nav1.7在OA软骨细胞中的存在,并显示出与已知的Nav1.7类似的电生理特性和对ProTx II的抑制效果。通过记录77个OA患者的软骨细胞,结果表明约17%的细胞产生具有快速失活组分的内向钠电流。
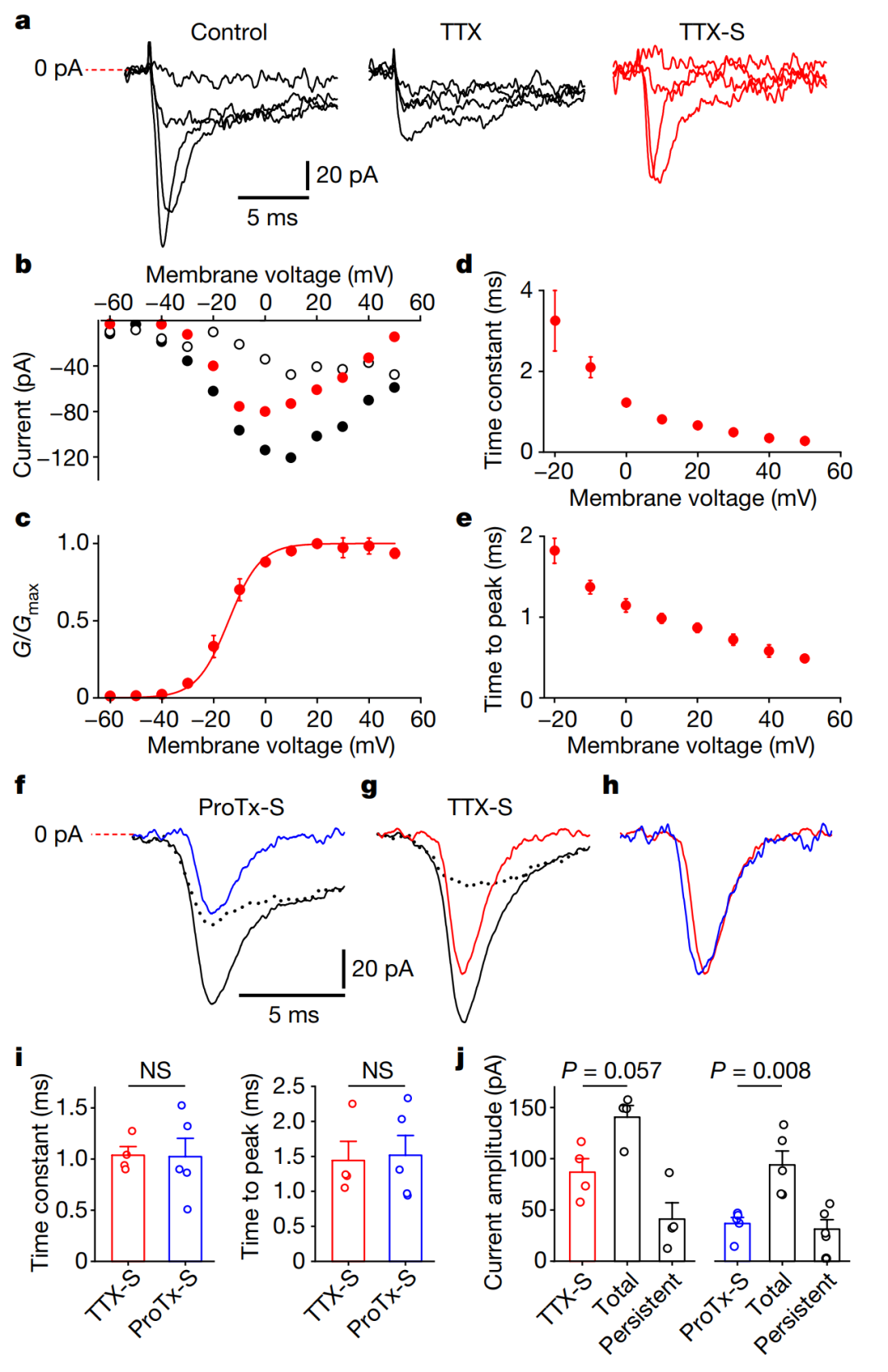
图1 | OA软骨细胞中存在TTX-S电流,主要由Nav1.7 ProTx II-S通道产生。
【软骨细胞中Nav1.7的删除可免受OA影响】
在实验中删除软骨细胞和DRG神经元中的Nav1.7明显减轻了膝盖关节软骨的丧失,并降低了关节炎研究国际协会(OARSI)评分,表明Nav1.7在关节炎进展中发挥作用(图2a和b)。
在Nav1.7DRG;chondrocyte小鼠中,观察到显著减少的骨赘形成、骨下骨板增厚、伴有较少滑膜炎证据,这暗示Nav1.7在DMM(内侧半月板不稳定)模型中影响OA结构性病变(图2c至e)。在行动活性和机械性痛觉敏感性测试中,Nav1.7DRG;chondrocyte小鼠展现出更高的整体活动距离和明显减少的机械性痛觉过敏(图2f至h)。将Nav1.7在软骨细胞中删除后,观察到DMM诱导的软骨丢失、骨赘形成、骨下骨板增厚和滑膜炎评分的显著减少,同时也减轻了行动活性丧失和机械性痛觉过敏(图2i至m)。删除软骨细胞中的Nav1.7减少了DMM模型中的痛觉行为,表明Nav1.7在软骨细胞中对OA相关的疼痛行为具有调控作用(图2n至p)。这些结果表明,软骨细胞和DRG神经元中表达的Nav1.7同时对调节OA的进展和相关疼痛具有重要作用。
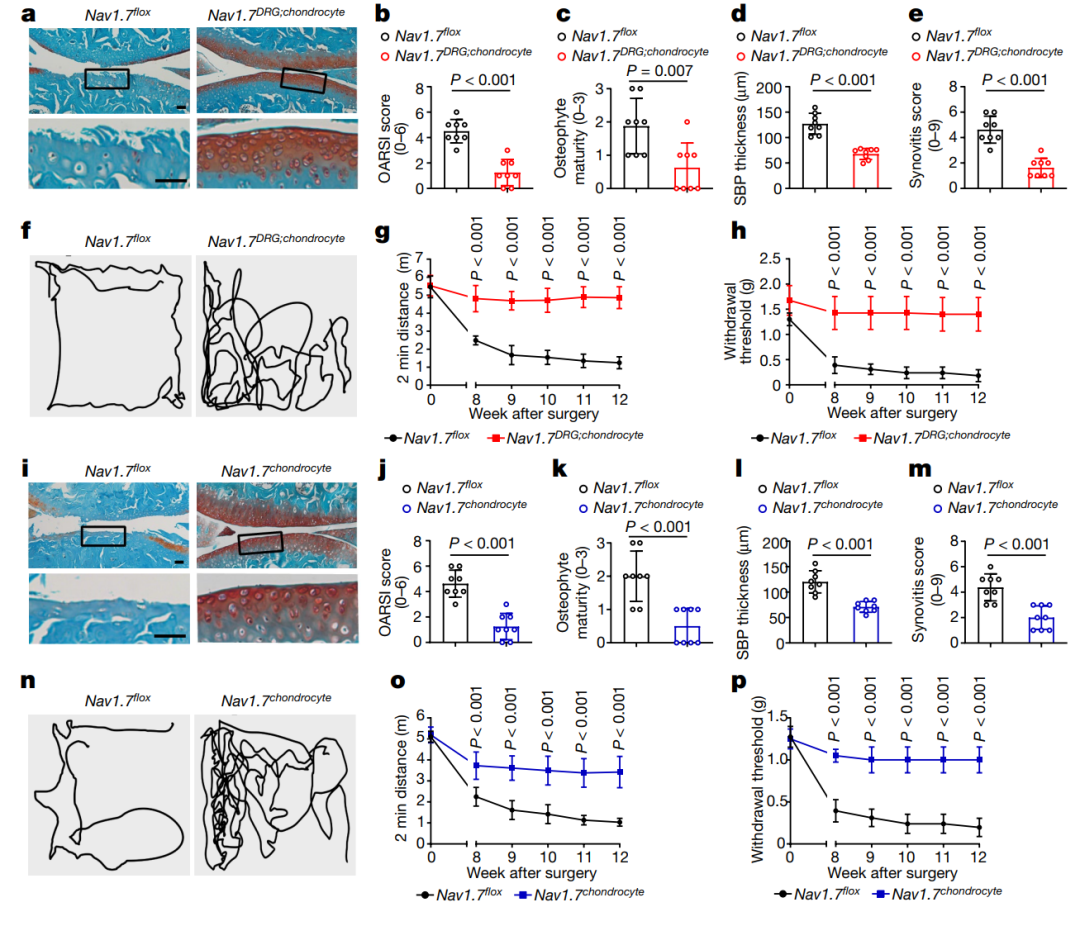
图2 | 软骨细胞Nav1.7消除保护免受骨关节炎侵害并减轻疼痛。
【Nav1.7阻断调节软骨细胞】
Nav1.7阻断在OA模型中对软骨细胞产生促进合成和抑制分解的效应。通过对软骨细胞进行体外研究,发现IL-1β诱导的编码分解分子的基因表达(如MMP13、ADAMTS5、COX2和NOS2)受到1µM TTX的抑制。ProTx II和PF-04856264等Nav1.7选择性阻断剂也表明了Nav1.7在抑制IL-1β诱导的分解作用中的重要性。从PF-04856264和ProTx II处理的分泌物中筛选出满足一定条件的蛋白质,进一步鉴定了HSP70和midkine作为特定调节因子(图3a和b)。通过添加特定抗体验证了这些条件培养基对软骨细胞生物学的影响,显示出HSP70和midkine在条件培养基对软骨细胞生物学功能的影响(图3c和d)。PF-04856264对DMM小鼠关节炎的保护作用被HSP70抑制剂VER 155008和midkine抑制剂iMDK抵消,暗示了HSP70和midkine在Nav1.7抑制介导的OA保护作用中的重要性(图3e至g)。Nav1.7的阻断通过增加HSP70和midkine的分泌来调节软骨细胞的新陈代谢,影响软骨的健康状态和OA的发展,进而揭示了HSP70和midkine在OA进程中的重要作用。
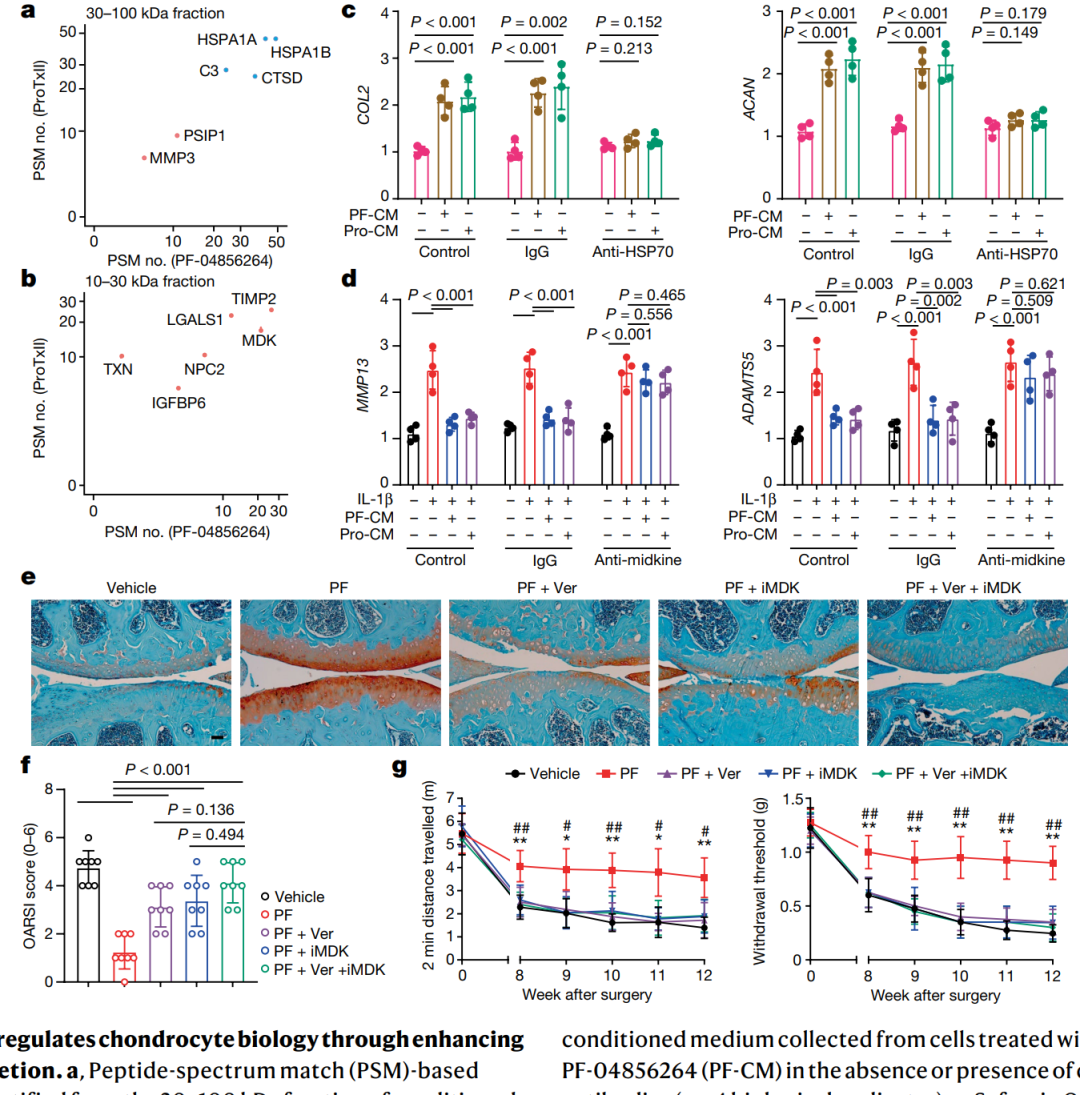
图3 | Nav1.7阻断通过增强HSP70和midkine的分泌调节软骨细胞生物学。
【Nav1.7阻断改变软骨细胞的Ca2+】
使用共聚焦显微镜和板阅读器测量显示,Nav1.7阻断(使用ProTx II或PF-04856264)导致人类OA软骨细胞和C28I2软骨细胞内Ca2+水平的变化。Nav1.7阻断减少了ATP刺激引起的初始胞内Ca2+的迅速增加,但随后导致持续时间更长的高Ca2+水平(图4a和4b)。在C28I2细胞中,钙离子载体ionomycin和细胞内可渗透的钙螯合剂BAPTA-AM的实验表明,更高的Ca2+信号通过Nav1.7阻断有助于调节HSP70和midkine的分泌。BAPTA-AM存在时,Nav1.7阻断对HSP70和midkine的增强分泌效应消失(图4c和4d)。使用NCX(钠钙交换蛋白)抑制剂KB-R7943预先抑制NCX后,对ATP刺激后软骨细胞胞内Ca2+浓度的调节作用显示,NCX对Nav1.7阻断后胞内Ca2+信号的调节起重要作用(图4e)。NCX抑制剂KB-R7943也使Nav1.7阻断导致的HSP70和midkine增强分泌效应消失(图4f和4g)。RT-PCR实验表明,C28I2细胞中NCX家族蛋白NCX1(也称为SLC8A1)的mRNA清晰可见,而NCX2和NCX3无法检测到(图4h)。在NCX1短干扰RNA(siRNA)敲除后,PF-04856264对Ca2+信号和HSP70、midkine分泌的调节效应基本消失(图4i至4l)。这些结果表明软骨细胞内Ca2+信号对Nav1.7阻断后HSP70和midkine增强分泌至关重要,并强调了NCX1在调节Nav1.7阻断对软骨细胞胞内钙信号和相关蛋白分泌中的关键作用。
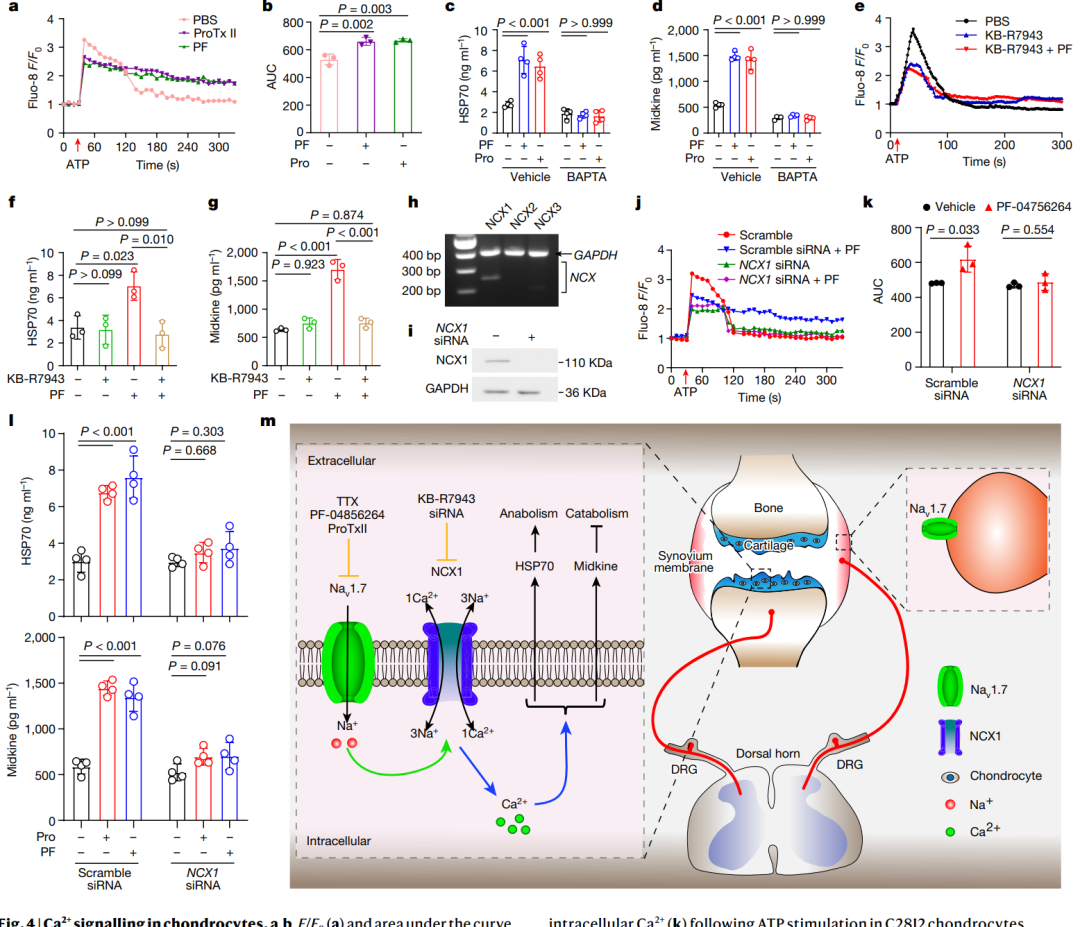
图4 | 软骨细胞中的Ca2+信号传导。
【小结】
这项研究发现Nav1.7是一种与OA相关的离子通道,在OA治疗中可能成为疾病修复和缓解疼痛的潜在治疗靶点——DRG神经元表达的Nav1.7参与疼痛,而软骨细胞表达的Nav1.7调控软骨细胞生物学、软骨损失以及OA所导致的疼痛(图4m)。总之,Nav1.7阻断剂有望作为治疗OA的治疗药物,既能保护软骨免受损失,又能减轻疼痛。
原文链接:
https://doi.org/10.1038/s41586-023-06888-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#骨关节炎# #Nav1.7阻断剂#
55