鹿茸草神奇疗效:如何通过调节代谢与α7nAChR-TLR4/NF-κB p65信号通路改善急性肺损伤?
2024-04-26 梅斯循证中医药 MedSci原创 发表于陕西省
该研究不仅为LRC提取物在ALI治疗领域的新药研发与临床应用提供了坚实的科学支撑,同时为深入探索中药复杂机制系统网络构建了有效的研究框架。
急性肺损伤(Acute Lung Injury,简称ALI)是一种严重的呼吸系统疾病,其主要特征为炎症和肺组织损伤,是脓毒症中常见且具有重要临床意义的并发症。鉴于其对健康有严重影响,对脓毒症引发的急性肺损伤实施预防性治疗具有非常重要的医学价值。
其发生和发展涉及多种复杂的分子机制,其中包括炎症反应和氧化应激。在分子层面,内毒素与免疫细胞中的Toll样受体4(TLR4)进行相互作用,进而诱导核因子kappa-B(NF-κB)的活性。一旦被激活,NF-κB将释放肿瘤坏死因子-α和IL-6等促炎细胞因子,从而触发炎症反应。
鹿茸草(LRC)是一种具有清热、解毒、祛风止痛等功效的中草药。内含多种活性成分,包括黄酮、生物碱、皂苷和多糖等,因此被广泛用于治疗呼吸道疾病。据科学研究显示,LRC对脂多糖(LPS)诱导的大鼠ALI具有明显的肺保护作用。
一篇名为“Monochasma savatieri Franch. protects against acute lung injury viaα7nAChR-TLR4/NF-κB p65 signaling pathway based on integrated pharmacology analysis”的文章揭示了LRC治疗ALI的潜力。

图1 论文首页
LRC提取物显著改善LPS诱导的体内ALI
研究经过腹膜内注射LPS诱导ALI动物模型,并对模型进行LRC提取物预处理(图2A)。为深入研究LRC提取物的药效,研究对LPS诱导的ALI小鼠分别给予了200、400和800mg/kg的LRC提取物剂量。肺组织的病理状态通过H&E染色进行评估。相较于对照组,LPS实验组呈现出了显著的组织学变化,包括肺泡壁增厚、间质水肿以及炎性细胞广泛浸润到肺泡间隙。然而,LRC提取物有效地缓解了LPS诱导的病理变化,并且这种效果呈现出剂量依赖性(图2B和C)。
随即,研究量化了LRC提取物对LPS诱导的ALI期间肺水肿和微血管通透性的影响。结果显示,LRC提取物组显著降低了肺组织的湿/干重比(图2D)、组织提取物中的髓过氧化物酶(MPO)活性(图2E)以及支气管肺泡灌洗液(BALF)中的蛋白质含量(图2F)。结果表明,LRC提取物能够改善LPS诱导的微血管通透性和肺水肿。
此外,研究还测定了ALI模型中一些重要指标的活性,包括一氧化氮合酶(iNOS)(图2G)和环氧化酶(COX2)(图2H)。这些指标在肺组织中被LPS激活,但随后被LRC提取物所抑制。这些研究结果表明,LRC提取物对LPS引起的肺泡血管屏障破坏、肺水肿和细胞损伤具有显著的改善作用。其中,高剂量LRC组(800 mg/kg)的效果最为显著。
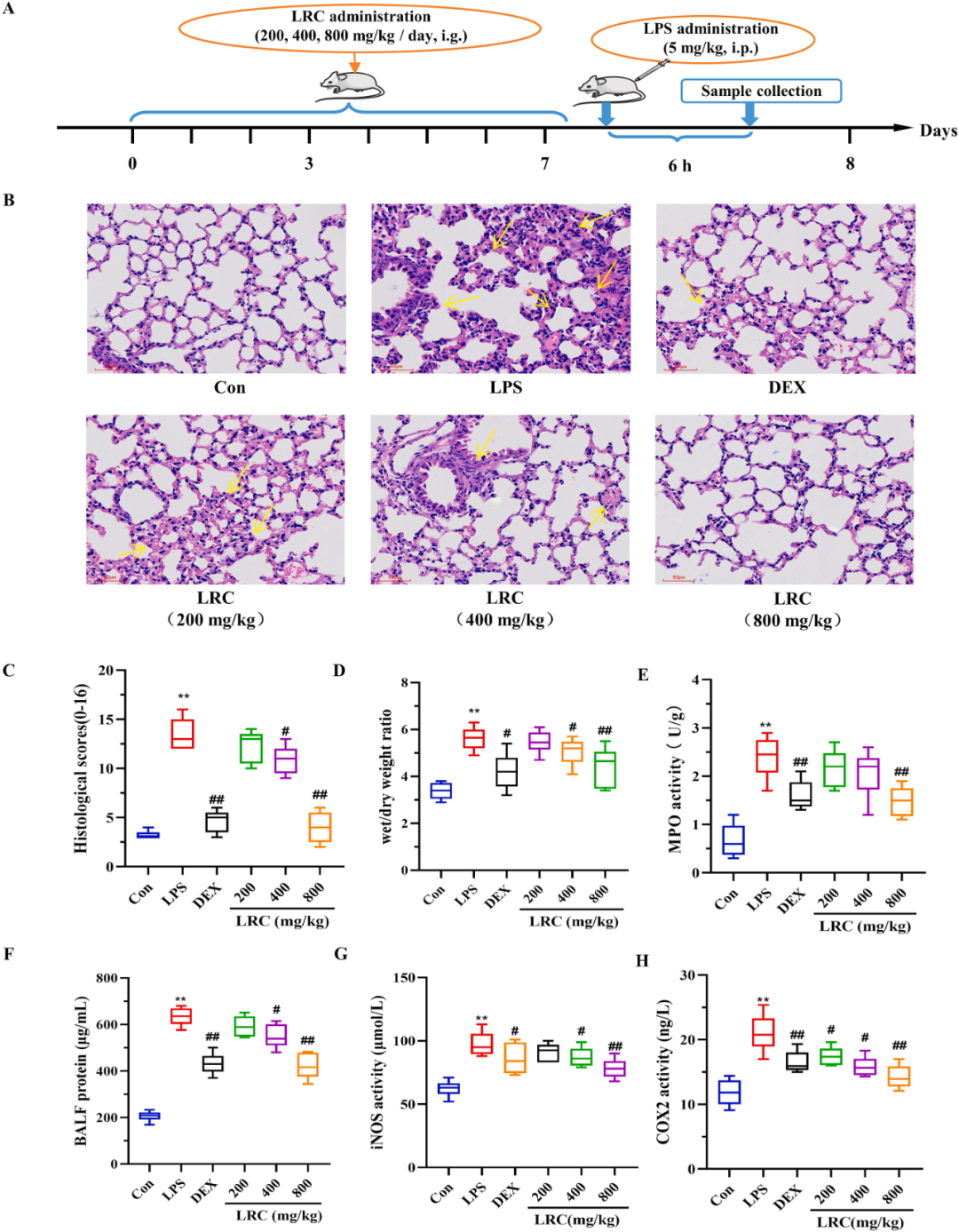
图2 LRC提取物在体内对LPS诱导的ALI有保护作用
LRC提取物通过降低LPS诱导的ALI中细胞凋亡相关蛋白的表达抑制细胞凋亡
为进一步评估LRC提取物对ALI模型小鼠细胞凋亡和组织损伤的影响,研究采用TUNEL染色技术来检测肺组织中凋亡细胞的数量,并利用免疫组织化学染色方法测定了Bcl-2和Bax的表达水平(图3A-D)。同时,研究还运用ELISA技术测定了肺组织中胱天蛋白酶-3、-8和-9的活性(图3E-G)。
结果显示,LPS组小鼠肺组织中凋亡细胞数量显著增加,Bcl-2水平明显降低,而Bax水平相应上升。此外,胱天蛋白酶-3、-8和-9的活性也显著增强。然而,在接受LRC提取物治疗后,细胞凋亡的数量明显减少,Bcl-2的表达得到增强,Bax的表达受到抑制,胱天蛋白酶-3、-8和-9的活性也受到抑制。
综上所述,LRC提取物具有抑制ALI小鼠肺细胞凋亡的潜力,这可能为其在ALI治疗中的应用提供新的思路。
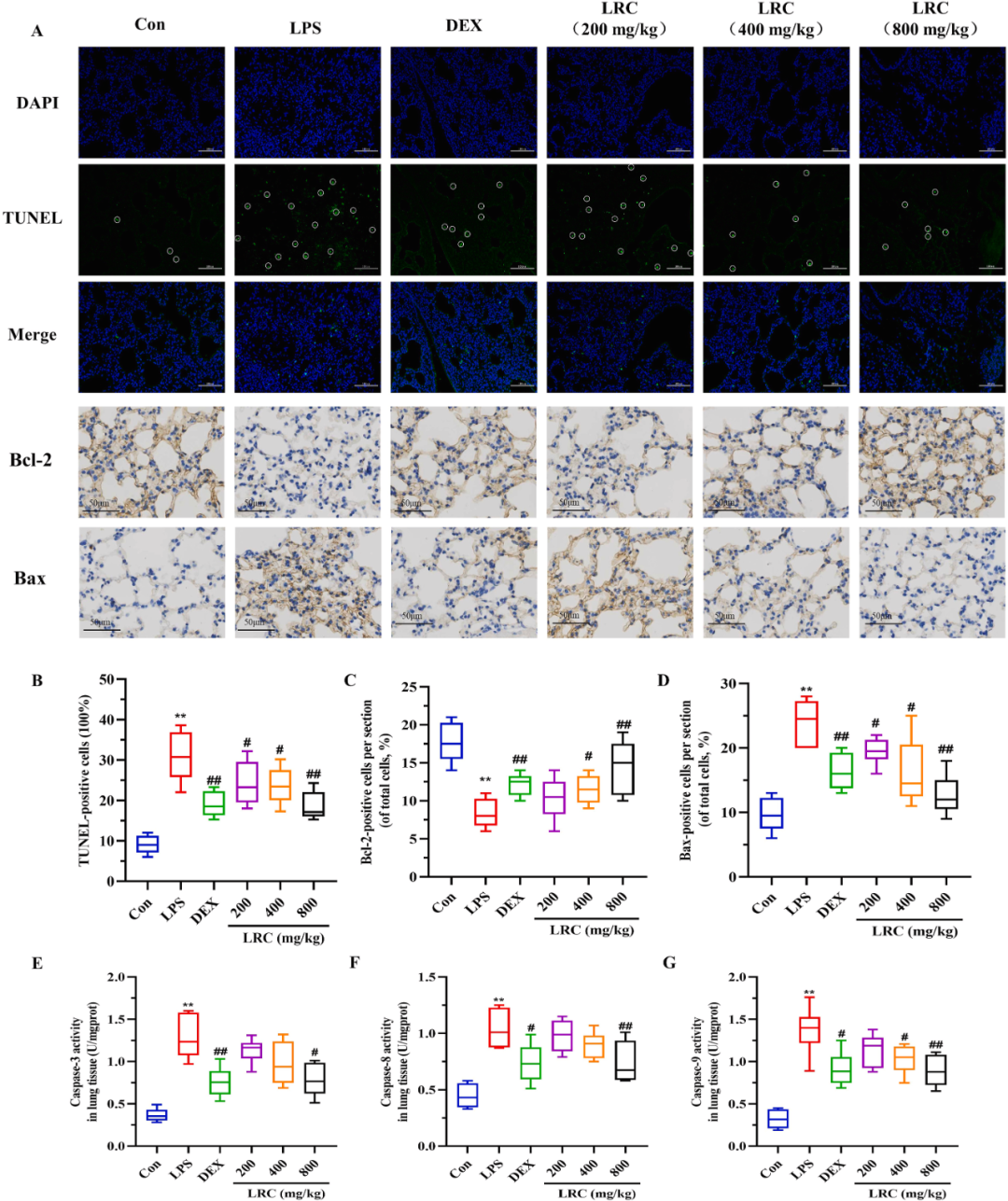
图3 LRC提取物通过降低LPS诱导的ALI中细胞凋亡相关蛋白的水平来抑制细胞凋亡
LRC提取物减轻ALI模型小鼠肺部氧化损伤
经过代谢组学分析,研究发现肌肽、谷氨酸和牛磺酸等抗氧化代谢产物的生成均发生了显著变化。为了验证LRC提取物对氧化应激的调控作用,研究进一步评估了肺组织中MDA、SOD和GSH的含量。MDA作为膜脂质过氧化的重要产物,是衡量细胞和组织氧化损伤程度的关键指标。同时,超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)在体内担任着重要的抗氧化角色,能够有效保护细胞免受氧化损伤。实验结果证实了在LPS诱导的ALI模型小鼠中,预先给予800 mg/kg的LRC提取物能够显著降低组织中的MDA水平,并增强SOD和GSH-Px的活性(图4A-C)。由此可见,LRC提取物对氧化应激具有明显的调控作用,对保护细胞和组织免受氧化损伤具有重要意义。
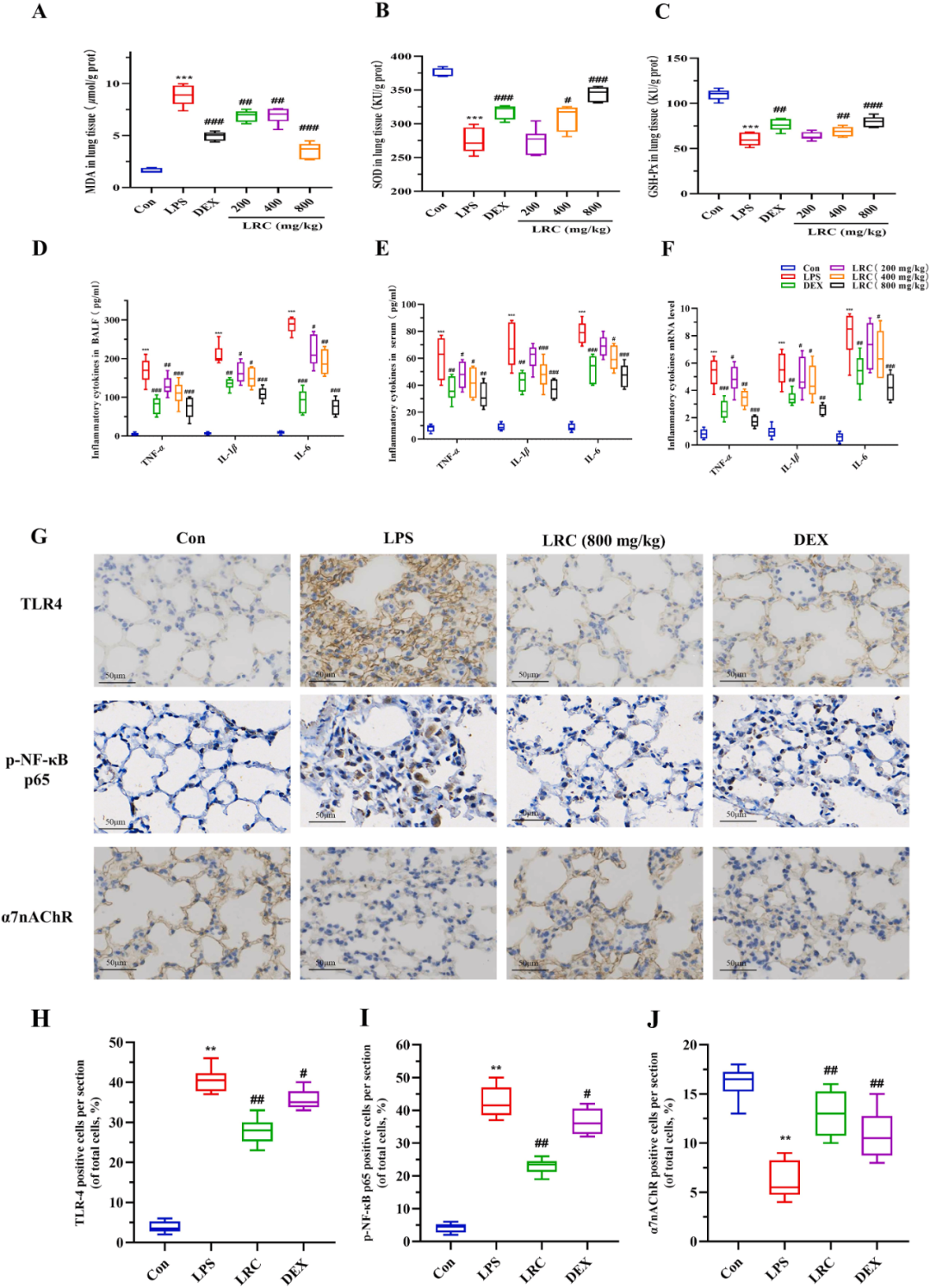
图4 LRC提取物通过激活CAP和抑制TLR4/NF-κB信号通路抑制LPS诱导的ALI的炎症反应和氧化应激
LRC提取物抑制LPS诱导的急性肺损伤的炎症反应
随着ALI的发展,局部促炎性细胞因子如肿瘤坏死因子TNF-α、白细胞介素IL-1β和IL-6在诱导中性粒细胞向肺部浸润方面起着关键作用。综合网络药理学与代谢组学的研究成果,研究者发现炎症与ALI发病机制的多个层面紧密相连。为进一步探究LRC提取物对这些关键细胞因子在体内的表达影响。研究利用酶联免疫吸附试验(ELISA)技术,测量了血清和支气管肺泡灌洗液(BALF)中这些目标因子的浓度水平(图4D、E),并评估它们在局部肺组织中的相对表达量(图4F)。结果表明,高剂量组(800mg/kg)的LRC提取物能够显著抑制由LPS诱导的ALI小鼠体内TNF-α、IL-1β和IL-6水平的上升,进一步证实了LRC提取物通过抑制炎症反应来保护ALI小鼠肺部的功效。
LRC提取物通过抑制α7nAChR介导的TLR4/NF-κB p65炎症反应预防ALI
基于网络药理学通路预测的证据,研究运用免疫组织化学染色技术,对肺组织中TLR4和p-NF-κB p65的表达水平进行了精确的测量。这两种分子是炎症反应的关键介导者。在随后的肺组织代谢组学分析中,研究者进一步测量了肺组织中TLR4、p-NF-κB p65和α7nAChR的表达水平,以揭示LRC提取物抗ALI的具体机制(图4G)。
在ALI模型组中,通过免疫组织化学染色观察到,与空白对照组相比,TLR4和p-NF-κB p65的阳性表达区域显著增多。然而,当给予LRC提取物(800 mg/kg)干预后,TLR4和p-NF-κB p65蛋白的表达水平明显降低(图4H、I)。此外,LPS组中α7nAChR的表达下调,而在LRC组中观察到其表达水平的恢复,这证实了LRC提取物确实能够调节CAP(图4J)。
综上所述,LRC提取物具有通过增强α7nAChR表达、刺激CAP和抑制TLR4/NF-κB信号通路来减少炎症反应的能力,从而发挥预防ALI的作用。
结论
该研究不仅为LRC提取物在ALI治疗领域的新药研发与临床应用提供了坚实的科学支撑,同时为深入探索中药复杂机制系统网络构建了有效的研究框架。
参考文献:
Zhao M, Yang M, Du J, Cao X, Zhong L, Li W, Chen Y, Peng M, Guo H, Zhou T, Zhang C, Ren Z, Ding Z, Zhong R, Wang Y, Shu Z. Monochasma savatieri Franch. protects against acute lung injury via α7nAChR-TLR4/NF-κB p65 signaling pathway based on integrated pharmacology analysis. J Ethnopharmacol. 2024 Mar 1;321:117487. doi: 10.1016/j.jep.2023.117487
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














精彩评论,需要您登录查看
47
#急性肺损伤# #鹿茸草#
0