Br J Cancer:安罗替尼通过靶向EGFR抑制未分化甲状腺癌的血管生成作用
2021-06-06 xiaozeng MedSci原创
甲状腺癌是一种最普遍的内分泌恶性肿瘤,其发病率逐年升高。
甲状腺癌是一种最普遍的内分泌恶性肿瘤,其发病率逐年升高。 未分化甲状腺癌(ATC)作为甲状腺癌中恶性程度最高的一种,虽然其仅占所有甲状腺癌的1-2%。但由于ATC的高侵袭性,其是造成大多数甲状腺癌相关死亡的主要原因。
与分化型甲状腺癌不同,ATC对手术、化疗以及同位素干预均具有抵抗力。据报道,即使采用相应的靶向治疗,患者的生存率也未得到改善。
ATC的发生发展取决于血管生成信号转导通路,并由缺氧应激作用所促进。缺氧诱导的血管生成是恶性肿瘤的一大主要生存途径。HIF1α(缺氧诱导因子1α)是参与氧气反应的关键调节因子,也介导肿瘤和血管细胞之间串扰的通路。
尽管缺氧诱导的血管生成在ATC发生发展中发挥着重要的作用。然而,广谱抗血管生成剂的治疗潜力仍未确定。
安罗替尼(Anlotinib)是一种新型的多靶点受体酪氨酸激酶(RTK)抑制剂,其可以阻断VEGF/PDGF/FGF诱导的血管生成作用。该研究旨在探讨安罗替尼在ATC缺氧诱导的血管生成调控网络中的作用。
研究人员通过组织微阵列建立了分子表达谱系。并采用多种测定方法(小管形成、3D发芽和鸡绒毛尿囊膜模型)评估血管生成作用。
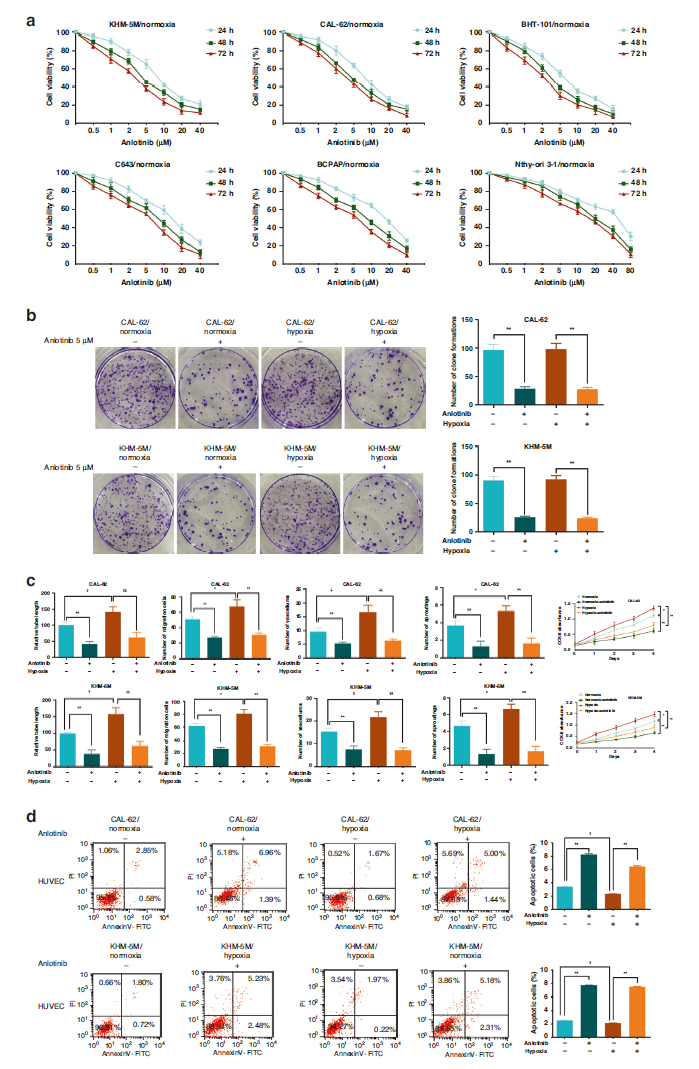
安罗替尼抑制ATC中缺氧激活的血管生成
结果显示,在常氧和缺氧条件下,安罗替尼可通过剂量依赖性和时间依赖性方式抑制细胞的活性,且可更有效地抑制缺氧激活的血管生成。研究人员发现,在缺氧状态下CXCL11和磷酸化EGFR的表达水平上调且呈正相关。
进一步的研究发现,癌细胞-内皮细胞串扰可能是由CXCL11-EGF-EGFR的正向反馈回路所介导,而安罗替尼能够通过双重机制直接靶向EGFR,同时对癌症和内皮细胞产生抑制作用,并阻断该回路。而AKT-mTOR通路同样参与了这个调控网络。
安洛替尼可延缓体内肿瘤的发生
总而言之,该研究结果揭示,CXCL11-EGF-EGFR信号通路的发现为缺氧状态下癌细胞和内皮细胞之间相互作用提供了潜在的分子机制,而EGFR或可成为一个新型的靶点,且安罗替尼可能是ATC的一个潜在的治疗候选药物。
原始出处:
Liang, J., Jin, Z., Kuang, J. et al. The role of anlotinib-mediated EGFR blockade in a positive feedback loop of CXCL11-EGF-EGFR signalling in anaplastic thyroid cancer angiogenesis. Br J Cancer (04 June 2021).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#GFR#
36
#甲状腺癌#采用#抗血管新生#治疗效果是不错的,#安罗替尼#是其中之一。
203