Neuron:陕西中医药大学罗层等揭示了慢性疼痛过程中伤害性感觉-运动相互作用的细胞和回路基础
2025-04-18 iNature iNature
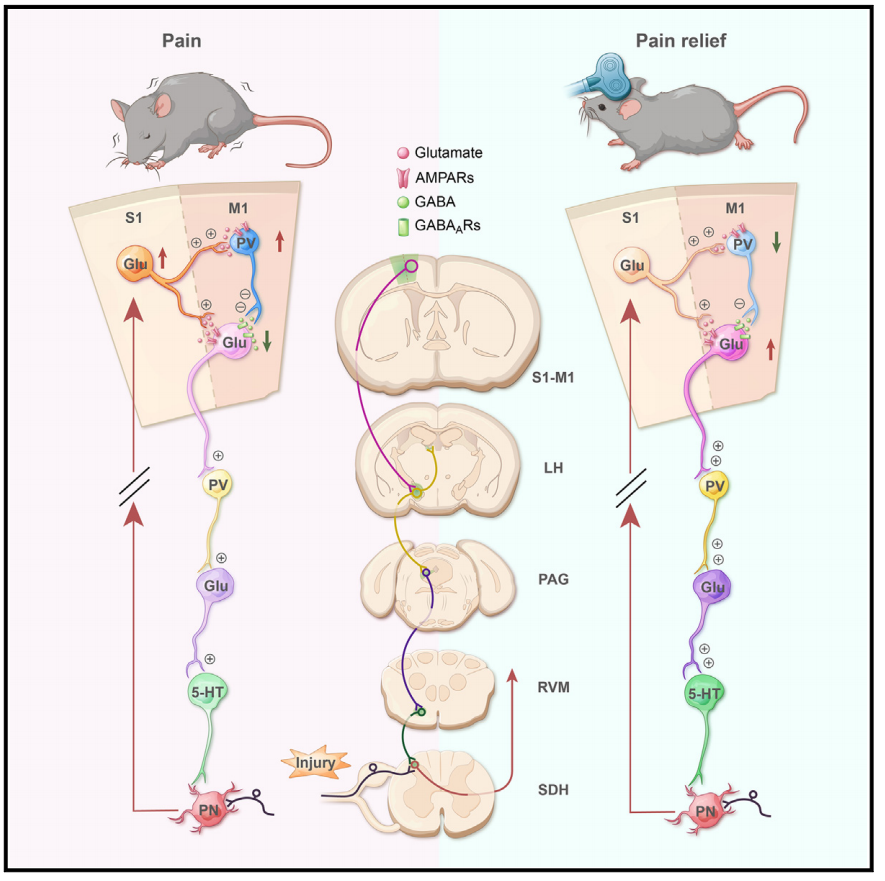
该研究发现,损伤/炎症通过初级体感皮层(S1)和M1之间的兴奋-抑制失衡导致M1Glu锥体神经元活性降低。
感觉-运动整合在慢性疼痛的过程中至关重要。初级运动皮质(M1)正在成为慢性疼痛治疗的一个有希望的靶点。然而,伤害性感觉输入如何影响M1活动,以及纠正M1缺陷如何反过来在细胞和网络水平调节疼痛处理,仍然难以捉摸。
2025年4月15日,陕西中医药大学罗层、空军军医大学武胜昔共同通讯在Neuron在线发表题为“A sensory-motor-sensory circuit underlies antinociception ignited by primary motor cortex in mice”的研究论文,该研究发现,损伤/炎症通过初级体感皮层(S1)和M1之间的兴奋-抑制失衡导致M1Glu锥体神经元活性降低。
受损的M1输出进一步削弱了对外侧下丘脑(LHPV)的兴奋性小清蛋白神经元的输入,并损害了下行抑制系统,因此加剧了脊髓伤害感受性。当用重复经颅磁刺激(rTMS)矫正M1缺陷时,可以有效地逆转S1-M1微电路的不平衡,这有助于恢复M1触发下行抑制系统的能力,从而减轻伤害感受性超敏反应。因此,感觉-运动-感觉环路被确定为感觉和运动系统之间与疼痛相关的相互作用,并可能被用于治疗慢性疼痛。

疼痛是一种多维体验,由感觉辨别、情感动机和认知评估组成。超过50%–60%的慢性疼痛患者无法从多种药物组合中获益,包括传统的镇痛药和抗抑郁药。为了克服这一困境,神经调节正成为医学难治性疼痛患者的替代治疗方法。其中,初级运动皮层刺激(MCS)已被证明是治疗顽固性慢性疼痛综合征的有效疗法。初级运动皮层(M1),主要是这表明感觉-运动整合在慢性疼痛的过程中是至关重要的。然而,感觉和运动系统之间与疼痛相关的相互作用却知之甚少。最近的一项研究报道,M1相关回路的光遗传激活缓解了小鼠的神经病理性疼痛,但没有缓解基础伤害感受。尽管如此,M1激活诱导镇痛的根本原因很少被阐明。
首先,上行伤害性感觉输入如何影响M1的活动仍然难以捉摸。我们对慢性疼痛中M1活动的了解主要局限于功能成像和皮质内记录的宏观观察,如灰质减少慢性疼痛个体的体积、血流量减少和皮质脊髓兴奋性抑制。迄今为止,没有一项研究阐明了持续伤害性刺激后M1在微观和中观水平上发生可塑性变化的确切细胞和回路基础。令人信服的证据表明,从背根神经节(DRG)到初级体感皮层(S1),沿上行疼痛通路的神经元可塑性增加在慢性疼痛的发展中具有重要意义。S1是一个关键的中继,它整合了疼痛感觉-辨别维度的疼痛相关信息。S1显示出与M1的广泛联系,感觉运动相互作用与各种病理生理过程有关。然而,对S1-M1相互作用在慢性疼痛过程中的作用知之甚少。
机理模式图(图源自Neuron)
该研究描述了慢性疼痛过程中伤害性感觉-运动相互作用的细胞和回路基础。在损伤/炎症时,持续的伤害性输入诱导S1Glu神经元的活性增强,这优先增加M1PV神经元的前馈抑制,导致S1Glu/M1PV/Glu回路中不平衡的兴奋-抑制,并导致M1Glu锥体神经元的总体输出减少。M1输出的下调活性反过来削弱了对外侧下丘脑(LHPV)投射神经元的兴奋性小白蛋白神经元的兴奋性输入,并进一步削弱了下行抑制系统,因此加剧了脊髓伤害感受性。当用诸如rTMS的策略刺激M1时,可以有效地逆转S1-M1微回路中兴奋-抑制的不平衡,这有助于恢复M1触发下行抑制系统的能力,从而减轻伤害感受性超敏反应。因此,这项研究为持续伤害性输入如何导致M1的适应性不良可塑性,以及纠正M1缺陷如何反过来调节伤害性超敏反应提供了新的见解。
参考信息:
https://www.cell.com/neuron/fulltext/S0896-6273(25)00246-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#慢性疼痛# #M1Glu#
10