ACS Nano:环氧合酶抑制剂在三阴性乳腺癌中加强紫杉醇诱导的免疫原性细胞死亡
2024-06-05 BioMed科技 BioMed科技 发表于威斯康星
浙江大学医学院王伟林教授、Yang Du、毛峥伟教授和丁元研究员等人研究了选择性环氧合酶抑制剂塞来昔布(CXB)通过阻断肿瘤细胞中PGE2的生物合成来增强PTX诱导ICD的潜力。
三阴性乳腺癌(TNBC)是一种高度侵袭性的恶性肿瘤,一直缺乏有效的靶向治疗策略。在肿瘤细胞中诱导免疫原性细胞死亡(ICD)是通过促进抗肿瘤免疫来提高疗效的一种有前途的策略。紫杉醇(PTX)是TNBC常用的化疗药物,可诱导ICD;然而,由此产生的免疫原性十分有限。因此,迫切需要探索通过结合免疫调节剂来提高TNBC中ICD有效性的策略。
在本研究中,浙江大学医学院王伟林教授、Yang Du、毛峥伟教授和丁元研究员等人研究了选择性环氧合酶抑制剂塞来昔布(CXB)通过阻断肿瘤细胞中PGE2的生物合成来增强PTX诱导ICD的潜力。研究观察到,CXB和PTX的组合促进了树突状细胞的成熟,并引发了T细胞依赖性免疫反应,从而在疫苗接种试验中增强了肿瘤排斥反应。为了进一步优化体内药物递送,作者还开发了cRGD修饰的脂质体,用于CXB和PTX的靶向共递送。该递送系统显著改善了TNBC原位小鼠模型中的药物积累并引发了强大的抗肿瘤免疫。此外,它还可以作为原位疫苗抑制肿瘤复发和肺转移。总的来说,上述研究发现为CXB和PTX组合的治疗机制提供了深入的见解,突出了它们作为TNBC有效的免疫疗法的潜力。相关工作以“Celecoxib Augments Paclitaxel-Induced Immunogenic Cell Death in Triple-Negative Breast Cancer”为题发表在ACS Nano。

【文章要点】
除了产生免疫刺激性损伤相关分子模式(DAMP)外,最近的研究结果还表明,化疗诱导的细胞死亡还可引发免疫抑制分子的爆炸性释放,如前列腺素E2(PGE2),它可以减弱垂死肿瘤细胞的免疫原性。PGE2属于一组来源于花生四烯酸的类二十烷脂介质,对TME中的多种免疫细胞具有免疫抑制作用。例如,PGE2已被证明通过CERB途径将M1巨噬细胞转化为M2巨噬细胞,从而抑制抗肿瘤免疫。此外,PGE2可以通过激活β-连环蛋白信号传导来促进肿瘤逃避,从而抑制TME中CD103+DCs的功能。此外,阻断PGE2-EP2/EP4-cDC1轴已被证明可防止肿瘤中的cDC1功能障碍,从而使抗癌CD8+T细胞反应重新激活。目前,已经有研究观察到PTX治疗后肿瘤内PGE2水平升高的现象。因此,抑制肿瘤细胞内PGE2生物合成有望增强PTX诱导的ICD并增强针对肿瘤的免疫反应。为此,本工作研究了塞来昔布(CXB)与PTX联合治疗TNBC的情况。塞来昔布是一种选择性环氧合酶-2(COX-2)抑制剂,在临床上广泛用于抑制PGE2的合成。研究结果表明,CXB可以通过激活DC介导的免疫和引发抗肿瘤疫苗效应来增强PTX诱导的ICD(图1)。
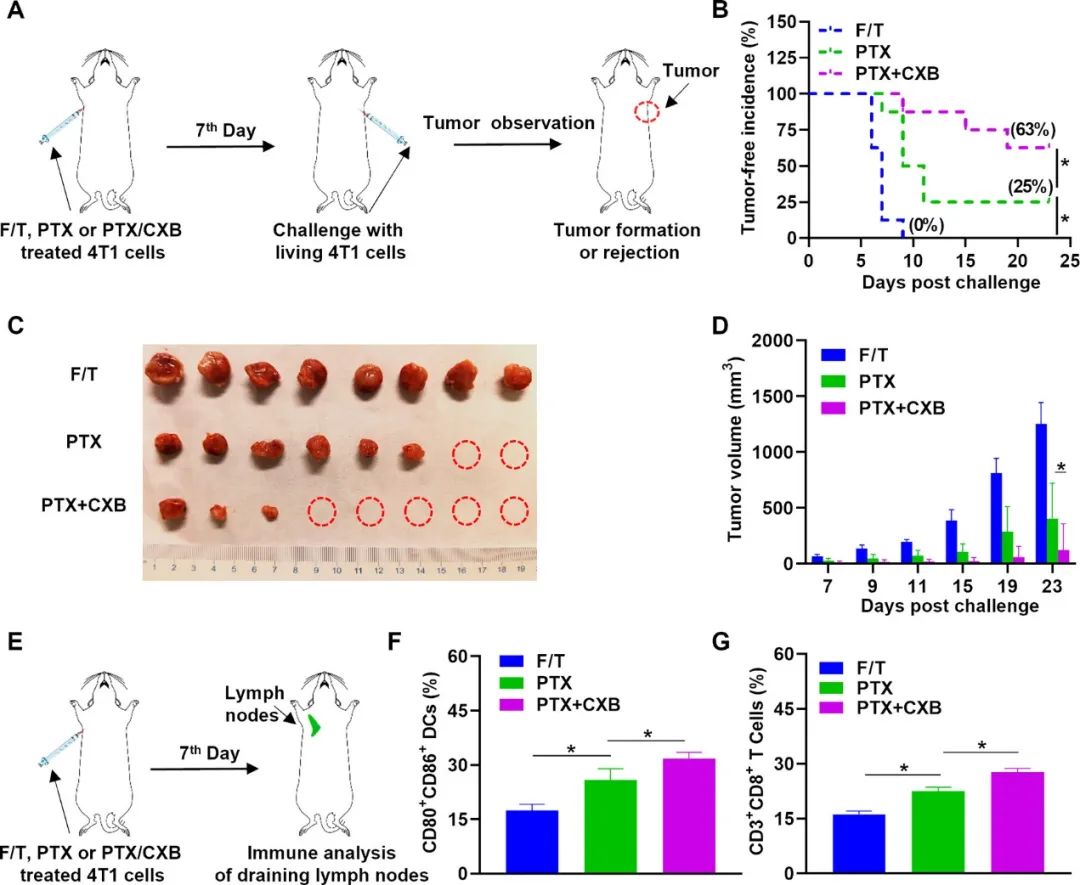
图1 CXB与PTX联合诱导增强的疫苗效果
为了优化这两种药物向肿瘤部位的递送,作者进一步开发了环精氨酸-甘氨酸-天冬氨酸基序(cRGD)修饰的脂质体,以包裹PTX和CXB(PTX/CXB@Lip-cRGD) (图2)。脂质体是公认的纳米递送系统,用于提高疏水性药物的生物利用度。cRGD肽则作为肿瘤靶向配体,与包括TNBC在内的各种癌症细胞中过表达的整合素受体结合。在TNBC的原位小鼠模型中,研究证明了PTX/CXB@Lip-cRGD显著提高了肿瘤靶向效率并增强了治疗效果。此外,这种治疗显示出抑制肿瘤再激发和肺转移的原位疫苗接种效果。该研究结果强调了一种潜在的ICD诱导药物组合,提供了一种有效的基于免疫的TNBC治疗策略。
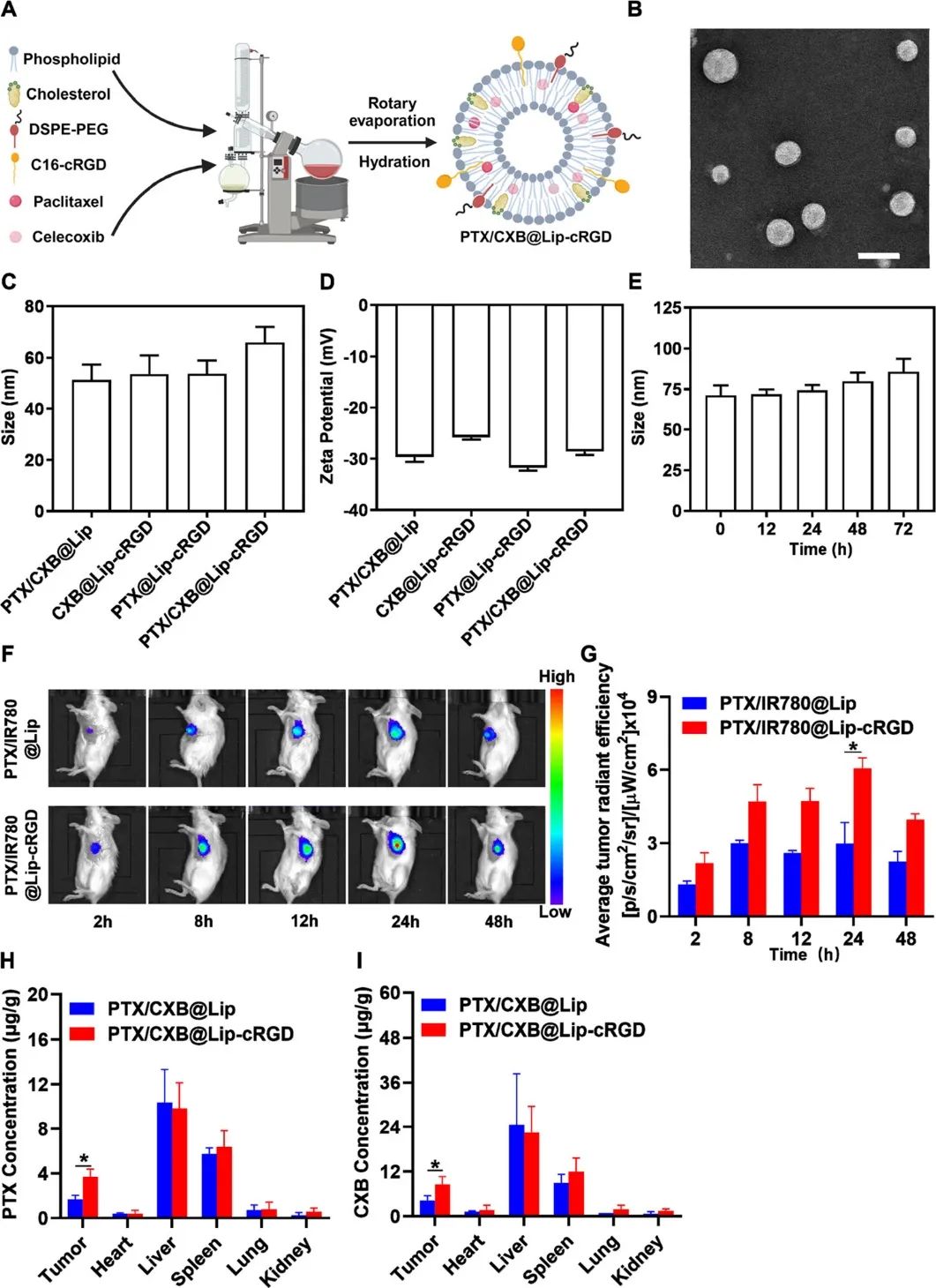
图2 PTX/CXB@Lip-cRGD
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c02947
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#三阴性乳腺癌# #免疫原性细胞死亡# #环氧合酶抑制剂#
17