Immunity:赵可吉/吴船合作发现远端沉默子CNS-28抑制IFN-γ表达以维持组织稳态
2023-04-18 iNature iNature 发表于上海
该研究在此提出了适当Ifng 表达的负向机制,抑制IFN-g过度反应以确保组织稳态。
干扰素-γ (IFN-γ)是哺乳动物应对病毒或细胞内细菌感染的关键细胞因子。虽然许多增强子被描述为促进IFN-γ反应,但据目前还没有研究发现Ifng 基因的沉默子。
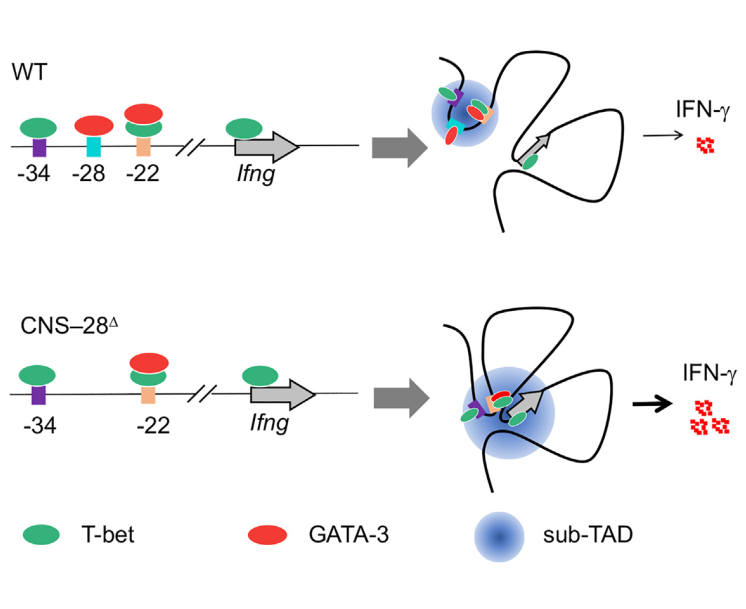
2023年4月10日,美国国立卫生研究院赵可吉和美国国家癌症研究所吴船共同通讯在Immunity在线发表了题为“Restraint of IFN-γ expression through a distal silencer CNS–28 for tissue homeostasis”的研究论文,该研究通过检测Ifng 位点内初始CD4+ T细胞中H3K4me1组蛋白修饰,发现了一种抑制Ifng 表达的沉默子(CNS-28)。在机制上,CNS-28通过减少Ifng 位点内的增强子-启动子相互作用来维持Ifng 沉默,这种相互作用依赖于GATA3,但不依赖于T-bet。
该研究结果还发现CNS-28在功能上抑制NK细胞、CD4+ 细胞和CD8+ T细胞在先天和适应性免疫反应中的Ifng 转录。此外,CNS-28缺乏导致IFN-γ表达升高,Th1和Th2模式改变,从而抑制2型反应。因此,该研究结果表明CNS-28活性通过与Ifng 基因位点内的其他调节顺式元件合作来确保免疫细胞的静止,以最大限度地减少自身免疫。

细胞因子是免疫稳态和宿主防御的关键调节因子。细胞因子基因的表达需要不同的调控元件精确控制。虽然转录因子(TF)与启动子和近端调控元件之间的相互作用对基因表达至关重要,但远端调控元件如增强子、沉默子和边界元件的功能现在因其在细胞类型特异性方式中控制基因激活和抑制的作用而受到重视。CD4+ T辅助性(Th)细胞是研究这些远端调控元件的理想细胞,因为它们易于分离、扩增和分化。
Th细胞亚型,包括Th1, Th2, Th9, Th17和Treg细胞在哺乳动物的适应性免疫中被广泛研究。初始CD4+ T细胞在遇到各种抗原和微环境时,容易分化成不同的Th细胞亚型。在这些细胞中,Th1细胞衍生的IFN-γ具有广泛的功能,包括宿主防御、自身免疫反应、肿瘤监测和神经元功能。IFN-γ表达的动态调控机制已被广泛研究。T-bet (T-box基因,TBX21)是调节1型免疫应答的关键因子,包括决定Th1细胞分化和Ifng 表达。T-bet直接与Ifng 启动子结合激活。
T-bet与保守非编码序列(CNSs)多个远端元件的相互作用也对Ifng 的表达起重要作用。通过Ifng 位点识别其他tf(如STAT4、Runx3和NFAT)与CNS的结合,促进了顺式调节元件的功能映射。所有这些上游和下游的中枢神经系统,包括CNS - 54、CNS - 34、CNS - 22、CNS - 6和CNS+18到CNS+20,都被证明是Ifng 转录的增强子。然而,目前还没有研究发现Ifng 表达的负调控元件。
T-bet和GATA3分别被称为Th1和Th2细胞的主TF。T-bet和GATA3在体外和体内均可在Th1细胞内共表达,提示Th1和Th2细胞在基因组调控和功能上具有潜在的可塑性。事实上,在Th1细胞分化过程中,GATA3可以结合在包含Th1基因的基因组区域,包括Ifng 位点。尽管已经在Th1细胞中定位了GATA3结合位点,但GATA3与远端元件在Th1细胞命运决定和Ifng 转录中的相互作用仍不清楚。
文章模式图(图源自Immunity )
表观基因组修饰编码细胞分化所需的染色质的信息。染色质修饰在T细胞发育、可塑性和记忆形成中起着关键作用。组蛋白H3赖氨酸4 (H3K4)甲基化被认为是评估活性和引物增强子的许可表观遗传标记。混合系白血病(MLL)组蛋白甲基转移酶家族,包括SETD1A, MLL1 (KMT2A), MLL2 (KMT2B), MLL3 (KMT2C)和MLL4 (KMT2D),催化H3K4的甲基化。MLL4通过直接结合或形成长距离染色质环催化H3K4的甲基化,在形成Treg细胞中的增强子景观中起着关键作用。然而,目前尚不清楚MLL4的这种作用是否也会影响其他T细胞亚群的分化和功能。
该研究发现MLL4的缺失导致了Th1细胞分化过程中Ifng 表达的大幅增加。通过Mll4基因缺失和H3K4me1结合谱分析,该研究鉴定出Ifng 位点的远端元件CNS-28。MLL4促进CNS-28的H3K4单甲基化,并促进包含CNS-22, CNS-28和CNS-34的微小染色质结构域的形成。此外,该研究结果证明CNS-28通过抑制Ifng 位点内CNS - 22启动子相互作用来抑制Ifng 表达。缺失CNS-28的小鼠表现出适应性和先天免疫细胞的全身IFN-g升高。因此,该研究在此提出了适当Ifng 表达的负向机制,抑制IFN-g过度反应以确保组织稳态。
原文链接:
https://www.cell.com/immunity/fulltext/S1074-7613(23)00126-7#%20
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言