郑利民教授分享肝癌组织PD-L1的表达、调控与临床意义
2020-06-29 转化医学网 转化医学网
<p><strong><img style="display: block; margin-left: auto; margin-right: auto;" src="https://img.medsci.cn/images/20200624/863cf8e683e44d2194013744c4ad56ac.jpg" /></strong></p> <p><strong>郑利民 教授</strong></p> <p>博士生导师</p> <p>中山大学教授,国务院学位委员会学科评议组成员</p> <p>荷兰Leiden大学博士,1999年被瑞典国家研究院聘为助理教授。2002年回国,先后获国家杰青和教育部***。曾任中山大学生命科学院院长和肿瘤医院生物治疗中心主任;现任中山大学教授,国务院学位委员会学科评议组成员。</p> <p>多年来一直从事人免疫细胞研究,

郑利民 教授
博士生导师
中山大学教授,国务院学位委员会学科评议组成员
荷兰Leiden大学博士,1999年被瑞典国家研究院聘为助理教授。2002年回国,先后获国家杰青和教育部***。曾任中山大学生命科学院院长和肿瘤医院生物治疗中心主任;现任中山大学教授,国务院学位委员会学科评议组成员。
多年来一直从事人免疫细胞研究,在国际期刊发表论文100余篇。回国后,以肝癌为主要模型,探讨人体肿瘤组织中免疫细胞与癌细胞之间的相互作用、调控机制及其临床意义。先后主持了国家科技重大专项(首席科学家)以及5项国家基金委重点项目。近年作为通讯作者的论文发表在PNAS、JCI、JEM和Hepatology等刊物。作为第一完成人获“国家自然科学二等奖”。2015年起,连续六年入选Elsevier 发布的“中国高被引学者(医学组)”榜单。
郑教授主要为大家分享他们实验室的工作,主要讲肝癌组织PD-L1的表达、调控与临床意义。
背景
肿瘤是地上的一个种子在合适的土壤中生长出的结果。以前做总结时,很多人主要关注癌细胞本身,实际上,肿瘤=癌细胞+适宜组织微环境。像中国人讲的南橘北枳一样,就是说橘子跟北枳这两个东西,其实是一模一样的,但因为在不同的气候和土壤环境下,就展现出了不同的这个表型。所以最近一项由Hanahan& Weinberg领导的一项研究中提到,如果要真正了解肿瘤生物学,就必须要结合微生物环境来开展研究。该研究发表在Cell上。
免疫细胞是微环境的重要组成部分。在正常组织中,每天基本都会有些细胞发生突变,或者恶变的细胞出来,这种情况下免疫细胞是起抗肿瘤的作用。在很多实体瘤中,通过临床数据的分析可以发现免疫细胞反而起着促肿瘤的作用。
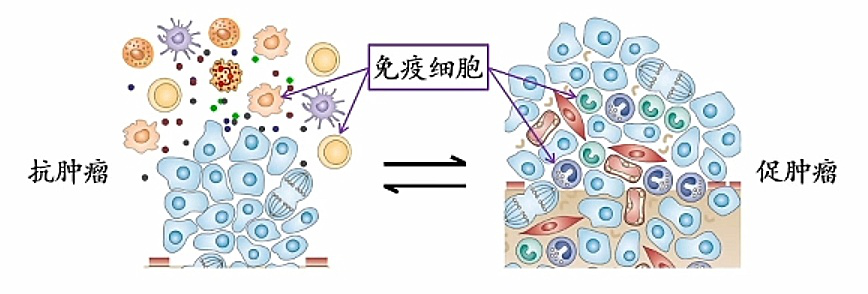
因为免疫细胞同时具有抗肿瘤和促肿瘤的双向作用,所以恢复或重建组织微环境的抗肿瘤功能,可以作为肿瘤治疗的新策略。
在肿瘤免疫这一块,以往大家都在想单纯提高抗肿瘤免疫,比如回收或激活免疫细胞,总体效果都不是非常理想。最近前几年,美国免疫学家詹姆斯·艾利森(James P Alison)和日本免疫学家本庶佑(Tasuku Honjo)因为在肿瘤免疫领域做出的贡献,荣获 2018 年诺贝尔生理学或医学奖。其实主要是提出一个概念:正常组织中本来是具有抗肿瘤的功能,那是否能恢复或重建它的抗肿瘤功能?他们提出的概念让治愈癌症成为现实。他们发现,在肿瘤中,促肿瘤作用里抑制免疫的有两个很重要的分子,即“刹车”分子PD-1和CDLA4。

詹姆斯·艾利森(James P Alison)(左)
本庶佑(Tasuku Honjo)(右)
Part one
在肿瘤治疗方面,现在已经有不少公司在做免疫检查点的药物了,用的最多的就是“明星”分子PD-1。实际上用了PD-1药物后,临床上确实已经起到了一个革命性的改变。但真正的效果是不是用了这个药物后,所有病人都能好的?实际并不是。
目前PD-1和PD-L1只对一小部分患者是有效的。比如,在肝癌病人里,17年有一个国际多中心的临床试验,发现晚期肝癌中,PD-1抗体单药大概可以获得20%的临床缓解率,延长患者总生存。
但真正完全缓解的,其实远远低于这个数字,于是就提出了一些问题:
为什么只有部分病人有效?-新的机制?新靶标?
哪些是适合病人?-判断模型?知道个体化治疗·能否提升疗效?-传统治疗方案(改良与联合)关于PD-1、PD-L1抗体治疗对于哪些病人有效果,目前临床上没有一个真正的特别有效的一个标记物。现在有多个临床实验的证据提示,如果肿瘤组织中,浸润免疫细胞,特别是髓系APC上,表达PD-L1的病人与PD-1/PD-L1治疗应答相关。
免疫细胞:在外周血和组织中呈现出不同的表型
很多人大概都在做外周血和淋巴结等,但实际上,真正发病的地方,或者说是免疫细胞“打仗”的地方,可以看到外周血跟组织中免疫细胞的表型是不一样的。这也提示一点,如果将来发展一些标记物,临床组织里出来的结果可能更加可靠,更能反映实际情况。
免疫微环境:认识初级阶段,对人肿瘤了解更少
另外,一般在动物实验或体外实验中,经常可以看到有一些药物或治疗方案对抗肿瘤能达到完全缓解。实际上在临床上面很少,为什么呢?主要是人的实体瘤跟动物实验里面差别非常大。除了免疫细胞,或者是除了细胞的种类不一样以外,另外有个很重要的一点,就是小鼠的肿瘤大部分都很快形成,而人的实体瘤,是免疫系统与癌细胞长期共进化的一个结果,都处在不同的区域。
免疫细胞在肝癌组织中的选择性分布特征
郑教授的实验室一开始做免疫细胞在肝组织中的分布,发现组织中的免疫细胞不是随机分布的。
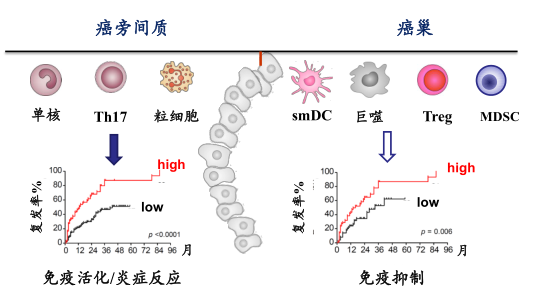
Mφ在肝癌组织不同区域的独特表型与功能
其实同样一个类型的细胞在不同的区域也是不一样的。

一个肝癌组织的连续的切片
郑教授等以前就在做了,发现Mφ多由外周血单核细胞迁移和分化而成。那么就提出疑问:肿瘤微环境如何调控Mφ表型?不同表型Mφ对预后影响如何?
得出结论:肝癌组织中,癌巢和间质中的Mφ数量均与预后成负相关
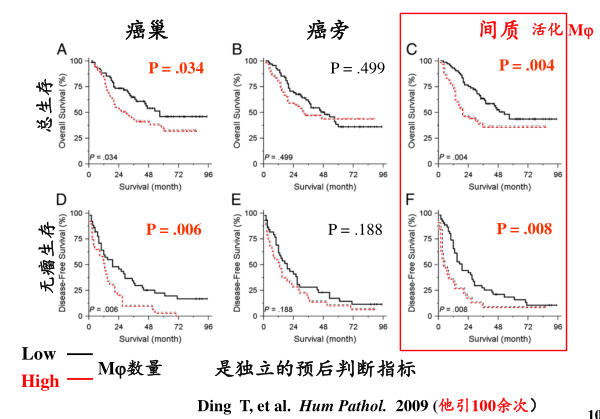
他们还发现:活化细胞数量越多,转移复发率就高。
这里就会有一个问题,活化的免疫细胞如何促进肿瘤进展?
在肝癌组织侵袭边缘的单核细胞高表达PD-L1(B7-H1)
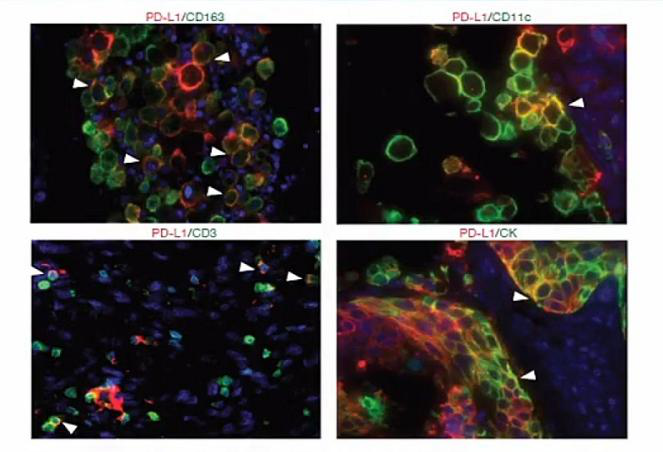
郑教授等大概在十几年前,就当时就做了PD-L1表达在组织中,现在他们发现在肝癌组织里的癌巢区域,PD-L1主要表达在单核细胞上。

现在一些年轻的临床医做实验的仪器的话都是很灵敏的,很弱的信号都能检测出来,但分子或者细胞在组织上的表达是有差异的,所以一开始可能是用一个比较低的电压来给做曝光,然后他另外有个片子就是检测比较弱的信号的。
如果报告时间很长,里外差别是看不出来的。这说明单核细胞在肝癌组织中是表达最主要的一类。
结论:
单核细胞:在肿瘤中 表达PD-L1 分子,外周血不表达,说明受到肿瘤微环境的调节。
PD-L1 的表达程度与患者肿瘤进展正相关。
PD-L1 主要分布在癌旁间质区域。
那么为什么只有癌旁间质的单核- 巨噬细胞高表达PD-L1 分子?据此,郑教授等做了一个奇怪的试验。结果发现:活化早期的单核细胞表达PD-L1;PD-L1受单核细胞自分泌因子的调控;IL-10起主导作用,TNF-α协同。
肿瘤组织中的T 细胞高表达 PD-1 (PD-L1 受体)介导了活化单核细胞的免疫抑制作用
那么大家可能就在想肿瘤组织中表达PD-L1的话,它里面的免疫应答有什么影响呢?郑教授发现,PD-L1介导了单核细胞的免疫抑制作用。
肿瘤活化的单核细胞表达 PD-L1 诱导免疫逃逸
在体内,如果阻断单核细胞上面的PD-L1的表达,就会恢复单核细胞抗肿瘤的活性。
活化单核细胞通过诱导Th17/Th22 分化促进血管生成
那么同时那为什么还有其他的机制?还有没有促进调控肿瘤的进展呢?他们发现,活化单核细胞还是可以通过调控Th17、Th22的分化来促进血管生成。
第一部分小结:
组织特定区域 炎症反应促进肝癌进展的新机制——将活化单核细胞“ 铸剑 ( 抗肿瘤免疫) 为犁 ( 血管生成) ”

Part two
肿瘤组织:单核/ 巨噬细胞表达 PD-L1 , 促肿瘤;可预测患者对anti-PD-1 mAb 治疗的应答
PD-L1+ 单核/ 巨噬细胞: 具有抗肿瘤潜能?
根据前面的结果,大家可能会想,在肿瘤组织中,单核、巨噬细胞表达PD-L1,可以促肿瘤,有助于疾病的进展。但实际上,最早提到单核、巨噬细胞表达PD-L1时,是可以预测病人对PD-L1抗体治疗的应答。意思就是,在肿瘤组织中,它表达PD-L1的分子时,尽管这个分子是不好的,但其实这些病人进行治疗后效果是比较好的。那为什么这个分子不好病人治疗还好呢?其实根据上面的结果,可以知道为什么免疫细胞会表达PD-L1,说明这个免疫细胞是一个活化的。意思就是,如果在肿瘤组织中,看到单核细胞、巨噬细胞表达PD-L1,这说明这个组织实际上具有抗肿瘤潜能。所以,如果阻断PD-L1,就有可能恢复其抗肿瘤性。
举个例子,PD-1和PD-L1都是“刹车”分子。如果说你去看两辆车,有一辆车刹车不好,还有一辆车子刹车非常强。那可以推测出来哪一辆车的发动机比较好,如果要修车,肯定是去修刹车比较强的那台。因为这个车要这么强的刹车就说明这个车的发动机是非常有利的。如果把它的刹车修好了,那它的启动就会非常快;如果车连刹车都没有,那可以推断出车可能修后发动机也不行。
于是,当时郑教授等与上海中山医院肝癌研究所等一起做了450余例的PD-L1在肝癌癌巢中的表达。他们发现,PD-L1样本病例中,大概有将近30%的病例是阳性的。在70%的病人里,巨噬细胞和肿瘤细胞都不表达PD-L1。他们还发现,同样一个免疫分子表达不同类型细胞上,它对于愈合状态是不同的影响。同时,他们也做了多重荧光染色,发现免疫细胞PD-L1的表达是在单核/巨噬细胞上面的。
大家自然就会想,单核/巨噬细胞的组织环境是什么样呢?
巨噬细胞上高表达 PD-L1 -- 活化的组织微环境巨噬细胞上高表达 PD-L1: 组织高表达多种肿瘤抗原
这给大家一个提示:
肿瘤治疗的新思路——联合治疗
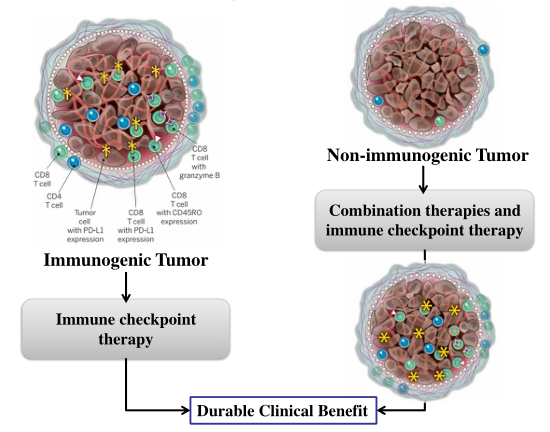
如果将来做肿瘤治疗,这可能提供一个新的思路。热肿瘤是具有免疫原性的,里面很多免疫活化的细胞,这些病人给他们用PD-1/PD-L1进行治疗,可能会有相对好的效果。但在临床上,这其实占很少,绝大部分病人实际上没有免疫原性。因为肿瘤经过人身体里跟免疫系统长期得共进化后,就没有了免疫原性。那怎么办呢?如果结合其他的治疗,比如在里面用溶瘤病毒,有射频的消融,或者用其他的一些治疗方案,也要用到局部产生炎症反应里面,就有可能营造一个相对活化的免疫环境,然后再进行治疗,就会有一个比较好的效果。
那么肿瘤细胞表达PD-L1是怎样调控的呢?如果在肿瘤组织中,主要高表达EZH2,它能负调控IFN-γ诱导的PD-L1表达在肝癌细胞上。在很多阳性病例中,很多不表达EZH2。

肝癌肿瘤细胞中EZH2 调控PD-L1 表达模式图
那么单核细胞为什么会高表达PD-L1?免疫细胞的活性是受到所处的环境的调控,于是郑教授等就去观察了正常组织中营养缺乏的环境里的糖酵解,发现肿瘤相关单核细胞的有氧糖酵解效应显着提高。如果在其中使用糖酵解抑制剂时,就会明显抑制PD-L1的表达。在其他的系统里,糖酵解并非通过PKM2-HIF1α调控TAM 表达PD-L1,糖酵解通过PFKFB3 调控TAM 表达PD-L1,PFKFB3 调控PD-L1 表达并与效应T 细胞功能显着相关。
总结:
肝癌组织中PD-L1 的表达:
1. 不同区域 - 独特的分布;不同细胞— 独特功能。
2. 免疫细胞:PD-L1 主要表达在活化 的单核/ 巨噬细胞上 ;伴随活化的肿瘤微环境;具有回复抗肿瘤免疫应答的潜能 ( 通过阻断PD-1/PD-L1)
3. 肿瘤细胞: 主要受IFNγ 诱导,EZH2 可通过调节PD-L1 和IRF-1 启动子的H3K27me3 水平来调控PD-L1 表达。
4. 思考:如何更好/ 合理的调控免疫应答— 新的治疗策略?
(包括联合 EZH2 抑制剂以及代谢调控分子等)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#PD-L1#
38
肝癌,接下来就要细分了,对于体质好的病人,能否将PD-1类+抗血管新生+放疗等相结合,甚至有必要用TACE进行减负
0
#肝癌#这里他区分的肿瘤的间质,肿瘤的癌巢位置,其实是肿瘤微环境中,也要区分肿瘤细胞和淋巴细胞巨噬细胞,他们表达一些分子标志物的临床意义是不一样的。
197