Mol Cancer:卡马替尼展现治疗MET融合驱动儿童高级别胶质瘤的潜力
2024-07-16 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
研究建立MET融合阳性pHGG小鼠模型,发现卡马替尼效力及药代特性优,与放疗结合可诱导肿瘤消退,为新疗法提供依据,解释卡博替尼失败原因。
儿童型弥漫性高级别胶质瘤 (pHGG) 是最具侵袭性的儿童肿瘤,致死率高,已有的疗法很少能治愈pHGG,5 年生存率仅为~20%。目前pHGG患者通常接受肿瘤切除,然后根据患儿年龄选择进行化疗和/或放疗。受体酪氨酸激酶 (RTK) 基因NTRK、ALK、ROS或MET的致癌融合经常会导致婴儿出现 pHGG亚组(IHG,婴儿型半球胶质瘤)。
最近一系列进展表明选择性抑制剂对NTRK或ALK融合pHGG患者有显著反应(尤其对IHG患者中尤其有效),但目前尚无针对MET融合阳性胶质瘤的有效选择性疗法。
近日,Marc Zuckermann 等研究团队在 Molecular Cancer 发表题为 Capmatinib is an effective treatment for MET-fusion driven pediatric high-grade glioma and synergizes with radiotherapy 的文章,使用两个独立且互补的MET融合阳性小鼠模型获得的临床前支持将卡马替尼(Capmatinib)和放疗(RT)结合起来作为针对MET激活的pHGG的新治疗方法,同时也指出了卡博替尼临床失败的原因。

作者分析了SJYC07临床试验(NCT00602667)或标准机构方案中登记的MET融合IHG患者的MRI扫描,发现MET融合导致的IHG肿瘤通常非常大、血管丰富且易出血,并且与术中出血、难以实现大体全切除和高发病率有关(图 1a-d)。CLIP2和MET之间的融合事件之前已在IHG和pHGG中观察到,这是首次发现NPM1和HIP1可作为MET的替代融合。
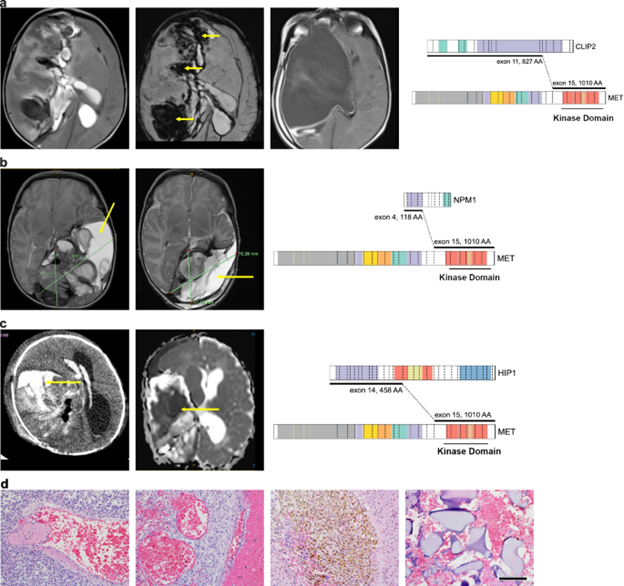
图一. MET 融合导致的 IHG 可导致大型血管肿瘤,手术切除非常困难。a 具有 CLIP2-MET 融合的 IHG 的 MRI 图像(右图)。左图:左:T2 加权图像显示一个包含整个右大脑半球的大型实体囊性肿瘤,中间:减法加权图像序列(SWI)。黄色箭头表示肿瘤内出血区域。右:T2 加权图像显示手术后大型肿瘤切除腔。b 具有 NPM1-MET 融合的 IHG 的 MRI 图像(右图)。左图:左:T2 加权 MRI 图像显示一个包含左半球整个颞叶的大型实体囊性肿瘤。右:首次尝试神经外科切除后的图像。由于手术期间大量出血和出血,只能切除一小部分肿瘤。黄色箭头显示肿瘤内的大囊肿。c 具有 HIP1-MET 融合的 IHG 图像(右图)。左图:左图:急诊室对一名 4 周大婴儿进行的紧急 CT 扫描,该婴儿表现为烦躁不安和前囟门膨出。显示巨大的右半球出血性肿瘤。黄色箭头指向大的出血灶。右图:MRI 的扩散受限图像 (DWI)。受限的水扩散(黄色箭头标记的暗/黑色区域)表示高细胞密度和增殖性肿瘤。d 人类 MET 融合肿瘤 (TRIM24::MET) 的组织学切片显示肿瘤细胞侵入大而异常的薄壁血管(两个上图),伴有壁内血栓(两个左图)和急性出血(左二)。在肿瘤中观察到大面积的含铁血黄素沉积,这是先前出血和血肿的证据(右二)。手术期间需要大量的明胶海绵来实现止血(最右边)。比例尺为 150µm
为了寻找新的治疗选项,作者建立并表征了两个携带不同MET融合基因的新的原位小鼠模型。这些模型包括一个免疫能力的小鼠同种移植模型和来自一个MET融合IHG患者的患者衍生原位异种移植模型(PDOX),该患者未对传统治疗和卡博替尼靶向治疗做出反应。利用这些模型,研究人员分析了三种MET抑制剂(卡帕替尼、克里唑替尼和卡博替尼)单独或与放疗联合治疗的功效和药代动力学特性。

图二. TFG-MET驱动的小鼠模型和MET抑制剂的药代动力学特征。a 示意图说明了在宫内电穿孔后诱导CRISPR/Cas9介导的Trp53缺失和TFG-MET过表达的方法和所用载体。b 通过宫内电穿孔产生的肿瘤的H&E染色和免疫组织化学分析,通过TFG-MET的HA标签可视化。与正常组织(右下角)相比,肿瘤显示出升高的pMET和pErk水平。大面板中的比例尺为100µm,高倍插图中的比例尺为25µm。c,H&E染色显示小鼠脑中有一个大而侵袭性的HGG。红色矩形表示b中显示的区域。d 人类MET驱动的pHGG的H&E染色显示出与鼠肿瘤相似的特征。大面板中的比例尺为100µm,高倍插图中的比例尺为25µm。e 生存曲线表明子宫内电穿孔诱导的肿瘤渗透性和潜伏期。f,对肿瘤中靶向 Trp53基因座的PCR产物进行 Sanger 测序,发现所有分析的序列中均有95bp缺失(n=6)。g,h 在 CD-1裸鼠施用相应化合物后,在指定时间点血浆(G)和脑(H)中卡马替尼和克唑替尼的浓度。每个化合物和时间点分析了三只小鼠。误差线表示标准偏差。虚线矩形表示以下临床前同种异体移植研究中的辐射时间窗口
卡马替尼在两个模型中显示出优越的脑药代动力学特性和更强的体外和体内效力,比卡博替尼或克里唑替尼都要好。

表一. 与克唑替尼相比,卡马替尼在小鼠中表现出良好的药代动力学特征:为了评估克唑替尼和卡马替尼的脑暴露情况,我们分析了它们在CD1裸鼠中的药代动力学特征。卡马替尼被迅速吸收并从大脑和血浆中清除,给药后16小时浓度低于检测限(图 2g、h 和补充表 1;附加文件 3),而克唑替尼缓慢平衡,在给药后4小时达到Cmax。然而,这两种药物在脑组织中均达到生理相关浓度>1µM。我们发现卡马替尼在大脑中达到的未结合药物(有效药效浓度)最大浓度比克唑替尼高9.6倍(~103nM vs ~11nM)。
PDOX模型复制了患者对卡博替尼疗效不佳的情况。相反,卡马替尼(Capmatinib)与放疗联合治疗延长了小鼠的生存时间,并在两种互补的小鼠模型中诱导了长期的无进展生存期。卡马替尼(Capmatinib)治疗增加了辐射诱导的DNA双链断裂并延迟了其修复。

图三. 卡马替尼(Capmatinib) 对TFG-MET驱动的肿瘤细胞有效。a 在不同时间点添加所示浓度的克唑替尼(cri)或卡马替尼capmatinib(cap)后,对培养的小鼠肿瘤细胞中的磷酸化和总MET以及下游效应物 Erk 进行蛋白质印迹分析。b 用卡马替尼capmatinib或克唑替尼crizotinib治疗后小鼠肿瘤细胞的剂量反应曲线。每个点代表三次重复中的一次重复。使用CellTiter-Glo测定法在化合物添加72小时后分析活细胞。垂直虚线表示EC50值。c 概述示意图,描绘了我们临床前同种异体移植研究中的各种治疗方法和两个不同队列。d 用所示疗法治疗的PD队列肿瘤中磷蛋白的免疫组织化学染色。卡马替尼capmatinib治疗后,pMET、pErk和pAkt水平显着降低。比例尺为50µm。e 用载体 (veh)、克唑替尼或卡马替尼单独或与辐射联合治疗的同种异体移植肿瘤的磷酸化和总MET、Akt和Erk的蛋白质印迹。f 图 C中蛋白质印迹的发光信号量化,标准化为相应的载体对照。每个点代表一个单独的重复。误差线显示平均值的标准误差。使用单因素方差分析和Tukey多重比较检验确定统计显着性(*p<0.05、**p<0.01、***p<0.001、****p<0.0001)
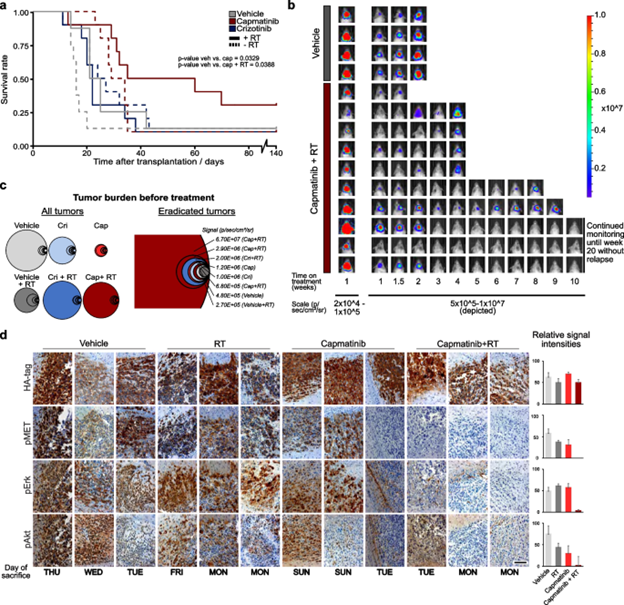
图四. 联合使用capmatinib和RT可提高体内存活率和存活时间。a“存活组”中小鼠的Kaplan–Meier曲线。所有治疗均在移植后1周开始。放射治疗持续6天,总共12Gy。化合物治疗持续84天。在额外49天的监测(移植后140天)后,试验结束,剩余小鼠均未出现任何残留肿瘤的迹象。接受 capmatinib + RT治疗的三只小鼠到达此时间点,而其他各组仅包含1只“幸存者”。分别为N = 8(载体组)或n = 10(化合物治疗组)。显示统计上显着存活差异的组的P值。b 来自载体组的四只代表性小鼠(根据初始荧光素酶强度排名居中)和capmatinib + RT组所有小鼠的生物发光成像图片。第一行以另一种强度尺度描绘,以可视化所有小鼠的肿瘤。所示比例尺表示范围从5x10^5-1x10^7光子/秒/cm2/sr。组合治疗在治疗的第21天左右使8/10只动物的肿瘤消退。c 根据治疗前所有入组小鼠的 BLI的肿瘤负担以圆圈面积表示(左图)。右图显示存活140天而无残留肿瘤的小鼠的初始肿瘤大小。虽然载体组的存活动物显示出最小的初始肿瘤,但所有大小的肿瘤都可以通过卡马替尼和放射疗法治愈。d 对存活队列中肿瘤的磷蛋白进行免疫组织化学分析,这些肿瘤用所示疗法治疗直至出现神经系统症状。在治疗期间(月至日)采集的接受卡马替尼治疗的小鼠中,磷酸化MET、pErk和pAkt水平显著降低,但在周末治疗暂停期间采集的组织中,磷酸化MET、pErk和pAkt水平再次升高。比例尺为100µm。
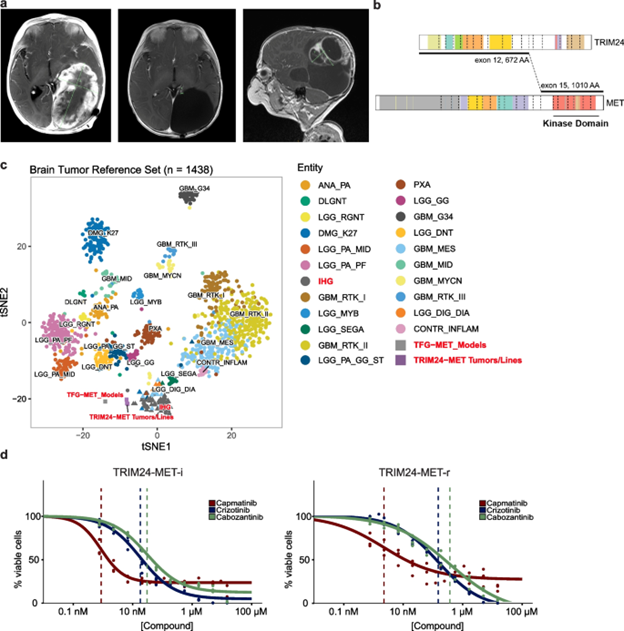
图五. 人类肿瘤样本对MET抑制的敏感性。a 一名患有TRIM24-MET融合的IHG患者的MRI图像。左图:诊断时的图像显示一个巨大的囊性实体肿瘤充满了左半球的整个颞叶。中图:切除和化疗结束时的图像。右图:复发时的MRI图像。b 融合包含TRIM24外显子1-12和c-MET外显子15,编码一种嵌合蛋白,该蛋白包含TRIM24的N端部分和c-MET激酶结构域。c,由一组参考胶质瘤亚型组成的组合甲基化数据集的tSNE投影(n=1128,圆圈来自 Capper 等人,Nature 2018,三角形来自 Clarke 等人,Cancer Discov 2020)。本研究中的TRIM24-MET和TFG-MET肿瘤样本和细胞系(方块,TRIM24-MET-i原代n = 4,细胞培养n = 1;TRIM24-MET-r原代n = 3,细胞培养n = 1;TFG-MET模型n = 6)与具有RTK融合基因的婴儿HGG(IHG)分组在一起。d 用卡马替尼、克唑替尼或卡博替尼治疗72小时后TRIM24-MET-i和TRIM24-MET-r细胞的剂量反应曲线。数据来自三个独立实验。垂直虚线表示EC50值。
为了确定PDOX模型能够多接近地重现卡博替尼的临床失败,研究人员直接比较了卡马替尼(Cabozatinib)与卡博替尼(Cabozatinib)治疗(图 6a)。卡博替尼(Cabozatinib)治疗使中位生存期延长了15.5天(卡博替尼与卡博替尼载体的p值 = 0.002)。尽管具有统计学意义,但肿瘤生长的这种轻微减少在临床上可能并不明显,因此与患者缺乏疗效相一致。与此形成鲜明对比的是,卡马替尼(Capmatinib)诱导了长期稳定的疾病,所有小鼠在19周的治疗期内都存活了下来(图 6b;卡马替尼与卡马替尼载体的 p 值 < 0.0005)。
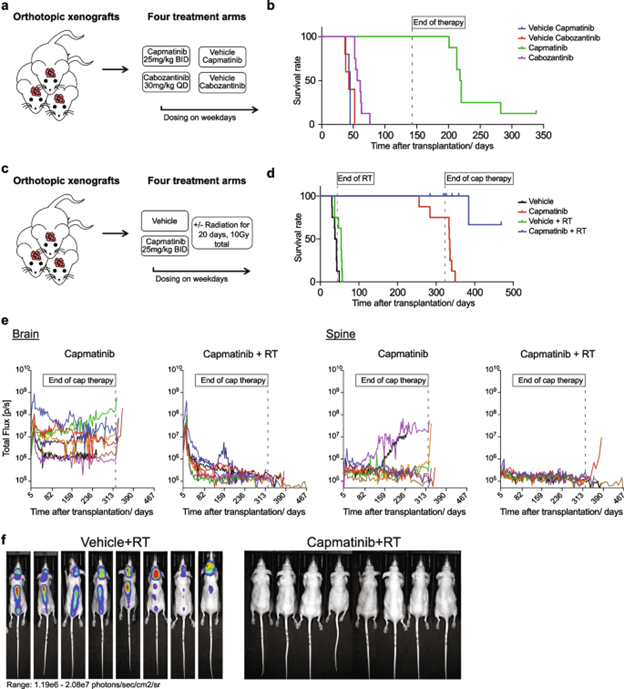
图六. 卡马替尼和放射治疗相结合可在体内消灭人类肿瘤细胞。a 概览示意图描述了临床前研究中的四个治疗组,比较了卡马替尼和卡博替尼的体内反应。b A 中所示研究中参加小鼠的Kaplan–Meier曲线。所有治疗均在移植后13天开始。化合物治疗持续133天。在随后6个月的监测中,卡马替尼治疗组8只小鼠中有7只出现肿瘤复发。c 概览示意图描述了临床前研究中的四个治疗组,比较了卡马替尼和放射治疗的联合治疗与单独治疗。d C中所示研究中参加小鼠的Kaplan–Meier曲线。所有治疗均在移植后18天开始。放射治疗以每天0.5Gy的剂量进行,总共10Gy。化合物治疗持续301天。经过额外的147天监测后,试验结束时所有小鼠都已达到肿瘤诱发或自然终点。e 参加C中所示的4组临床前试验的接受卡马替尼治疗的小鼠的颅骨和脊髓区域的总通量趋势(光子/秒/cm2/sr)。f 最接近人道终点时载体+ RT组小鼠的生物发光成像图片,以及当时接受卡马替尼+ RT治疗的小鼠的生物发光成像图片。颜色标度范围:1.19x10^6-2.08x10^7 光子/秒/cm2/sr。
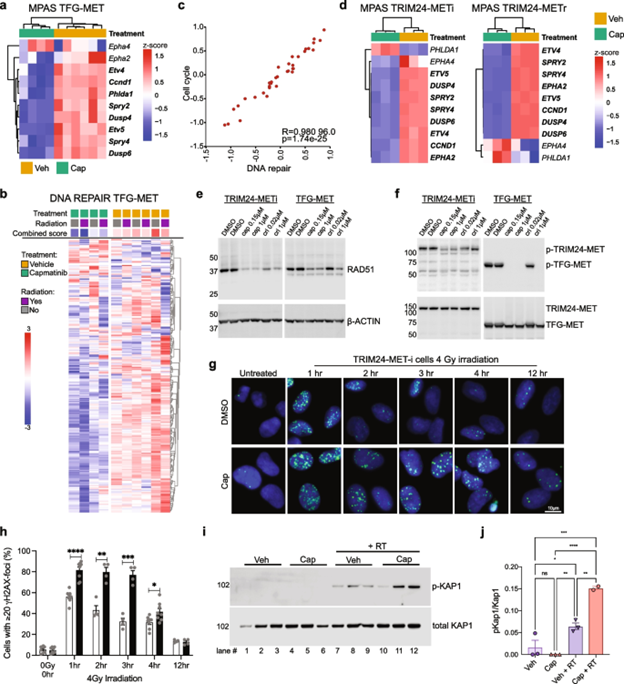
图七. 卡马替尼会使DNA修复基因的表达失调并增强辐射诱导的DNA损伤。a 用载体 (+/-RT) 或卡马替尼 (+/- RT,重点关注受卡马替尼治疗严重影响的4个肿瘤,2个异常值被排除在外) 治疗的 PD队列肿瘤中所示Mapk通路特征 (MPAS) 基因的表达。除了Epha4之外,在接受卡马替尼治疗的小鼠中,所有分析的Mapk通路特征基因的表达均受到抑制。显着下调 (调整 p < 0.05) 的基因以粗体表示。b “DNA REPAIR_7”基因组 (baderlab pathways 2019) 中基因的热图表明卡马替尼治疗导致 DNA修复基因表达降低。c 本研究中通过RNAseq分析的所有小鼠肿瘤(经治疗和未治疗)中基因集“DNA REPAIR_7”和“CELL CYCLE_7”(baderlab 通路 2019)的总表达分数之间的相关性。每个点代表一个肿瘤。d 热图显示与DMSO载体对照相比,在源自TRIM24-MET融合肿瘤的细胞系中,体外卡马替尼治疗的MAPK通路活性评分 (MPAS) 基因表达。显着下调(调整 p <0.05)的基因以粗体表示。e 在对TRIM24-MET或TFG-MET细胞进行24小时的指示治疗后,对RAD51和β-ACTIN进行蛋白质印迹分析。卡马替尼和克唑替尼均诱导RAD51下调。f 在用TRIM24-MET或TFG-MET细胞进行24小时的指示处理后,对MET和p-MET进行蛋白质印迹分析,作为蛋白质印迹分析的对照,例如在4 Gy辐射后的不同恢复时间点对TRIM24-MET L97人神经胶质瘤细胞系进行γH2AX免疫荧光染色。与DMSO处理的(DMSO)细胞相比,卡马替尼(Cap)处理的细胞显示出明显更高水平的γH2AX。h f中γH2AX-foci的量化。在辐射后1、2、3和4小时,与DMSO处理的细胞(白条)相比,卡马替尼处理的细胞(黑条)中具有≥20 γH2AX-foci的细胞百分比明显更高。误差线显示平均值的标准误差,使用t检验分析确定统计显着性。(****;p<0.0001, ***;p<0.001, **;p<0.01, *;p<0.05)。比例尺为10µm。i 用载体 (Veh) 或卡马替尼 (Cap) 单独或与辐射 (RT) 组合处理的 TFG-MET同种异体移植肿瘤的磷酸化和总Kap1的蛋白质印迹。样品7-9和11-12在RT后1 小时收集,泳道10在RT后3小时收集,并显示DNA双链断裂信号随时间下降。j 图 h 中蛋白质印迹的发光信号量化,标准化为载体对照。每个点代表一个单独的重复。误差线显示平均值的标准误差。使用单因素方差分析和Tukey多重比较检验确定统计学意义(*p<0.05、**p<0.01、***p<0.001、****p<0.0001)。由于RT后的时间点不同,因此排除了第 10 泳道的裂解物。
总之,这项研究生成了新型的MET融合驱动的pHGG小鼠模型,以确定这种疾病的最佳选择性抑制剂。与克唑替尼和卡博替尼相比,卡马替尼表现出更高的效力和优越的药代动力学特性,包括脑中未结合药物的比例更大。卡马替尼(Capmatinib)与低剂量辐射的结合增强了放射治疗引起的DNA 损伤,并在体内诱导了强烈的肿瘤消退,而卡博替尼治疗则重现了患者缺乏疗效的情况。使用两个独立且互补的小鼠模型获得的临床前数据结果一致,为将卡马替尼和放射治疗相结合作为针对MET激活的pHGG的新疗法提供了强有力的理由。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#卡马替尼# #儿童型弥漫性高级别胶质瘤# #MET融合#
44