Cell Rep:铁死亡与转移性结直肠癌的癌症转移机制存在关联
2023-09-17 浙江大学 MedSci原创 发表于广东省
铁死亡诱导已被探索成为一种有前途的抗癌疗法,特别是对于化疗耐药的肿瘤细胞。然而,铁死亡与癌症转移之间的串扰尚不清楚。
近日,浙江大学张红河、徐恩萍共同通讯在Cell Reports上发表题为“AMER1 deficiency promotes the distant metastasis of colorectal cancer by inhibiting SLC7A11- and FTL-mediated ferroptosis”的研究论文,阐明了AMER1介导铁死亡和癌症转移之间的串扰机制,为治疗AMER1突变的转移性结直肠癌患者提供了策略。

https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01121-X#%20
作为一种调节性细胞死亡,铁死亡是由脂质过氧化物的积累引发的,与铁稳态、脂质代谢、氨基酸代谢密切相关。铁死亡最重要的固有生理功能之一是肿瘤抑制。铁死亡显著增强某些肿瘤抑制基因的肿瘤抑制作用。例如,肿瘤蛋白p53(TP53)通过显著抑制氨基酸转运蛋白溶质载体家族膜11(SLC7A11)的转录来促进铁死亡,从而进一步增强TP53的肿瘤抑制作用。此外,BRCA1相关蛋白1(BAP1)以与TP53相同的方式触发铁死亡;因此,抗肿瘤活性甚至比非铁死亡相关的肿瘤抑制因子更明显。
肿瘤转移可通过直接侵袭和播散在局部淋巴结或远处器官发展。通过谱系追踪,已经表明淋巴转移比远处转移更容易发生,可能是因为淋巴液中高水平的油酸使肿瘤细胞,尤其是黑色素瘤细胞,对脂质过氧化和铁死亡具有更强的抵抗力,从而促进它们在血液中的存活。结直肠癌(CRC)是最致命的恶性肿瘤之一,在大多数情况下,转移仍然是患者死亡的主要原因。虽然一些药物,例如和厚朴酚(honokiol)和D13,是靶向铁死亡的关键因素,可以有效抑制结直肠癌的发展,但铁死亡是否参与CRC转移仍不清楚。目前,尚无有效的标志物可用于评估潜在的铁死亡诱导治疗。
为了进一步验证AMER1在调节体内铁死亡中的作用,我们首先研究了人类癌细胞中的AMER1失活是否可以减弱咪唑酮erastin(IKE)诱导的肿瘤生长抑制,IKE是erastin的代谢稳定类似物。如图2A所示,IKE显著抑制了模拟组中异种移植肿瘤的生长,而AMER1缺失在很大程度上消除了抑制作用(图2A)。由于铁死亡的特征是脂质过氧化,我们进一步进行了4-羟基-2-壬烯(4-HNE)免疫组织化学分析以测量脂质过氧化水平,发现IKE显著增加模拟组皮下肿瘤中的4-HNE水平,但在AMER1 KO组中没有(图2B)。值得注意的是,AMER1 KO组的皮下异种移植肿瘤体积略小,颜色较暗。然而,H&E染色显示,AMER KO组中的肿瘤细胞排列更紧凑,分化较差,并且表现得比模拟组的肿瘤细胞更具侵入性,这表明AMER1是一种肿瘤抑制因子,与以前的研究一致。
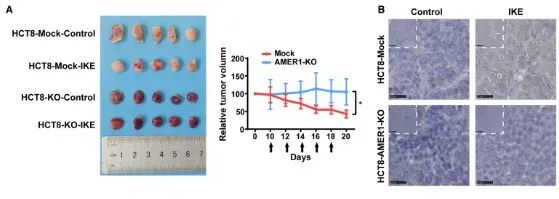
AMER1促进体内CRC细胞中的铁死亡
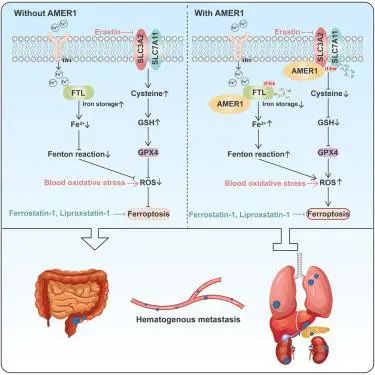
总之,我们不仅阐明了AMER1通过调节泛素化介导的SLC7A11和FTL降解来促进铁死亡的调节机制,而且还提出了铁死亡与癌症转移之间的串扰机制,其中AMER1缺乏诱导对铁死亡的抵抗并促进肿瘤细胞血源性转移,而野生型AMER1的肿瘤细胞更喜欢淋巴转移,因为它们对血液中的铁死亡敏感。因此,对于野生型或突变型AMER1的结直肠癌患者,需要采取不同的干预策略。此外,我们的研究结果还提供了通过诱导铁死亡再敏来治疗AMER1突变转移性CRC患者的机会。
参考资料:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01121-X#%20
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言