JMC:基于自噬-溶酶体机制的蛋白新型降解剂的研究及临床应用前景
2023-07-09 ComputArt ComputArt计算有乐趣 发表于上海
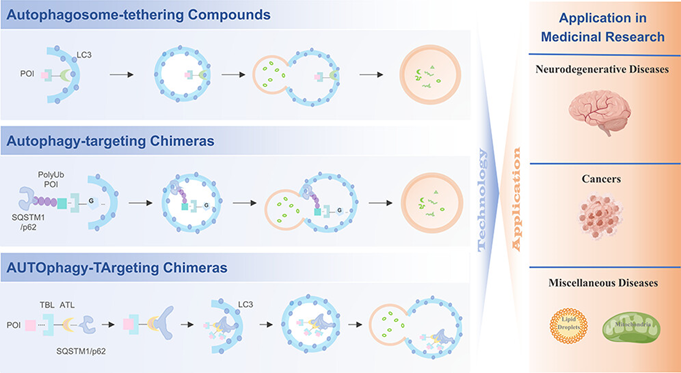
作者首先对基于自噬-溶酶体机制的三种靶蛋白降解技术(ATTEC、AUTAC和AUTOTAC)的原理进行了研究和总结。
自2019年3月首款PROTAC分子进入临床开发以来,仅短短3年多的时间,靶向蛋白降解(Targeted Protein Degradation,TPD)领域取得了飞速发展,因其能够克服许多传统小分子药物的局限性而备受研究者青睐。一方面,全球有多个PROTAC和分子胶项目进入临床阶段,其中部分领先项目已经多次公开披露了临床研究数据。另一方面,新技术层出不穷,如LYTAC、ATTEC、ATAC、AUTOTA等(图1)。
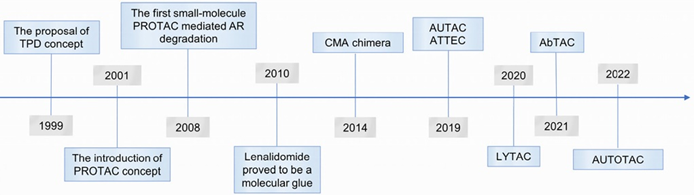
图1 靶蛋白降解技术(TPD)发展时间线
自噬是细胞内废物处理和回收的重要机制,近年来涌现出几种基于自噬-溶酶体机制的自噬降解剂,如自噬体绑定化合物(ATTEC)、自噬靶向嵌合体(AUTAC)、自噬靶向嵌合体(AUTOTAC)等。这些新型降解剂已被证明在治疗人类疾病(如神经退行性疾病和癌症)方面具有潜力。成都中医药大学药学院彭成教授课题组对目前出现的上述新型自噬降解剂的研究及其在临床应用前景方面进行了总结,近期在美国化学会出版社的药物化学核心期刊Journal of Medicinal Chemistry上发表了题为《Application of Novel Degraders Employing Autophagy for Expediting Medicinal Research》的综述文章(DOI:10.1021/acs.jmedchem.2c01712)1。
作者首先对基于自噬-溶酶体机制的三种靶蛋白降解技术(ATTEC、AUTAC和AUTOTAC)的原理进行了研究和总结。自噬体绑定化合物(ATTEC)能够直接与自噬受体微管相关蛋白1A/1B轻链3(LC3)结合,来引发细胞内蛋白和非蛋白物质的降解(图2a)。自噬靶向嵌合体(AUTAC)能够诱导K63连接的多泛素化来进行选择性蛋白降解(图2b)。另一种自噬靶向嵌合体(AUTOTAC)通过锚定在SOSTM1/p62复合物上来进行自噬降解(图2c)。以上三种基于自噬-溶酶体机制的蛋白降解剂通过不同的机理能够去除异常蛋白、蛋白聚集体以及功能失调的细胞器,进而能够治疗某些临床疾病。这些新技术对临床疾病的治疗提供了新的治疗思路。
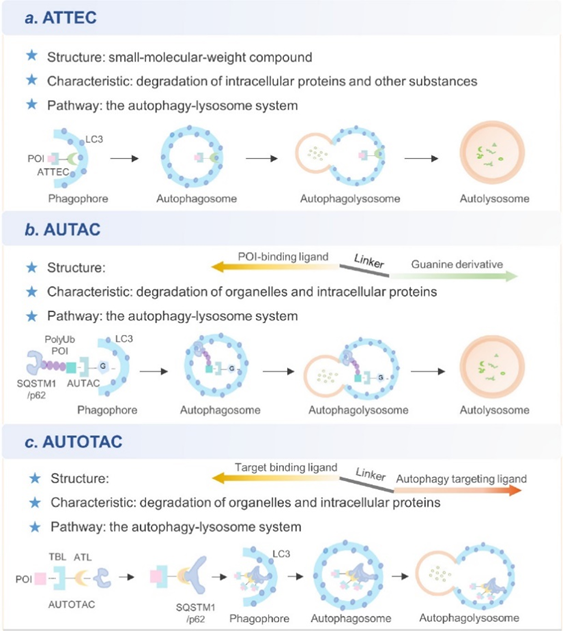
图2三种新型自噬降解剂的应用原理
作者进一步对上述三种蛋白降解剂的药学研究现状与临床应用前景进行了调研,并从疾病治疗的角度来讨论新型自噬降解剂的优势。目前新型自噬降解剂应用研究较多的疾病领域为神经退行性疾病,如亨廷顿舞蹈病、帕金森病和阿尔茨海默病。这类疾病的成因主要是细胞内蛋白的快速异常聚集,进而影响了神经信号的传递。亨廷顿舞蹈病(HD)是被研究最为广泛的一种神经退行性疾病,其主要由亨廷顿基因外显子1中CAG三核苷酸重复扩增引起,表现为非自愿舞蹈状运动、认知障碍和精神异常。选择性清除突变型亨廷顿蛋白(mHTT)是治疗HD的主要策略。东京大学的Ishikawa教授小组设计了含有泛素连接酶配体的PROTAC,其配体与蛋白聚集体的探针连接,成功地减少了成神经纤维细胞中的HTT水平2。但是这种建立在PROTACs技术上的蛋白降解剂会引起mHTT的非特异性降解,并且其降解机制尚不清楚。从另一方面来看,mHTT蛋白可以通过神经细胞内的自噬过程来进行降解,这给如何减少mHTT水平提供了一种新的思路。复旦大学附属华山医院的鲁伯勋教授课题组就利用ATTECs技术成功对mHTT蛋白进行了选择性降解。突变型亨廷顿蛋白(mHTT)和野生型亨廷顿蛋白(wtHTT)最主要的区别在于mHTT含有一个扩展的聚谷氨酰胺(polyQ)区域,为选择性降解提供了一个靶位点。针对这个位点,鲁伯勋课题组发展了四个小分子化合物(GW5074, AN1, AN2, 和ispinesib),这些化合物相较于PROTACs表现出对mHTT蛋白的更好的选择性和更高的降解效能(图3左下)。
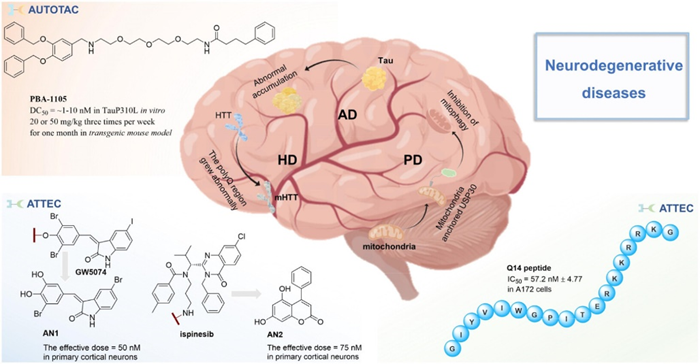
图3 应用自噬降解剂治疗神经退行性疾病
除亨廷顿舞蹈病外,帕金森病(PD)和阿尔茨海默病(AD)也具有应用自噬降解剂治疗的前景。研究表明,利用自噬过程加速受损线粒体的代谢可能是治疗帕金森病的一种方法。深圳大学的Shuiming,Li等人开发了一种名为Q14的新型多肽,它能够轻松地穿过细胞膜,并与线粒体膜上的USP30结合,抑制线粒体蛋白的去泛素化和降解,从而促进了线粒体的自噬过程(图3右下)。对于阿尔茨海默病,最直接的策略是通过自噬途径降解Aβ和Tau蛋白聚集体。首尔大学的Yong Tae Kwon等人利用建立的AUTOTAC平台发展了对突变Tau样蛋白更高效能及选择性的降解剂(图左上)。AUTOTAC降解剂一端结合自噬靶向配体(ATL),另一端结合靶结合配体(TBL),因此它可以与POI、 SQSTM1/p62结合,形成LC3识别的复合物,从而通过自噬途径降解Tau样蛋白3。
除神经退行性疾病外,ATTEC、AUTAC和AUTOTAC这三种新型自噬降解技术也被应用于癌症治疗、脂滴降解、功能失调线粒体清除等。尽管其中有些技术尚处于早期阶段(例如ATTECs)且缺乏系统的筛选方法,这给药物设计带来了困难。AUTACs和AUTOTACs的对蛋白的降解率相对较低,也限制了它们的医学应用。总的来说,在靶蛋白降解技术飞速发展的今天,相比PROTACs,这三种新型自噬降解剂具有更广泛的靶标谱和更高的效能,为研究靶蛋白降解治疗疾病提供了全新的思路与方法。
参考文献:
(1) Li, X.; Liu, Q.; Xie, X.; Peng, C.; Pang, Q.; Liu, B.; Han, B. Application of Novel Degraders Employing Autophagy for Expediting Medicinal Research. J Med Chem 2023, Article; Early Access. DOI: 10.1021/acs.jmedchem.2c01712.
(2) Tomoshige, S.; Nomura, S.; Ohgane, K.; Hashimoto, Y.; Ishikawa, M. Degradation of huntingtin mediated by a hybrid molecule composed of IAP antagonist linked to phenyldiazenyl benzothiazole derivative. Bioorganic & Medicinal Chemistry Letters 2018,28 (4), 707-710, Article. DOI: 10.1016/j.bmcl.2018.01.012.
(3) Ji, C. H.; Kim, H. Y.; Lee, M. J.; Heo, A. J.; Park, D. Y.; Lim, S.; Shin, S.; Ganipisetti, S.; Yang, W. S.; Jung, C. A.; et al. The AUTOTAC chemical biology platform for targeted protein degradation via the autophagy-lysosome system (vol 13, 904, 2022). Nature Communications 2022, 13 (1), Correction. DOI: 10.1038/s41467-022-29845-w.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







