百济神州PARP抑制剂获批,市场格局竞争加剧
2021-05-07 JACKZHAO MedSci原创
5月7日,百济神州官网发布公告消息称,中国国家药品监督管理局批准PARP抑制剂百汇泽®(帕米帕利)用于治疗既往接受过治疗的晚期卵巢癌患者。
5月7日,百济神州官网发布公告消息称,中国国家药品监督管理局批准PARP抑制剂百汇泽®(帕米帕利)用于治疗既往接受过治疗的晚期卵巢癌患者。
公告新闻稿称,其PARP抑制剂“百汇泽”已获得中国国家药品监督管理局附条件批准,公司正在筹备商业化相关工作,预计将在本月内完成商业发布。据公告,“百汇泽”用于治疗既往接受过至少两线化疗、伴有胚系BRCA (gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。
百汇泽®(帕米帕利)是一款 PARP1和PARP2抑制剂,临床前模型显示其具有穿透血脑屏障和 PARPDNA 复合物捕捉等药理学特性。由百济神州的科学家在北京研发中心自主研发,帕米帕利目前正作为单一 疗法或与其他药物联用治疗多种恶性实体瘤进行全球临床开发。迄今为止,已有 1200 多例患者入组帕米帕利临床试验。2021 年 5 月,中国国家药品监督管理局(NMPA)附条件批准百汇泽®用于治疗既往接受过至少两线化疗、携有胚系 BRCA (gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。针对该适应症的完全批准将取决于正在开展中的确证性临床试验结果。
百济神州总裁吴晓滨称,这是公司第三款获得上市许可的自主研发创新药物,这是公司发展进程中的一项重要里程碑事件。目前百济神州广泛的商业化产品组合现包含7款药物,在恶性血液瘤和实体瘤中覆盖15 项适应症。
百济神州肿瘤免疫学首席医学官贲勇医学博士表示:“百汇泽®是中国首款获批用于治疗涵盖铂敏感以及铂耐药的复发性卵巢癌患者的 PARP 抑制剂,我们为此十分激动。百汇泽®的设计独特,旨在降低耐药性且提供持续抗肿瘤缓解,正如去年我们在欧洲肿瘤内科学会(ESMO)年会上公布的数据显示,这款高选择 性 PARP 抑制剂在患者中产生了颇高的客观缓解率,且总体耐受性良好。我们十分感激参与临床试验的患 者和研究者,并期待百汇泽®成为中国复发性卵巢癌患者的一款重要治疗选择。此外,我们正在其他多项试 验和适应症中评估百汇泽®,包括正在开展的百汇泽®作为维持疗法用于治疗铂敏感复发性卵巢癌患者的 3 期临床试验。”
复旦大学附属肿瘤医院肿瘤妇科主任吴小华博士兼该试验主要研究者称:“疾病复发在晚期卵巢癌患者中 十分常见,由于化疗疗效有限且毒副作用大,PARP 抑制剂在后线治疗中已成为一项常用疗法。这项关键 2 期临床试验数据令人欣喜,展现了帕米帕利能为铂敏感或铂耐药患者带来具有临床意义且持久的缓解。 我们相信帕米帕利获批能为这些患者和家属带来新的治疗希望。” NMPA 附条件批准百汇泽®用于治疗晚期卵巢癌、输卵管癌或原发性腹膜癌患者是基于一项 1/2 期临床试验 (NCT03333915)的关键性 2 期部分临床结果。共有 113 例既往接受过至少两项标准化疗、伴有 gBRCA 突变的高级别上皮性卵巢癌(包括输卵管癌或原发性腹膜癌)患者在中国入组该项试验的关键性 2 期部分,包括 90 例晚期铂敏感卵巢癌(PSOC)患者和 23 例晚期铂耐药卵巢癌(PROC)患者。 百汇泽®有效性数据是基于 101 例疗效可评估患者经独立审查委员会(IRC)根据 RECIST v1.1 进行评估, 其中包括 82 例 PSOC 患者和 19 例 PROC 患者。PSOC 患者中的中位随访时间为 17.0 个月,客观缓解率 (ORR)为 68.3%(95%CI:57.1,78.1),中位缓解持续时间(DoR)为 13.8 个月(95% CI:10.97,20.73);PROC 患者中的中位随访时间为 11.6 个月,ORR 为 31.6%(95%CI:12.6,56.6),中位 DoR 为 11.1 个月(95%CI:4.21,16.59)。
百汇泽®总体安全性概况是基于在 3 项临床试验中接受百汇泽®单药治疗的 317 例患者所得。最常见的不良 反应(≥10%)为贫血、恶心、白细胞减少症、中性粒细胞减少症、呕吐、疲乏、血小板减少症、食欲减 退、腹泻、腹痛、天门冬氨酸氨基转氨酶(AST)升高、丙氨酸氨基转氨酶(ALT)升高、血胆红素升高 和淋巴细胞减少症。
55.8%的患者经历了 3 级及以上的不良反应,最常见(≥1%)为贫血、中性粒细胞减 少症、白细胞减少症、血小板减少症、淋巴细胞减少症、呕吐、疲乏、腹泻、恶心和 AST 升高。
21.5%的 患者经历了严重不良反应,最常见(≥1%)为贫血和白细胞减少症。 该项关键二期临床试验在中国报告的最常见不良反应(≥10%)为贫血、白细胞减少、恶心、中性粒细胞减 少症、呕吐、血小板减少症、食欲减退、疲乏、腹痛、ALT 升高、腹泻、AST 升高、淋巴细胞减少症、γ谷氨酰转移酶增加、上呼吸道感染、血胆红素增加、不适、体重下降和头晕。
71.7%的患者经历了三级及 以上不良反应,最常见(≥1%)为贫血、中性粒细胞减少症、白细胞减少症、血小板减少症、淋巴细胞减 少症、呕吐、腹泻、γ-谷氨酰转移酶升高、低血钾、腹痛、疲乏、上呼吸道感染、全血细胞减少症和高血 压。 百汇泽推荐剂量为每次 60 毫克、每日两次口服治疗。
卵巢癌是女性生殖系统第二常见的恶性肿瘤。统计结果表明,全球每年大约有225000例新发病例,其存活率约30%,在妇科恶性肿瘤中发病率位居第二,死亡率位居第一。
卵巢癌在女性常见癌症排名中位列第七名,2018 年有 295525 名新增病例。由于超过六成的卵巢癌患者在 确诊时已为晚期,加上约七成患者由于化疗耐药导致疾病复发,卵巢癌死亡率普遍偏高。在中国,卵巢 癌是死亡率最高的妇科癌症,每年约有 22500 起死亡病例。中国卵巢癌患者的五年生存率约为 40%。
流行病学资料显示,无胚系BRCA基因突变的 女性一生中患卵巢癌的几率为 1%~2%,而有 BRCA1 突变的女性一生的患病风险为 21%~ 51%,有 BRCA2 突变的女性一生的患病风险为 11%~17%。因此,有必要对高危人群进行BRCA 基因的检测。高危人群包括:近亲有人患乳腺癌、 卵巢癌或其他相关癌症;或绝经前患乳腺癌;或同 时患多个相关的肿瘤,如乳腺癌、卵巢癌;或家族 中有男性乳腺癌;或有德系犹太人血统等。
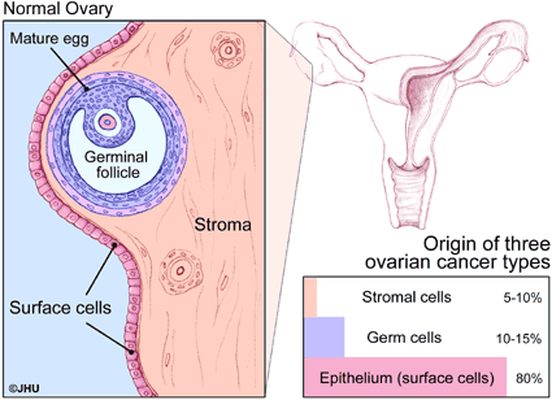
卵巢肿瘤可为良性或恶性;只有在肿瘤活组织检查或肿瘤发生转移之后,才能分辨肿瘤为良性还是恶性。 卵巢肿瘤分为三种类型: 上皮性肿瘤——大部分(接近85%)的卵巢肿瘤发生于卵巢上皮细胞。生殖细胞肿瘤-来源于卵巢内卵子产生的细胞。 这主要发生在儿童和青少年中,与上皮性卵巢肿瘤相比很少见。基质间质瘤-与上皮瘤相比很少见,这类肿瘤通常会产生类固醇激素。
卵巢癌通常使用 FIGO(国际妇产科联合会)系统进行分期。卵巢癌分为四期,即 I 期到 IV 期,表明癌症进展的程度从较轻(I 期)至较重(IV 期)。WHO病理分类如下:


卵巢恶性肿瘤诊断与治疗指南(第四版)
而发布此消息同一天,百济神州同步发布了第一季度业绩报,业绩报显示,2021年一季度,公司实现收入6.06亿美元,净收入为0.67亿美元。值得一提的是,这也是公司自2018年8月8日起在港股上市以来,首度在报表中实现盈利。去年同期,公司仍净收入亏损3.6亿美元。
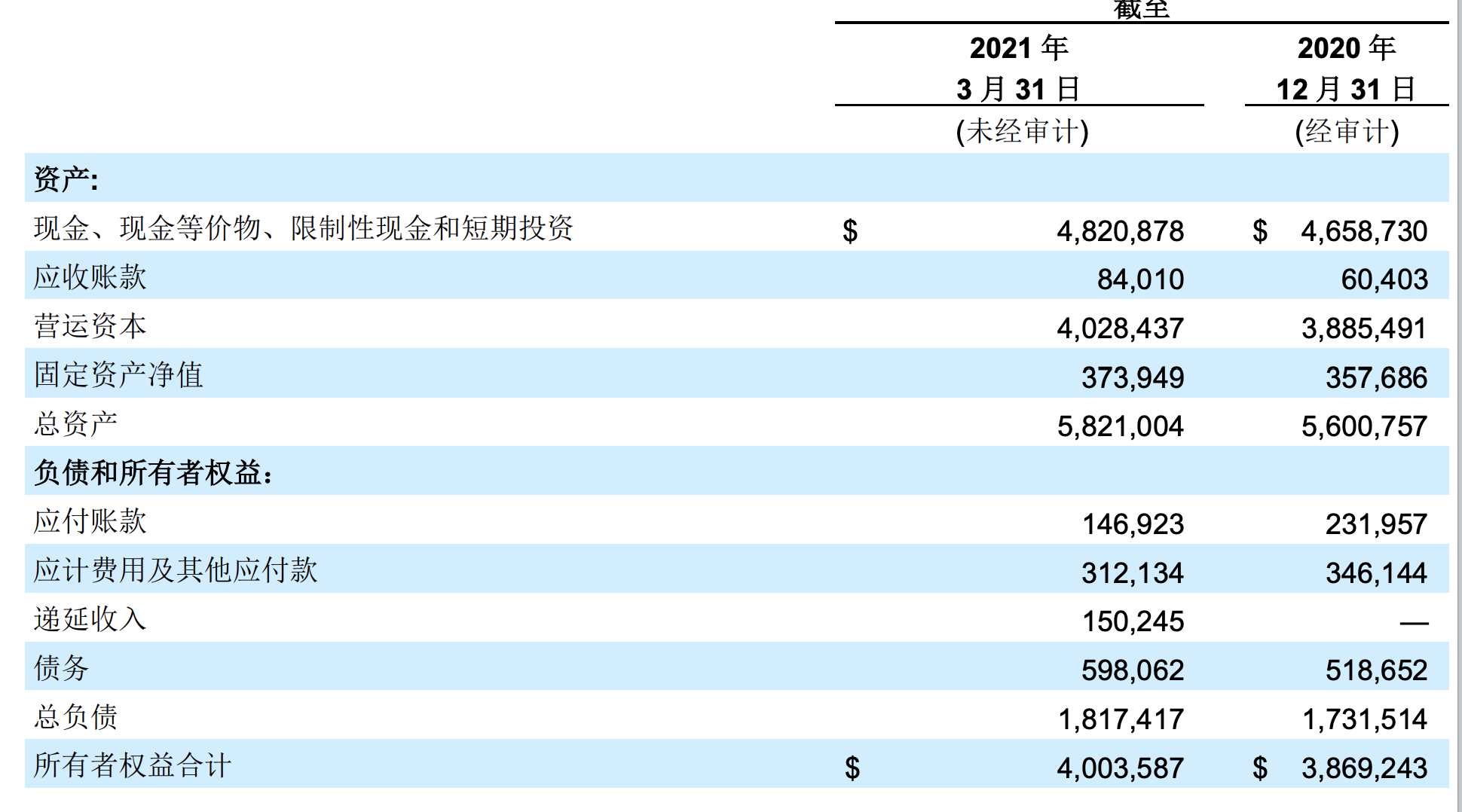
截至2021年3月 31日的三个月现金、现金等价物、受限资金和短期投资为48亿美元;相比较,截至2020年12月31日的持有额为47亿美元,实现了 1.621 亿美元的增长
业绩报中同时指出,帕米帕利预计里程碑事件:
- 于 2021 年上半年在中国获批用于治疗既往接受过至少两线化疗、伴有胚系 BRCA 突变的 复发晚期卵巢癌、输卵管癌或原发性腹膜癌患者
- 将于 2021 年或 2022 年上半年公布帕米帕利作为针对铂敏感复发性卵巢癌(OC)患者维 持治疗的 3 期临床试验(NCT03519230)主要结果
- 将在 ASCO 2021 年线上年会上公布临床数据,包括以下海报展示: – 帕米帕利在中国用于治疗胚系 BRCA 突变的局部晚期或转移性 HER2 阴性乳腺癌患者 的 2 期临床试验(NCT03575065) – 帕米帕利对比安慰剂作为对铂类一线化疗响应的无法手术的局部晚期或转移性胃癌患 者维持治疗的 2 期临床试验(NCT03427814)
公司业绩报中指出,预计新冠肺炎病毒(COVID-19)引起的世界卫生危机将继续对其业务造成一定的负面影响,包括商业销售、药政沟通、检查及申报、临床试验的患者、参与以及数据公布。该全球大流行对全球的影响仍存在不确定性。公司正在努力减少疫情导致的工作延迟和中 断,并继续按照在全球范围内制定的商业化、药政事物以及临床开发目标开展工作。
值得关注的是,首个国产PARP抑制剂为恒瑞医药氟唑帕利胶囊,并已在2020年12月获批上市,用于治疗 BRCA1/2 突变的复发卵巢癌(包括输卵管癌、原发性腹膜癌)的治疗。此外,氟唑帕利单药或联合阿帕替尼治疗卵巢癌、乳腺癌、胰腺癌已处于 III 期临床研究阶段。氟唑帕利另有多种联合治疗方案,包括与阿比特龙联合、与抗 PD-L1 抗体 SHR-1316 及替莫唑胺联合治疗多种实体肿瘤已处于临床开发阶段。
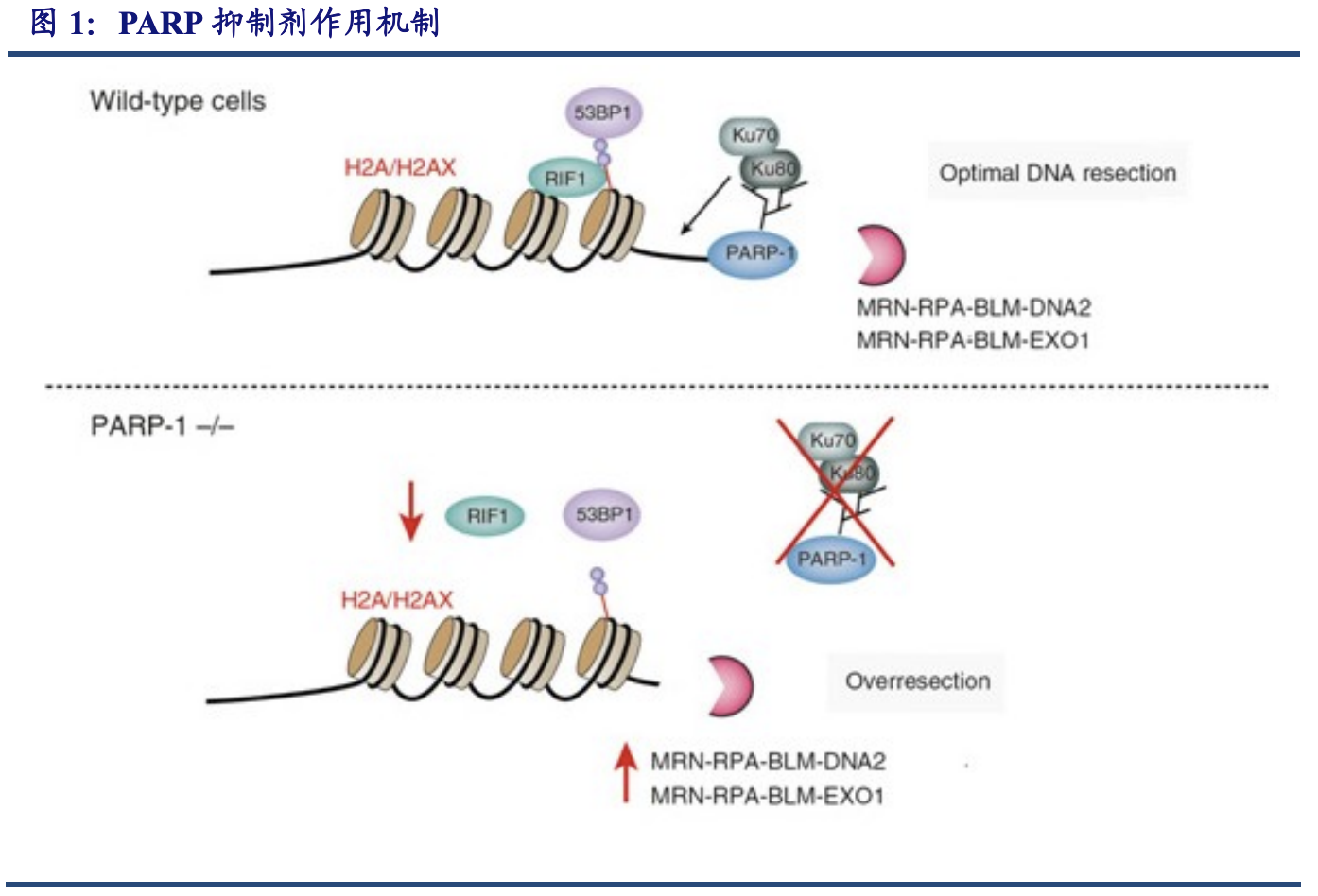
氟唑帕利是PARP抑制剂,可特异性杀伤BRCA突变的肿瘤细胞当BRCA未发生突变时,PARP抑制剂造成的DNA损伤,可以通过HRR完成修复。而当BRCA发生突变时,PARP抑制剂造成的 DNA 损伤便无法修复。因此PARP抑制剂作为一种分子靶向治疗药物,可以精准治疗 BRCA 基因突变的癌症患者。

今年2月,由中国医学科学院肿瘤医院吴令英教授担任主要研究者,全国26家研究机构共同参与的“氟唑帕利单药治疗BRCA1/2突变的复发性卵巢癌:一项单臂、多中心II期临床研究”于国际著名医学期刊《临床癌症研究》(Clin Cancer Res)在线全文发表。
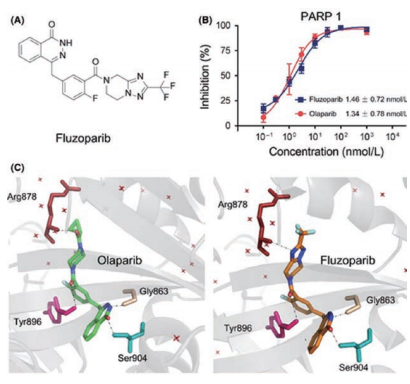
此次登上CCR杂志的研究共纳入113例美国东部肿瘤协作组(ECOG)评分0~1的伴有BRCA1/2 致病性及疑似致病性突变的复发性卵巢癌患者,既往均接受过2~4次含铂方案治疗。患者接受氟唑帕利150 mg bid连续给药,28天为一个给药周期,用药直至疾病进展、毒性无法耐受或撤知情。研究主要终点为IRC评估的ORR,次要研究终点包括缓解持续时间(DoR)、无进展生存期(PFS)等。结果显示,截至2020年3月21日,该研究由IRC评估的ORR高达69.9%,中位DoR长达10.2个月,中位PFS长达12.0个月,显示出氟唑帕利的优越疗效。
在安全性方面,3级及以上不良反应发生率为63.7%,其中3级及以上胃肠道不良反应发生率较低,且仅有1例(0.9%)患者因药物不良反应导致治疗终止,总体不良反应安全可控。
全球目前共有5款PARP抑制剂获批上市,奥拉帕利(Lynparza)、卢卡帕利(Rubraca)、尼拉帕利(Zejula)和他拉唑帕利(Talzenna)于美国获批上市销售,奥拉帕利片(利普卓)于 2018 年 8 月在中国获批上市。国内再鼎医药的甲苯磺酸尼拉帕利胶囊(名则乐)于2019 年12 月在中国获批上市,用于铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗。

国内市场目前已经上市的同类产品还有阿斯利康的奥拉帕利、以及GSK(葛兰素史克)/再鼎的尼拉帕利。全球市场方面,已经上市的PARP抑制剂则有阿斯利康的奥拉帕利、克洛维斯肿瘤(ClovisOncology)的鲁卡帕利、GSK的尼拉帕利以及辉瑞的他拉唑帕利。
2019 年奥拉帕利(Lynparza)、卢卡帕利(Rubraca)、尼拉帕利(Zejula)和他拉唑帕利(Talzenna)全球销售额约为 13.57 亿美元,美国销售额约为 6.74 亿美元。
参考资料:
https://ir.beigene.com/static-files/0283ea10-ce41-4c5e-8ddd-5bc55838b9d4
https://pdf.dfcfw.com/pdf/H3_AP202012201442160857_1.pdf?1608457750000.pdf
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#抑制剂#
36
好
62
#PARP#
57
认真学习了
59
竞争激烈了
76
自主创新创业要支持
62
学习学习
63