Nature子刊:许大千/吕志民/周钦合作揭示肿瘤细胞防御铁死亡新机制
2023-05-09 生物世界 生物世界 发表于上海
该研究发现并证实了能量代谢的核心酶肌酸激酶B能够发挥非经典/非代谢功能,还可以可发挥蛋白激酶功能,通过对谷胱甘肽过氧化物酶4的磷酸化,抑制肿瘤细胞铁死亡,从而促进肿瘤生长。
多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、程序性坏死(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
铁死亡(Ferroptosis)是2012年由哥伦比亚大学 Brent Stockwell 实验室发现的一种铁依赖性的新型细胞程序性死亡方式,由过度堆积的过氧化脂质(peroxidized lipids)诱导发生,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。同时,细胞中也有多个对抗铁死亡的防御途径(尤其是癌细胞),其中最主要的一个是由谷胱甘肽过氧化物酶4(GPX4)所介导的,通过谷胱甘肽(GSH)特异性催化过氧化脂质来抑制铁死亡的发生。
癌症代谢研究的最新进展表明,癌细胞通过调节代谢酶的典型功能,以产生增殖、侵袭和转移所需的基本组分、代谢物和能量。重要的是,癌细胞还赋予了代谢酶在调节许多工具性细胞活动中的非经典功能。
肌酸激酶(CK)、ATP合酶、磷酸甘油酸激酶和丙酮酸激酶作为代谢酶是直接负责ATP生成的关键酶。肌酸激酶(CK)负责催化磷酸基从ATP到肌酸的可逆转移,在调节细胞能量稳态中发挥关键作用,由两个亚基组成——肌酸激酶B(CKB)和肌酸激酶M(CKM),前者主要在大脑、平滑肌等组织中表达,后者主要在骨骼肌和心肌中表达。
磷酸甘油酸激酶和丙酮酸激酶具有非经典功能,有助于肿瘤生长。肌酸激酶B(CKB)在细胞能量稳态中的关键代谢功能已经被揭示,但其是否也具有促进肿瘤生长的非经典功能尚不清楚。
2023年5月8日,浙江大学转化医学院/浙江大学医学院附属第一医院/国家基础科学中心许大千/吕志民团队联合哈尔滨医科大学周钦团队,在 Nature Cell Biology 期刊发表了题为:Creatine kinase B suppresses ferroptosis by phosphorylating GPX4 through a moonlighting function 的研究论文。
该研究发现并证实了能量代谢的核心酶肌酸激酶B(CKB)能够发挥非经典/非代谢功能,还可以可发挥蛋白激酶功能,通过对谷胱甘肽过氧化物酶4(GPX4)的磷酸化,抑制肿瘤细胞铁死亡,从而促进肿瘤生长。

受体蛋白激酶的激活在各种癌症中普遍存在,对铁死亡的影响尚不清楚。在这项最新研究中,研究团队证明了胰岛素样生长因子1受体(IGF1R)信号激活的AKT使肌酸激酶B(CBK) 的T133磷酸化,降低CKB的代谢活性,增加CKB与谷胱甘肽过氧化物酶4(GPX4)的结合。重要的是,CKB作为蛋白激酶并磷酸化GPX4的S104。
GPX4的S104磷酸化阻止了HSC70与GPX4的结合,从而消除了由伴侣蛋白介导的自噬调节的GPX4降解,减轻了铁死亡,促进了小鼠肿瘤生长。
此外,研究团队还进一步发现,GPX4水平与人肝细胞癌标本中CKB T133和GPX4 S104磷酸化水平呈正相关,并与肝细胞癌患者预后不良相关。
总的来说,该研究证明了,胰岛素样生长因子1受体(IGF1R)在肝细胞癌(HCC)细胞中的激活可增加谷胱甘肽过氧化物酶4(GPX4)的表达,而GPX4的表达依赖于肌酸激酶B(CKB)的蛋白激酶的活性。CKB通过磷酸化GPX4,阻止其降解,抵消HCC细胞中的铁死亡,从而促进肿瘤生长。
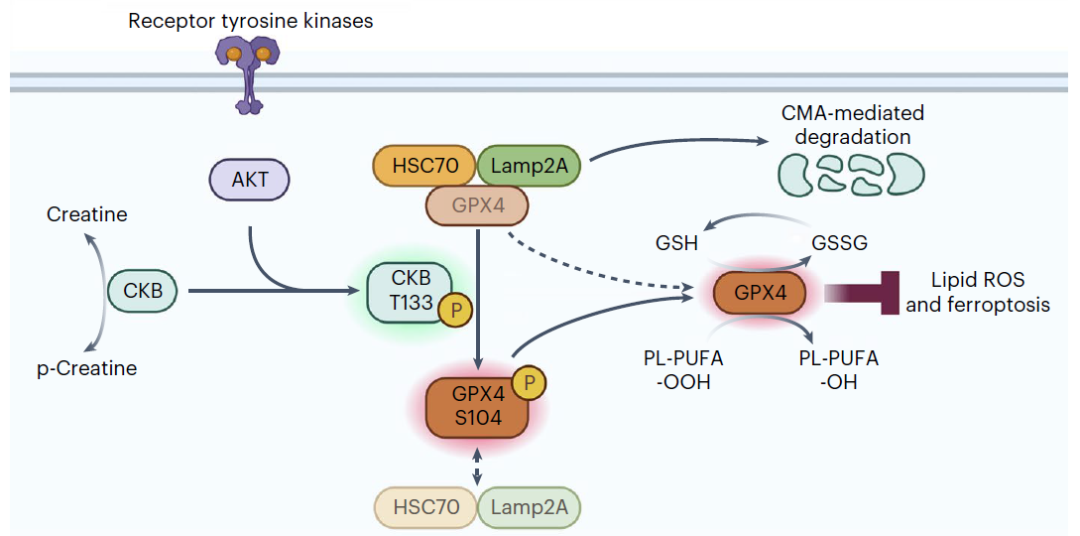
这些发现揭示了肿瘤细胞通过CKB增强GPX4稳定性的非经典/非代谢功能来对抗铁死亡的关键机制,并强调了针对CKB的蛋白激酶活性进行癌症治疗的潜力。
论文链接:
https://www.nature.com/articles/s41556-023-01133-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言