ASCO GU 2021:前列腺癌的免疫治疗取得曙光
2021-02-15 MedSci原创 MedSci原创
近年来,以PD-1/PD-L1单抗为代表的免疫检查点抑制剂先后在多个瘤种获得突破,包括黑色素瘤,淋巴瘤,NSCLC,肝癌,乳腺癌等。但是在晚期前列腺癌中,探索相对较晚。虽然,K药等获得“普
近年来,以PD-1/PD-L1单抗为代表的免疫检查点抑制剂先后在多个瘤种获得突破,包括黑色素瘤,淋巴瘤,NSCLC,肝癌,乳腺癌等。但是在晚期前列腺癌中,探索相对较晚。虽然,K药等获得“普适适应症”,即微卫星不稳定以及肿瘤高突变负荷的人群中,可以用K药治疗。但是,缺乏对前列腺癌整体人群的直接证据。既往开展的用于新型内分泌治疗以及化疗失败后单独免疫治疗的研究并未获得成功。因此,PD-1/PD-L1单抗治疗的前移以及与现有治疗的联合,成为目前晚期前列腺免疫治疗临床研究聚焦的重点,也是2021年ASCO GU大会中值得关注的亮点
免疫联合化疗在既往未化疗的mCRPC患者中的疗效显著
(1)纳武利尤单抗的CheckMate 9KD研究
CheckMate 9KD(NCT03338790)研究是一项纳武利尤单抗联合方案治疗mCRPC的2期临床研究。研究根据患者的既往治疗状态将患者分为A、B、C三个治疗组,分别接受纳武利尤单抗联合rucaparib、纳武利尤单抗联合多西他赛和强的松、纳武利尤单抗联合恩扎卢胺方案治疗。本次会议报道了CheckMate 9KD的B组治疗结果。
B组纳入的是既往未接受过化疗的转移性去势抵抗性前列腺癌(mCRPC)患者,但允许患者既往接受至多2种新型内分泌治疗(NAT:例如阿比特龙、恩扎卢胺等)。B组治疗方案具体为:纳武利尤单抗 360mg Q3w + 多西他赛 75mg/m 2 Q3w + 强的松 5mg Bid,其中化疗不超过10周期,序贯纳武利尤单抗 480mg Q4w维持治疗,直至疾病进展(PD)或不可耐受的副反应(最多治疗2年)。主要研究终点为:客观缓解率(ORR)和PSA缓解率(定义为治疗后最低PSA较基线PSA下降 ≥ 50%);次要研究终点为影像学无进展生存期(rPFS)、总生存期(OS)和安全性。
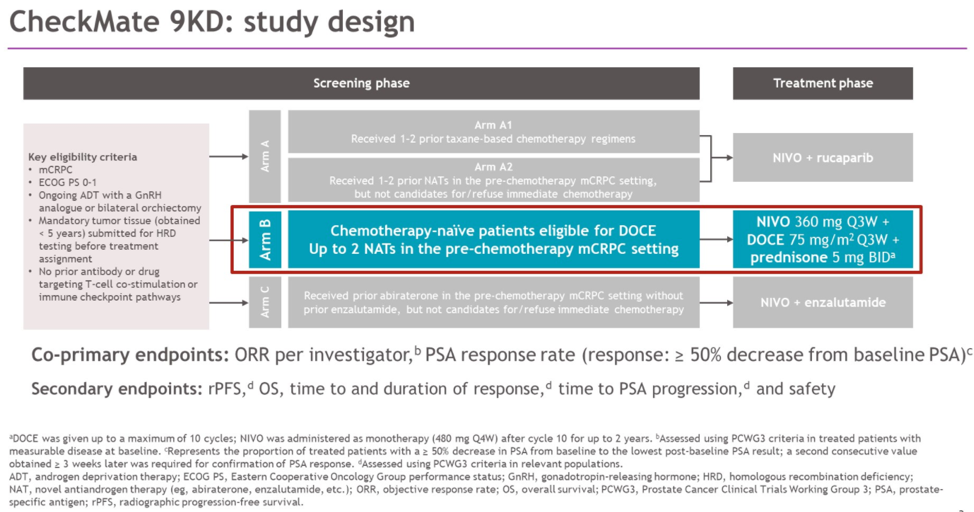
研究结果
CheckMate 9KD研究B组共纳入了84例患者,中位年龄为71岁(范围:53岁-88岁),其中27%的患者存在内脏转移,54%(45例)的患者具有可测量病灶。多西他赛化疗的中位周期数为8个周期,纳武利尤单抗的中位给药次数为11次。治疗结果汇总如下表:

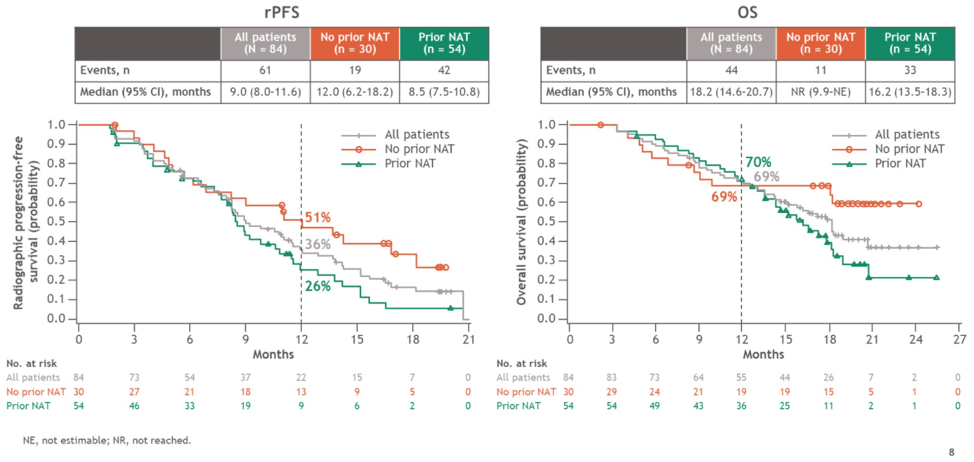
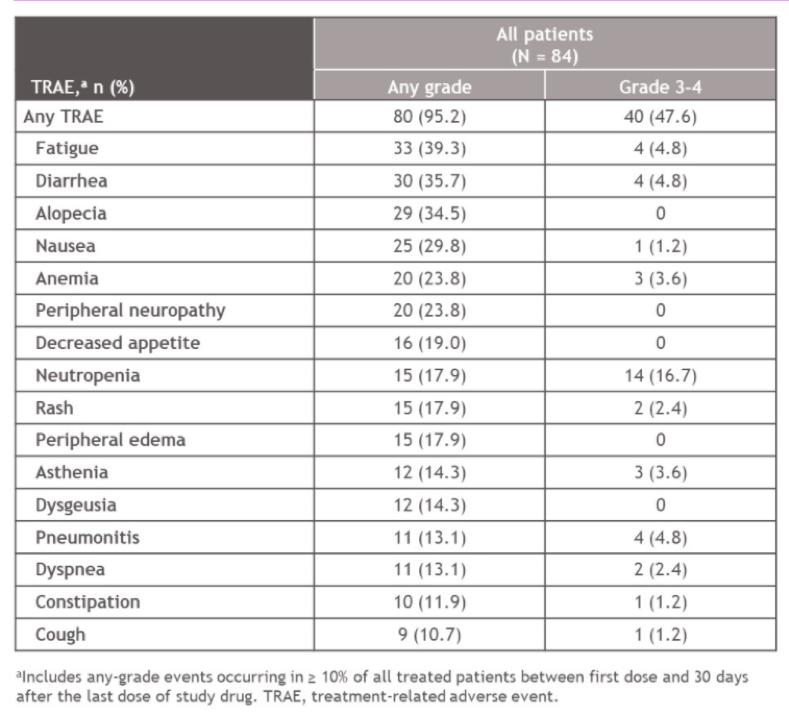
相比于既往接受过NAT的患者,既往未接受过NAT的患者PSA缓解率明显更高,中位rPFS时间也更长。OS数据虽然不成熟,但从OS曲线可以看到,接受或未接受过NAT的两组OS曲线在1年左右开始交叉,之后未接受过NAT组的OS曲线一直保持着绝对的优势。因此,从总体来看,纳武利尤单抗联合多西他赛化疗在既往未化疗的mCRPC患者中的疗效显著,安全性可靠。
(2)帕博利珠单抗的KEYNOTE-365研究
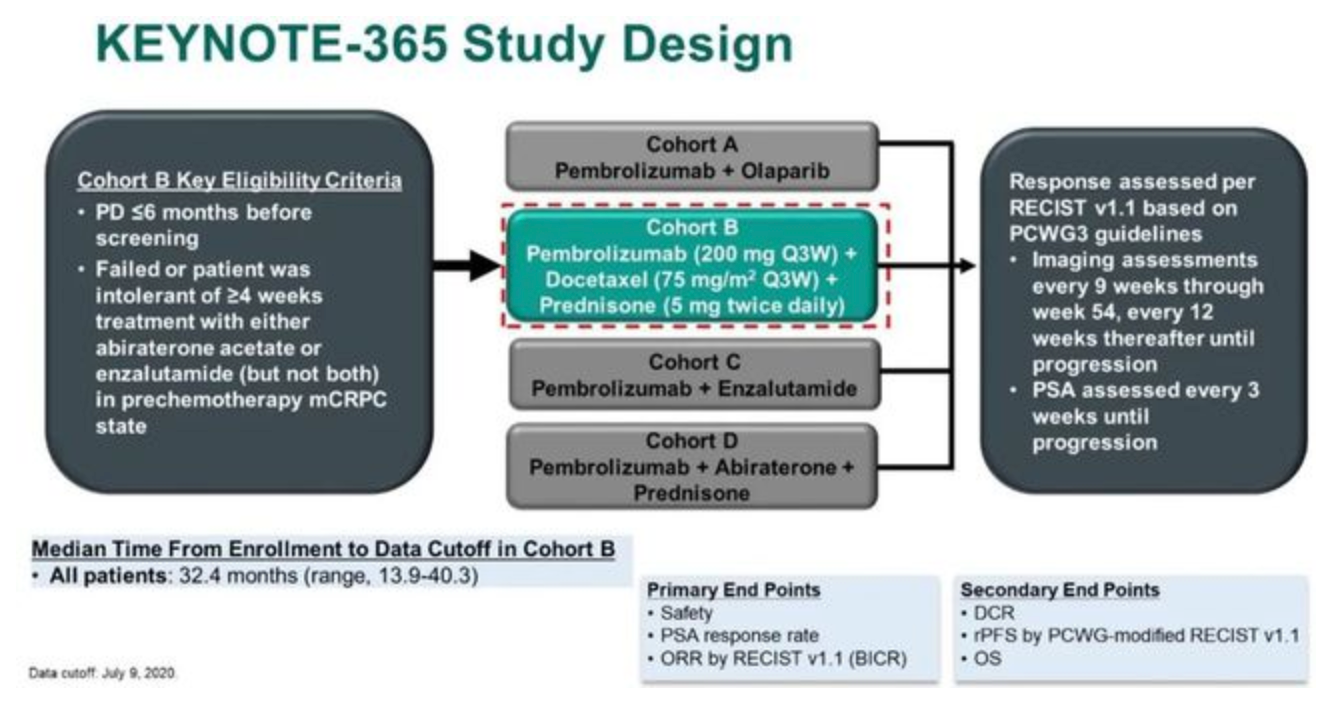
KEYNOTE-365研究是一项针对既往未化疗但接受过阿比特龙或恩扎卢胺治疗的mCRPC患者的1b/2期临床研究,分为A、B、C、D四个联合治疗组,分别接受帕博利珠单抗联合奥拉帕利、帕博利珠单抗联合多西他赛和强的松、帕博利珠单抗联合恩扎卢胺、帕博利珠单抗联合阿比特龙和强的松方案治疗。这种研究设计与CheckMate 9KD研究十分相似。本次ASCO GU大会报道了KEYNOTE-365的B组治疗更新结果。
B组治疗方案具体为:帕博利珠单抗 200mg Q3w + 多西他赛 75mg/m 2 Q3w + 强的松 5mg Bid直至PD。主要研究终点为:安全性、ORR和PSA缓解率(定义为治疗后最低PSA较基线PSA下降 ≥ 50%);次要研究终点为疾病控制率(DCR)、rPFS和OS。
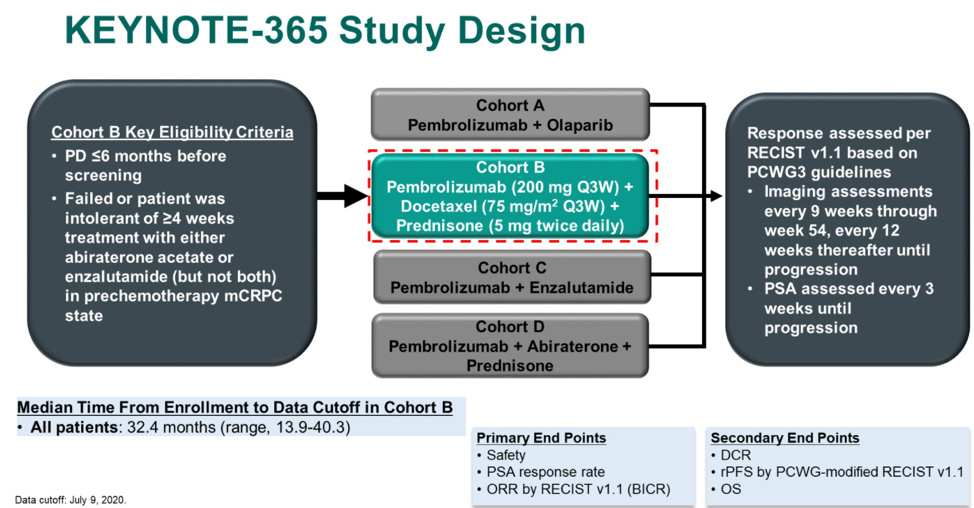
研究纳入104例患者,中位年龄68岁(范围:50岁-86岁),其中25.0%的患者具有内脏转移,50.0%(51例)的患者具有可测量病灶,可评估PSA者103例。最终的总体ORR为23.1%,DCR为76.0%,PSA缓解率为34.0%。本次中位随访时间为32.4个月,中位rPFS为8.5个月(8.3个月-10.1个月),中位OS为20.2个月(16.9个月-24.2个月)。治疗相关不良事件(TRAEs)发生率为96.2%,包括腹泻(41.3%)、乏力(41.3%)和脱发(40.4%)。≥3级的TRAEs发生率为44.2%,其中发热性中性粒细胞下降为11.5%。免疫治疗相关不良事件( irAEs)发生率为32.7%,≥3级irAEs发生率为8.7%。2例治疗相关性死亡,均为肺炎。
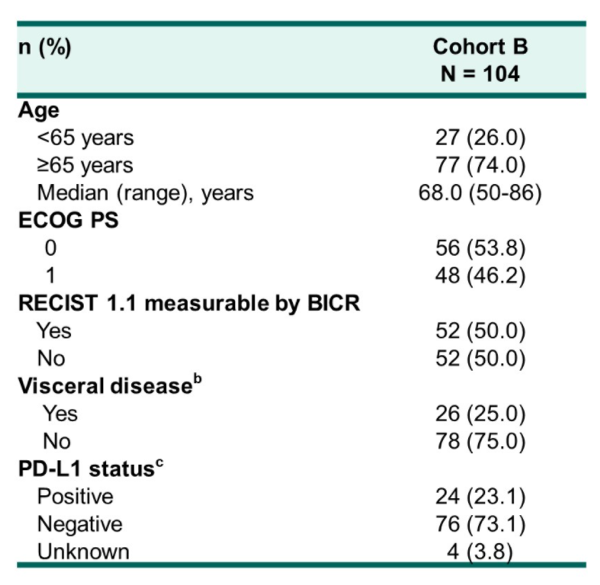
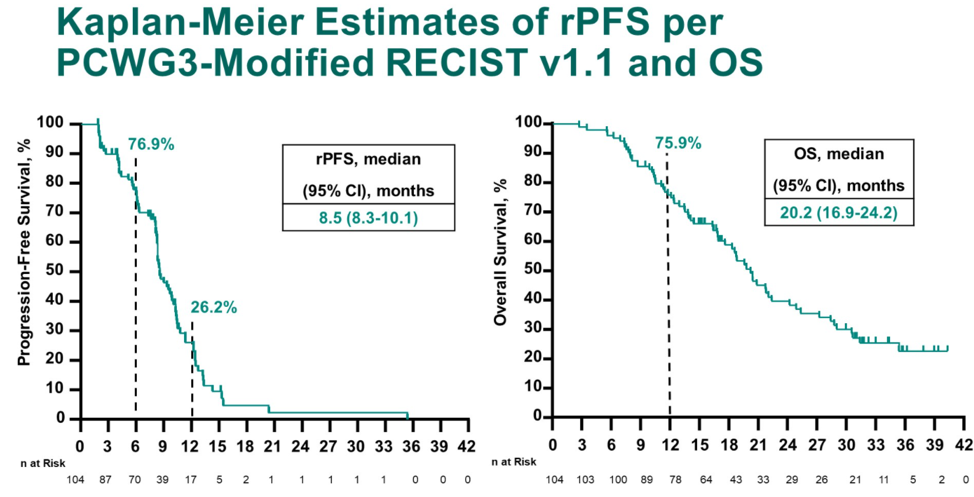
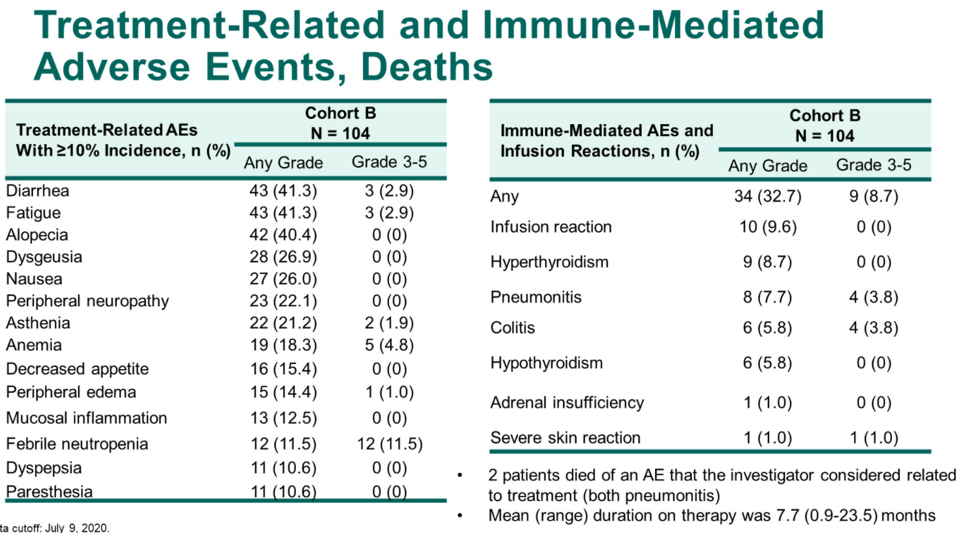
对于去势抵抗性前列腺癌,新型内分泌药物给药方便,已经成为主要的治疗选择,对于这些患者的后续治疗,尚无标准治疗。由于KEYNOTE-365研究B组和CheckMate 9KD研究B组(既往NAT)的研究对象都是既往未化疗的mCRPC患者,研究方案又都是免疫联合多西他赛和强的松化疗,可以粗略进行横向比较。
对于既往未化疗但是接受过新型内分泌治疗的mCRPC患者,两个免疫联合化疗研究的ORR略有差异,而PSA缓解率、rPFS和OS等数据均旗鼓相当,副反应类似并可控。与CheckMate 9KD的B组研究设计一致的3期临床研究(CheckMate 7DX,NCT04100018)以及与KEYNOTE-365的B组研究设计一致的3期临床研究(KEYNOTE-921,NCT03834506)目前都在有条不紊的进行中。基于各自优秀的2期研究数据,这些3期研究的结果都非常值得期待。
免疫联合放射治疗,仍待探索
(1)帕博利珠单抗联合内照射治疗,未获预期
镭223早在2013年就已经获美国FDA批准用于骨转移的mCRPC患者的治疗,而且2020年于国内获批相关适应证。既往有研究提示,镭223有可能增加mCRPC骨转移患者的免疫原性从而增加免疫检查点抑制剂(ICI)的抗肿瘤活性。本次ASCO GU大会就有人报道了帕博利珠单抗联合镭223治疗的2期临床研究。
研究对象为有骨转移、无内脏转移或淋巴结转移>2cm的mCRPC患者。患者按2:1的比例随机分配至镭223 55kBq/kg Q4w + 帕博利珠单抗 200mg Q3w治疗组(A组)或镭223 55kBq/kg Q4w单药治疗组(B组)。在3次镭223治疗后,如果评效至少为稳定(SD),则A组患者停用镭223,单用帕博利珠单抗维持至PD;而PD时只要没有内脏转移,就将恢复镭223治疗直至PD或不可耐受的毒性或完成一共6次的镭223治疗。
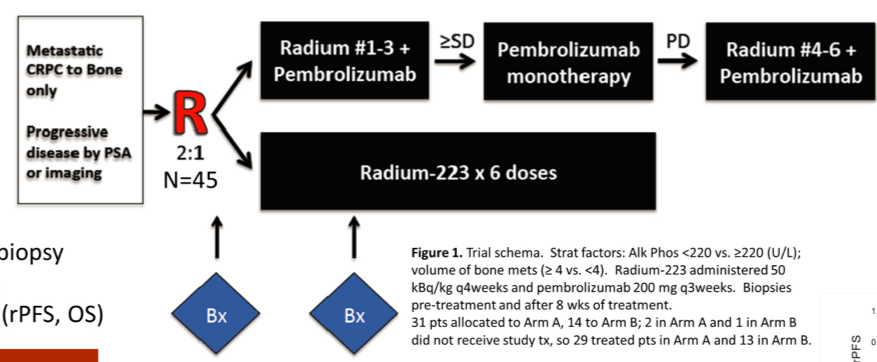
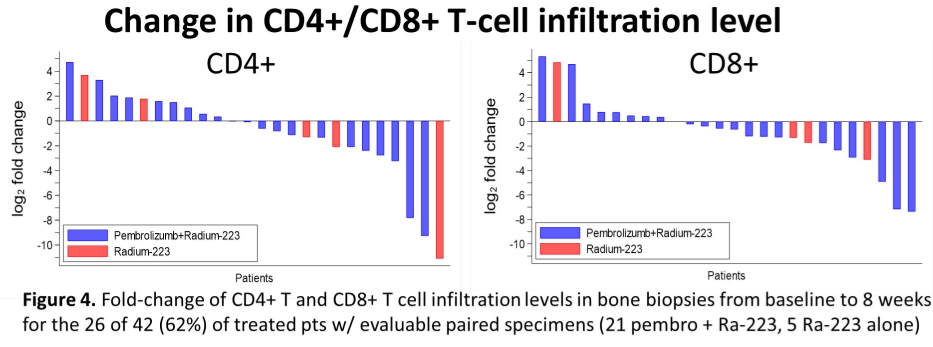
在入组的45例患者中,42例患者可评估疗效(A组29例、B组13例)。A组的3级非血液学TRAEs发生率为10%,B组无3级非血液学TRAEs的发生。两组的中位rPFS分别为6.7个月(95%CI:2.7个月-11.0个月)和5.7个月(95%CI:2.6个月-未达到);中位OS分别为16.9个月(95%CI:12.7个月-未达到)和16.0个月(95%CI:9.0个月-未达到)。两组的PSA缓解率分别为10%和0,有症状的骨不良事件(SSEs)发生率分别为38%和54%,病理性骨折的发生率分别为0和23%。
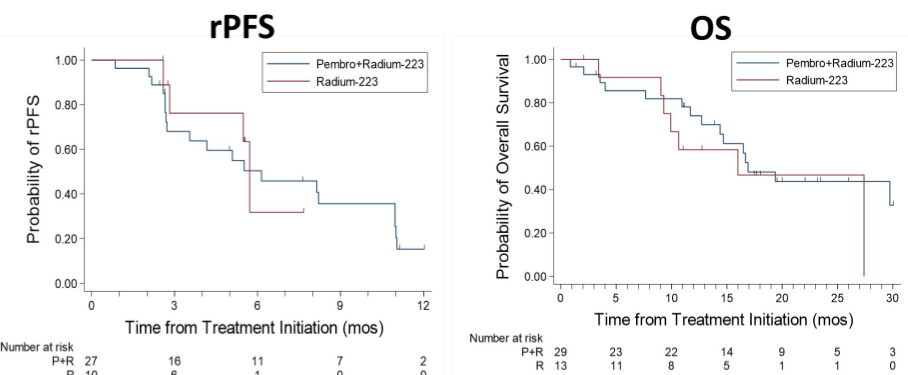
由此可以看出,除了联合组的骨不良事件和病理性骨折的风险更低以外,两组的PSA缓解率、rPFS和OS疗效数据并没有太大差异。因此,将免疫治疗加入到镭223治疗中去,虽然副反应可控,但并没有带来疗效的提升。与疗效结果相佐证的是,该研究同时通过活检标本检测了患者基线和治疗后8周的CD4+和CD8+的T细胞浸润情况,发现治疗前后并没有差异。
(2)avelumab联合外照射治疗,疾病获持久控制
放疗在多个瘤种中被认为与ICI治疗具有协同效应 1,2 。ICEPAC研究是一项多中心单臂2期临床研究,将PD-L1抑制剂阿维鲁单抗(avelumab)与立体定向放疗(SABR)相结合去治疗既往接受过≥1种新型内分泌治疗的mCRPC患者,允许既往接受过紫杉类化疗(不超过2种方案)的患者入组。具体治疗方案为:avelumab 10mg/kg Q2w,治疗共12个周期(对于12周期治疗后仍然维持疾病控制的患者允许继续avelumab治疗);并在第1次和第2次avelumab治疗前5天以内对1-2个病灶进行单次20Gy的SABR治疗。
该研究入组了31例患者,其中30例可评估疗效。所有患者中位年龄71岁(四分位距:64岁-75岁),只有骨转移者占42%,内脏转移者占16%,既往紫杉类化疗者占84%,既往阿比特龙和恩扎卢胺均失败者占13%。Avelumab作为二线、三线、四线或以上的治疗比例分别为29%、42%和29%。一共有70个转移灶接受了SABR治疗,其中骨转移灶占90%,软组织病灶占29%。Avelumab治疗中位周期数为9周期(四分位距:5周期-13周期),41%的患者接受avelumab治疗超过12个周期。≥3级的TRAE仅为16%。最终的DCR为50%(95%CI:31%-69%),软组织病灶的DCR为60%(31%-84%),ORR为33%(95%CI:12%-61%),放疗以外的病灶ORR为36%(95%CI:11%-69%),PSA缓解率为23%(95%CI:10%-42%)。中位随访18个月后,中位的rPFS为8.4个月(95%CI:4.5个月-未达到),中位OS为17.9个月(13.1-未达到)。
在经历过既往化疗失败的多线治疗(71%的患者为 ≥ 3线治疗)后的mCRPC患者中,avelumab联合放疗还是带来了比较持久的疾病控制(rPFS = 8.4个月)。后续扩大样本量的研究值得继续。同时,参照上述免疫联合内照射的研究,如果avelumab联合外照射治疗也能结合免疫微环境背景或相关biomarker进行疗效预测研究,则可能更具有指导性。
免疫治疗疗效预测研究还在艰难中探索
今年ASCO GU涉及前列腺癌的免疫治疗疗效预测研究非常少,更多有关生物标志物研究还聚焦在前列腺癌的预后分析、基因谱分析、DNA损伤同源重组修复(HRR)基因(BRCA1、BRCA2、ATM、PALB2、FANCA、RAD51D、CHEK2和CDK12等)及HRR基因缺陷(HRD)预测PARP抑制剂疗效等领域。
来自英国的一项研究通过全外显子测序(WES)、第二代测序(NGS)、RNA测序(RNAseq)、免疫组化等方法检测了mCRPC患者肿瘤活检标本中的PD-L1表达、基因表达谱(GEP)评分、错配修复(MMR)基因以及BRCA2、PALB2、CDK12、PTEN、ATM、TP53、SOX2等的表达水平或突变情况等,并将之与抗PD-1治疗后的预后进行关联分析。该研究检测了100例mCRPC患者肿瘤新鲜活检样本。
中位随访56.2个月,在所有的检测样本中,发现SOX2阳性表达率为27%,PD-L1阳性表达率达33%,GEP高评分患者比例达26%,且PD-L1表达与GEP评分呈正相关。此外,MMR病理性突变率为7%,BRCA2基因有害变异比率为9%,PALB2变异率1%,CDK12变异率3%,PTEN和ATM表达缺失分别占29%和13%,TP53突变率为25%。单因素分析显示,PD-L1阳性表达(HR = 1.75,95%CI:1.00-3.06;p = 0.045)、GEP高评分(HR = 2.00,95%CI:1.18-3.39;p = 0.0083)和SOX2阳性表达(HR = 1.81,95%CI:1.12-2.94;p = 0.015)均与患者治疗后总生存呈负性相关,而其它指标则与预后无关。
对于该研究,除了获得阳性关联结果的标志物以外,MMR突变与免疫治疗后生存无关这一点还是需要进一步判断,毕竟该研究所给出患者治疗背景欠缺,只说明了研究中的患者既往接受过至少一种新型内分泌治疗和至少一种紫杉类方案化疗,但对于抗PD-1治疗细节并未提及。
另一项来自美国的研究专门针对53例MSI-H的美国非裔晚期前列腺癌(PC)患者进行了研究,发现患者的MSI-H比率为3.7%(2例/53例),与全美数据显示的3%(62例/2090例)的比例大致相当;与英国这项研究不同的是,这两例MSI-H患者接受帕博利珠单抗治疗后获得了快速而持久的临床、生化和分子缓解,包括:PSA大幅度下降、转移性淋巴结获得影像学CR疗效、内脏转移灶未进展状态、液体活检显示前列腺癌来源的ctDNA突变消失等。
但是目前这些研究存在的问题就在于:1)样本量过少,不足以得出结论;或者2)标志物分散,缺乏强效关联;或者3)分析方法低下(比如单因素分析等),导致分析效力不足;所以无法做出高效的疗效预测。由此可见,前列腺癌免疫治疗疗效预测还将有很长的路需要走。
小结与展望
可以预见的是,经过多年的研究和实践,化疗和新型内分泌治疗仍将是晚期前列腺癌的主要治疗手段。从今年ASCO GU的各项研究看,免疫联合化疗,仍然非常值得期待。
此外,这些2期研究中的其它组别以免疫治疗联合了靶向或者内分泌治疗,至于结果,后续也值得关注。虽然这些研究都还没有披露结果,但从另一个角度说明,免疫联合治疗的研究将会是晚期前列腺癌研究的大势所趋。而预测标志物研究现阶段仍然不明确,传统在NSCLC等中的biomarkers未必适用于前列腺癌,但是探索仍然会继续。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#ASC#
88
#曙光#
103
前列腺癌相关研究,学习了,谢谢梅斯
102