天津医科大学张展展/孙少凯/孟召伟ACS Nano:大环白蛋白结合物用于肿瘤放射性核素和抗癌药物的精确输送!
2023-11-09 BioMed科技 BioMed科技 发表于上海
该研究提出了大环白蛋白结合物(MAC)作为放射性核素和抗癌药物的共递送载体,使有效的放化疗组合成为可能。
在基于放射性核素的联合放化疗中,精确地将放射性核素和抗癌药物输送到肿瘤组织中是确保药物协同作用和最佳治疗效果的关键。然而,目前的共传递载体往往依赖于物理包埋/吸附来负载抗癌药物,缺乏精确的药物加载和释放机制,导致了不可预测的联合效应。在这里,天津医科大学张展展/孙少凯/孟召伟、南开大学刘阳提出了一种大环白蛋白结合物(MAC),使抗癌药物的精确加载和控制释放成为可能。通过将多个大环主体(磺酸盐偶氮杯[4]芳烃,SAC4A)连接到白蛋白分子上,MAC通过宿主−客体相互作用和放射性核素的位置特异性标记促进了抗癌药物的精确负载。此外,MAC在低氧条件下降解,使加载的药物能够在到达肿瘤组织后释放。通过精确装载和定向输送放射性核素和抗癌药物,MAC在携带乳腺癌细胞(4T1)的小鼠中实现了有效的癌症诊断和联合放化疗。考虑到SAC4A可以负载多种抗癌药物,MAC可能为有效的联合放化疗提供一个很有前途的平台。该研究以题为“Macrocyclic-Albumin Conjugates for Precise Delivery of Radionuclides and Anticancer Drugs to Tumors”的论文发表在《ACS Nano》上。

该研究提出了大环白蛋白结合物(MAC)作为放射性核素和抗癌药物的共递送载体,使有效的放化疗组合成为可能。MAC是通过多个磺酸盐偶氮杯[4]芳烃(SAC4A)与牛血清白蛋白(BSA)分子偶联而合成的。SAC4A是一种低氧响应的大环宿主,在常氧条件下与多种抗癌药物表现出较强的结合亲和力,在低氧条件下可降解为与药物亲和力较低的氨基杯[4]芳烃(NH2C4A)。在MAC中,SAC4A作为构建块实现抗癌药物的精确加载和受控释放,而BSA丰富的氨基酸残基为MAC提供了用于放射性同位素定位标记的官能团。由于这两个功能单元在一个组件中,MAC能够有效地装载放射性同位素和抗癌药物。此外,SAC4A与抗癌药物之间强大的亲和力确保了MAC/药物的结构完整性,防止了有效载荷在血液中的任何不必要的泄漏。当到达低氧肿瘤组织时,MAC的SAC4A被生物还原酶降解,从而导致负载药物的释放和有效的放化疗联合。本研究选取临床上广泛应用于肿瘤治疗的131I和阿霉素作为具有代表性的放化疗药物组合。通过精确装载和靶向递送Na131I/DOX,MAC在乳腺癌(4T1)荷瘤小鼠中实现了有效的癌症诊断和联合放化疗。考虑到SAC4A可以负载多种抗癌药物,MAC可能为有效的联合放化疗提供一个很有前途的平台。
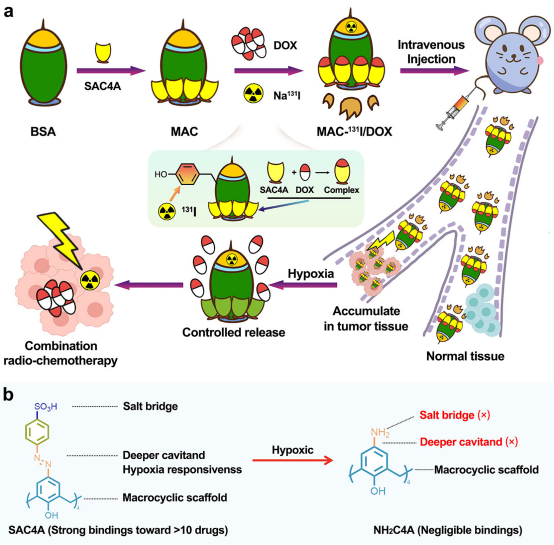
图 1.大环-白蛋白偶联物(MAC)用于有效的联合放化疗
【MAC的表征】
为了制备MAC,首先合成了缺氧响应性大环宿主SAC4A。SAC4A是通过用偶氮苯修饰杯[4]芳烃(C4A)的上缘而获得的。偶氮苯的引入使SAC4A具有更深的空腔结构,能够与多种抗癌药物牢固结合。更重要的是,SAC4A的偶氮苯基在到达缺氧肿瘤微环境后被生物还原酶有效降解,导致结合亲和力大幅降低,从而导致封装药物的释放。且SAC4A能够定量装载药物。此外,SAC4A对各种药物的普遍适用性。
高效载药和放射性同位素标记是MAC实现有效放化疗联合治疗的先决条件。为此,评估了 MAC高效放射性同位素标记的能力。I被用作模型放射性同位素,然后通过基于氯胺-T的方法标记MAC和BSA。通过放射薄层色谱(TLC)扫描仪测定,MAC和BSA对131I的标记率分别为96.88%和95.42%,表明MAC在131I标记方面具有巨大的潜力。此外,还证明了MAC−131I提供有效载药的能力。为了实现有效的联合放化疗,MAC−131I/药物应保持血流中的结构完整性,以避免不必要的有效负载泄漏。DOX作为模型药物加载到MAC中形成MAC-I/DOX。MAC-I/DOX在血液循环中具有高度的结构完整性。MAC优异的抗干扰能力应得益于其与客体分子的强结合亲和力。为了进行演示,评估了MAC-I/RhB在生物物质存在下的结构完整性,其中从MAC-I/RhB检测到的荧光恢复可以忽略不计。此外,还使用TLC 扫描仪研究了MAC−131I/DOX在PBS和FBS中的放射稳定性。BSA-131I被用作对照组。37℃孵育48小时后,超过95%的131I保留在MAC−131I/DOX上,这与BSA-131I相似,表明MAC−131I/DOX具有较高的放射稳定性。
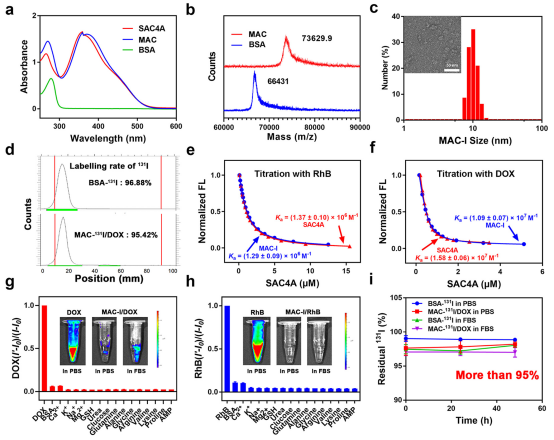
图2.MAC的结构表征
【MAC的缺氧反应性】
更重要的是,当到达缺氧的肿瘤微环境时,MAC的SAC4A很容易被生物还原酶降解为氨基杯[4]芳烃(NH2C4A),导致结合亲和力和载药释放显著降低。为了研究MAC-I对缺氧的响应能力,使用了一种类似于还原酶的化学物质--二亚硫酸钠(SDT),并将其与MAC孵育。此外,该研究还以DOX为客体分子考察了还原前后MAC与药物的结合亲和力。还原的MAC-I(NH2C4A-BSA-I)与DOX之间的结合亲和力比MAC-I低4个数量级。这种结合亲和力的显著降低表明,MAC-I有可能在降解时促进负载药物的释放。此外,该研究还评估了MAC在细胞水平上控制载药释放的能力。结果表明肿瘤组织中的MAC释放了负载药物。为了验证,使用MAC-I/DOX在4T1细胞上进行基于细胞存活率的检测。在常氧条件下,与DOX相比,MAC-I/DOX的细胞毒性可忽略不计,这表明MAC有效地屏蔽了抗癌药物,并避免了生理条件下的毒副作用。相比之下,在低氧条件下,MAC-I/DOX的细胞毒作用显著增强,说明DOX从MAC-I/DOX中释放。这种对缺氧的反应特性为MAC在肿瘤组织中实现有效的放化疗组合提供了极好的潜力。总而言之,这些体外结果强调了MAC作为联合递送载体实现成功放化疗的巨大前景。
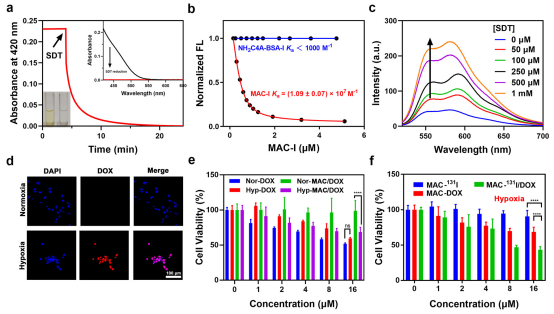
图3.MAC的缺氧可靠性
【MAC的生物安全性评价】
接下来对MAC进行了生物安全性评估,以研究其临床潜力。结果表明MAC诱导的急性炎症可以忽略不计。因此,低毒性和减轻治疗药物不良反应的能力为MAC实现有效的癌症诊断和放化疗联合治疗奠定了坚实的基础。
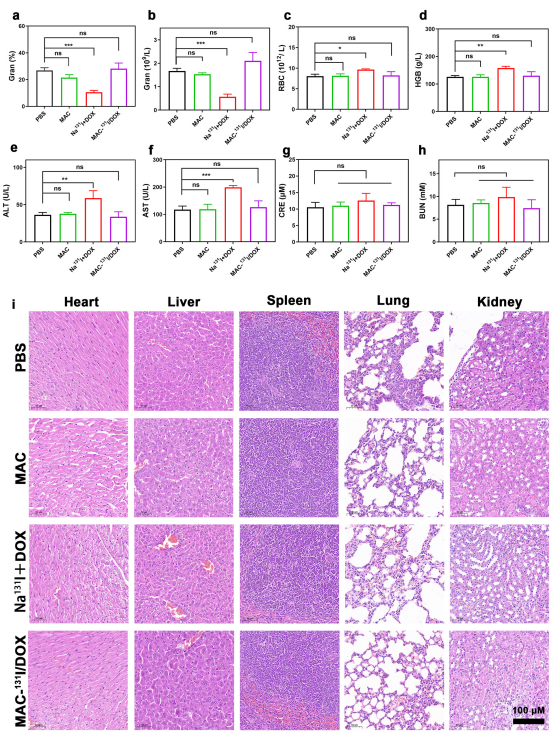
图4.MAC的生物安全性评价
【MAC的癌症诊断能力】
为了研究MAC诊断癌症的能力,该研究利用RhB作为荧光探针,将其掺入MAC中,形成了MAC-I/RhB。该研究推测,在到达肿瘤组织后,MAC-I/RhB会被生物还原酶有效地降解,导致RhB的释放和荧光的激活。为了证明这一点,将MAC-I/RhB和RhB静脉注射到4T1荷瘤小鼠体内。在注射后的不同时间,处死小鼠,采集肿瘤和主要器官,包括心、肝、脾、肺和肾进行成像。定量分析表明MAC-I/RhB通过荧光成像诊断肿瘤的能力。在注射MAC-131I的小鼠中,在注射后12小时检测到明显的肿瘤放射性。尽管总放射性逐渐下降,但靶/背景比随着时间的推移而增加,并在24小时达到最大值,表明MAC−131I具有良好的肿瘤保持能力。相比之下,游离的Na131I在6h内经历了快速的血液清除和尿液排泄,肿瘤聚集可以忽略不计。对肿瘤和主要器官放射性的半定量分析进一步证实了这些结果,在接受MAC−131I治疗的小鼠中,观察到肿瘤/肺组织的比率显著高于游离Na131I治疗的小鼠。这些结果表明,通过SPECT/CT成像,MAC在肿瘤诊断中具有巨大的潜力。
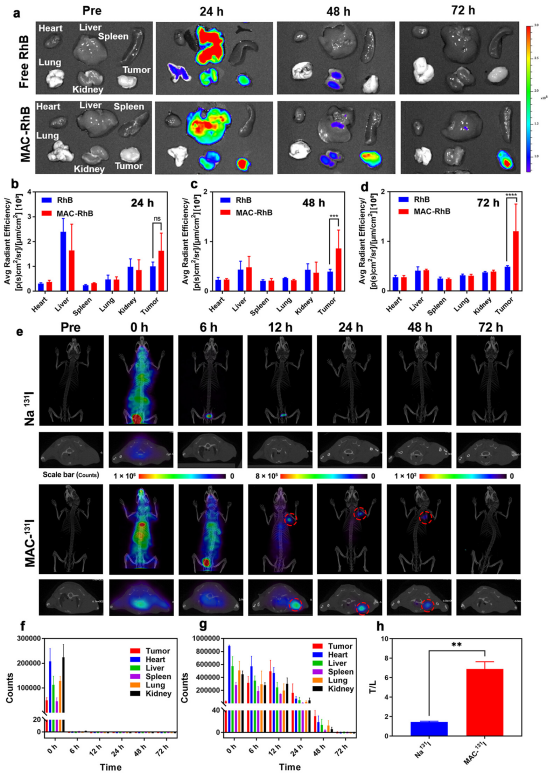
图5.MAC的癌症诊断能力
【MAC的抗肿瘤功效】
为了证明MAC作为有效的放化疗联合传递载体的广泛适用性,评估了MAC−131I/DOX的抗肿瘤效果。结果显示了MAC−131I/DOX治疗的小鼠具有显著的肿瘤抑制,这表明MAC−131I/DOX实现了有效的放射联合治疗。此外,通过针对凋亡标记和增殖标记的额外免疫荧光染色证实了这些发现。在MAC−131I/DOX治疗的小鼠肿瘤切片中,观察到原位末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)凋亡信号显著增强,Ki67增殖信号显著减弱。MAC具有显著的肿瘤抑制作用和可忽略的毒性作用,显示了其作为联合递送载体在开发安全有效的放化疗组合方面的巨大潜力。
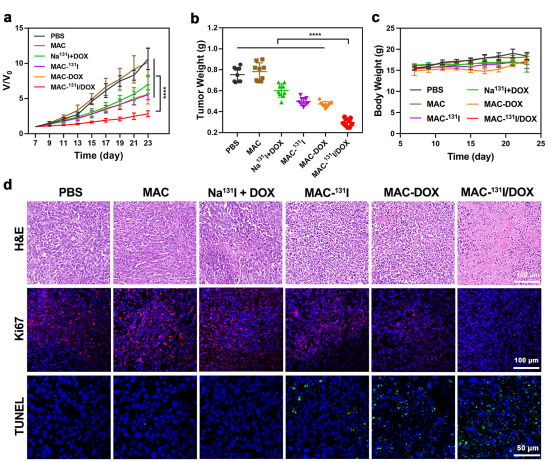
图6.MAC的抗肿瘤功效
【小结】
该研究开发了一种能够精确装载和共同递送放射性同位素和抗癌药物的MAC,用于有效的联合放化疗。MAC是通过多个低氧响应性大环宿主SAC4A与BSA分子缀合而合成的。集成的SAC4A作为MAC的基本组成部分,能够精确加载和控制释放各种药物,而BSA丰富的氨基酸残基允许对MAC中的放射性同位素进行位点特异性标记。通过将这两个功能单元组合在一个组件中,MAC有助于有效装载放射性同位素和抗癌药物。到达肿瘤组织后,MAC 的SAC4A减少,导致负载药物的释放和有效的联合放化疗。通过利用131I和DOX作为模型组合,MAC−131I/DOX在4T1荷瘤小鼠的癌症诊断和联合放化疗中表现出令人印象深刻的性能。此外,SAC4A对多种抗癌药物的强结合亲和力使得MAC-131I能够与其他药物协同作用。这些结果凸显了MAC作为实现基于放射性同位素的联合治疗的平台技术的潜力。鉴于放疗和化疗在临床环境中的广泛使用,该研究预计像MAC这样的共传递载体将成为研究和临床应用中联合放化疗的理想策略。
原文链接:
https://doi.org/10.1021/acsnano.3c04718
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







