上海交大夏伟梁/陆舜Science大子刊:PTPRT缺失可通过调节STING通路在非小细胞肺癌中增强抗PD -1治疗效果
2024-09-16 BioMed科技 BioMed科技 发表于上海
首次发现并系统阐述了受体型蛋白酪氨酸磷酸酶PTPRT缺失通过调节STING通路增强免疫检查点抑制剂(ICI)疗效的分子机制。
免疫疗法及其分子生物标志物
免疫检查点抑制剂(ICIs)的出现彻底改变了许多类型癌症的治疗。然而,只有有限比例的患者从持续反应的ICI中受益,接受治疗的患者中有30%以上发生了严重的不良事件。目前,美国食品药品监督管理局批准且在非小细胞肺癌中使用最广泛的ICI生物标志物是程序性死亡配体1(PD-L1)表达。一些PD-L1高表达的患者无法从ICI治疗中获得持久的临床益处(DCB),但20%的PD-L1表达阴性的患者会产生反应。这些复杂的情况意味着,仅靠PD-L1表达不足以预测反应。其他分子生物标志物,如肿瘤突变负荷(TMB)、肿瘤浸润淋巴细胞和特定肠道微生物组,已被探索以确定与临床结果的关联。然而,由于缺乏统一的标准和检测的复杂性,它们在临床实践中存在局限性。因此,识别与ICIs反应相关的精确和方便的生物标志物,对于实现精确治疗非常重要。
受体型蛋白酪氨酸磷酸酶(RPTPs)是一个跨膜免疫球蛋白家族,由20多个成员组成,它们共享同源磷酸酶结构域,分布在多个细胞膜上。蛋白酪氨酸磷酸酶受体T型(PTPRT)是RPTPs的成员,它可使STAT3的Y705残基和paxillin的Y88残基去磷酸化,调节细胞过程,包括增殖、粘附和存活。PTPRT突变在多种癌症类型中普遍存在(11%的结肠癌、10%的肺癌、11%的食道癌、9%的胃癌、8%的子宫内膜癌和6%的头颈癌),磷酸酶结构域的突变降低了其酶活性。然而,PTPRT调节免疫反应的潜在分子机制尚未得到探索。
新型标志物
在这项研究中,上海交通大学夏伟梁/陆舜团队等人首次发现并系统阐述了受体型蛋白酪氨酸磷酸酶PTPRT缺失通过调节STING通路增强免疫检查点抑制剂(ICI)疗效的分子机制。作者评估了蛋白酪氨酸磷酸酶受体T型(PTPRT)的缺失作为抗PD-1/L1治疗反应的预测因素。在小鼠模型中的研究表明,PTPRT缺陷型肿瘤依赖STING通路对抗PD-1治疗做出反应,这项研究可以帮助对受益于这种治疗的患者进行分层。相关工作以“PTPRT loss enhances anti–PD-1 therapy efficacy by regulation of STING pathway in non–small cell lung cancer”为题发表在Science Translational Medicine。

【文章要点】
干扰素基因刺激因子(STING)是连接先天免疫和适应性免疫的最关键的信号转导子之一,控制许多宿主防御基因的转录,包括促炎细胞因子和I型干扰素(IFN)。鉴于环鸟苷一磷酸-腺苷一磷酸合酶(cGAS)-STING通路在增强细胞毒性T淋巴细胞或自然杀伤(NK)细胞介导的细胞毒性中的作用,肿瘤局部STING激活在启动内源性抗肿瘤免疫中的重要性已得到充分证实。翻译后修饰(PTMs),特别是磷酸化、泛素化、sumoylation、乙酰化、甲基化和谷氨酰化,极大地影响了STING相关蛋白的活性和功能,从而在相应的不同背景下动态调节免疫反应。因此,探讨STING PTMs的作用和调控机制是极具意义的。为此,在该研究中,研究团队通过对非小细胞肺癌公共数据库分析和临床样本验证,发现携带T型受体蛋白酪氨酸磷酸酶(PTPRT)基因突变特别是磷酸酶片段突变的患者更能从免疫检查点抑制剂(ICI)治疗中获益。此外,PTPRT蛋白表达阴性的患者也是ICI治疗的响应人群。由此提出肿瘤PTPRT缺失是独立于PD-L1表达的预测ICI疗效的新型生物标志物(图1)。
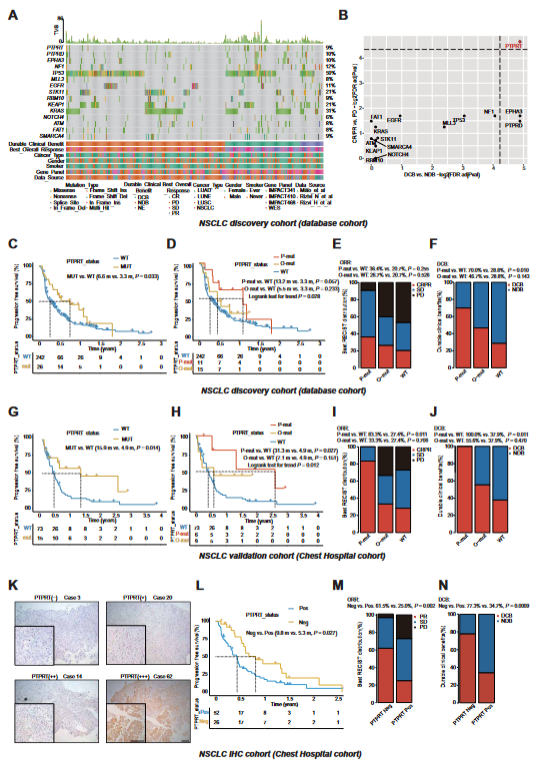
图1 非小细胞肺癌患者的PTPRT缺陷可在抗PD -1治疗中获益
研究团队通过转录组蛋白组测序、分子模拟和蛋白互作等实验阐明了分子机制:PTPRT 缺失型肿瘤表现出累积的 DNA 损伤、增加的胞质 DNA和更高的肿瘤突变负荷,间接激活STING通路。同时,鉴定出PTPRT去磷酸化的新底物为STING Y240位点。肿瘤PTPRT缺失提高了STING Y240位点酪氨酸磷酸化水平,抑制了STING的泛素化降解(图2)。
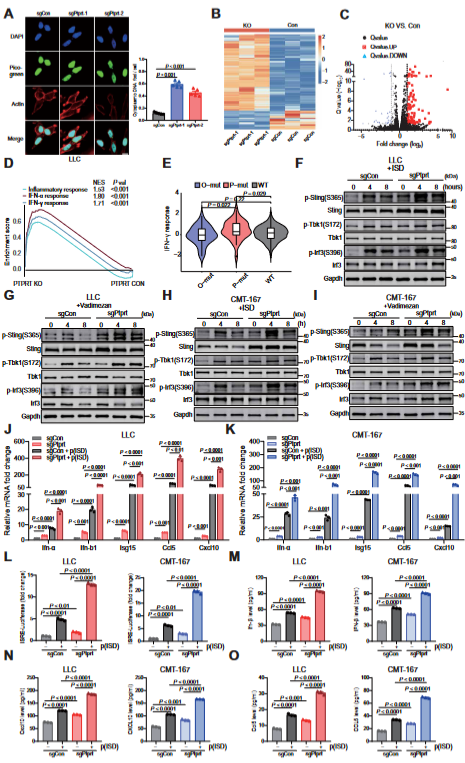
图2 PTPRT缺乏增加细胞质DNA并激活cGAS-STING通路
抗PD-1/PD-L1轴治疗显著提高了PTPRT缺陷型肿瘤患者的无进展生存率。PTPRT缺陷型肿瘤表现出累积的DNA损伤、细胞质DNA释放增加和更高的肿瘤突变负担。PTPRT缺陷型肿瘤通过激活STING通路释放更多的IFN-β、CCL5和CXCL10,并增加免疫细胞浸润,特别是CD8 T细胞和自然杀伤细胞的浸润,最终增强了抗PD-1治疗在多种皮下和原位肿瘤小鼠模型中的疗效。PTPRT缺陷型肿瘤对抗PD-1治疗的反应取决于肿瘤固有的STING通路(图3)。总之,该研究结果揭示了PTPRT缺陷型肿瘤对抗PD-1治疗敏感的机制,并强调了PTPRT在先天免疫中的生物学功能。考虑到PTPRT突变和阴性表达的普遍性,本研究对患者分层和临床决策具有重要价值。
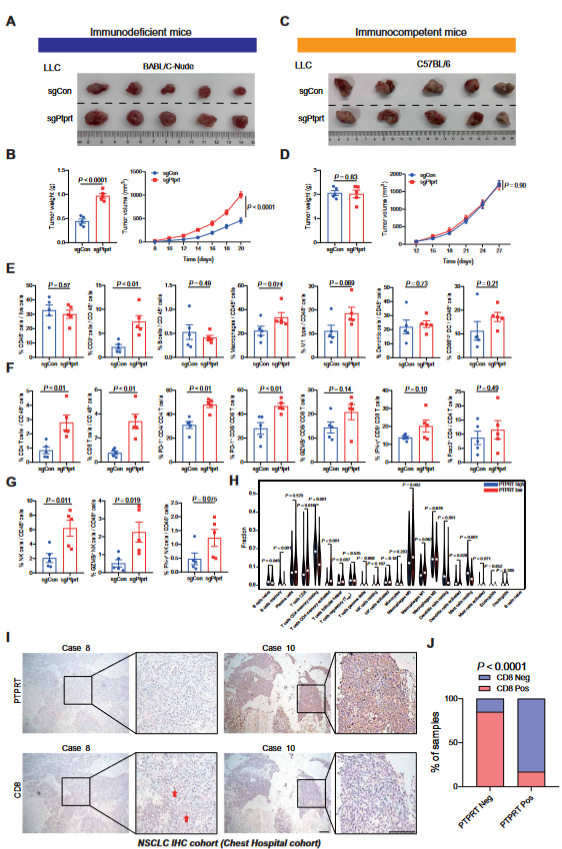
图3 PTPRT缺乏会重新编程肿瘤免疫微环境
【结论与展望】
最后,作者也指出了这项研究的局限性。这是一项对接受抗PD-1/PD-L1治疗的晚期非小细胞肺癌患者的回顾性研究,样本量有限;因此,未来需要进行更大规模的前瞻性研究来评估PTPRT的预测价值。此外,在未来的研究中,应考虑结合不同的生物标志物来提高预测ICI反应的准确性。总的来说,该研究数据揭示了PTPRT缺乏在积累TMB、提高STING Y240位点磷酸化、抑制STING降解和促进免疫细胞浸润方面的重要性。本研究提供了证据,表明PTPRT缺陷型NSCLC可以从抗PD-1治疗中受益,并为设计新的联合策略奠定了基础。
原文链接:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#非小细胞肺癌# #STING通路# #PD-1治疗#
62