Cell:邓宏魁成功使特化的细胞转分化为多潜能干细胞(iPS)
2013-07-21 MedSci MedSci原创
中国科学家7月18日在美国《科学》杂志上报告说,他们用一种非常简单和更加安全的方法,将体细胞制成多潜能干细胞,并用这种细胞培育出多只健康的小鼠,其中一只叫“青青”的小鼠刚过完100天的生日。这篇研究论文发表在今年5月份的Cell上。研究人员说,这是一项革命性的研究成果,为未来细胞治疗甚至器官移植提供了理想的细胞来源,将极大地推动治疗性克隆的发展,即克隆组织和器官以用于疾病治疗。哺乳动物细胞只有在胚
中国科学家7月18日在美国《科学》杂志上报告说,他们用一种非常简单和更加安全的方法,将体细胞制成多潜能干细胞,并用这种细胞培育出多只健康的小鼠,其中一只叫“青青”的小鼠刚过完100天的生日。这篇研究论文发表在今年5月份的Cell上。
研究人员说,这是一项革命性的研究成果,为未来细胞治疗甚至器官移植提供了理想的细胞来源,将极大地推动治疗性克隆的发展,即克隆组织和器官以用于疾病治疗。
哺乳动物细胞只有在胚胎早期发育阶段才具有分化为各种类型组织和器官的“多潜能性”,而随着生长发育成为成体细胞后会逐渐丧失这一功能。人类一直在寻找方法让已分化的成体细胞逆转,使之重新获得类似胚胎发育早期的“多潜能性”。
此前,通过借助卵母细胞进行细胞核移植或使用导入外源基因的方法,哺乳动物体细胞被证明可以进行“重编程”获得“多潜能性”,这两项技术共同获得了2012年诺贝尔生理学或医学奖。
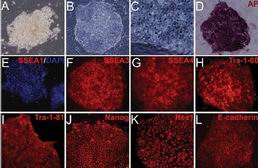
北京大学生命科学学院邓宏魁教授和赵扬博士带领的研究团队开展这项技术的方法更简单和安全,他们仅使用4个小分子化合物的组合对体细胞进行处理,就成功逆转其“发育时钟”,重新赋予体细胞“多潜能性”。
邓宏魁对新华社记者说:“使用这项技术,我们成功地将已特化的小鼠成体细胞诱导成为可以重新分化发育为心脏、肝脏、胰腺、皮肤、神经等多种组织和细胞类型的‘多潜能性’细胞,并将其命名为‘化学诱导的多潜能干细胞’。”
邓宏魁指出,这个新方法摆脱了以往技术手段对于卵母细胞和外源基因的依赖,避免重编程技术进一步应用所遭受的一些质疑,例如破坏胚胎或基因突变风险等。
在实验中,他们利用这种新方法,将成年小鼠的肺部成纤维细胞培育成一只叫“青青”的小鼠。邓宏魁说:“目前,‘青青’刚过完100天的生日,它发育良好,健康可爱,并且已有了它的‘孩子’。和以前用转基因的重编程技术得到小鼠相比,它可以不用再为外源癌症基因的重新激活等健康风险而感到担心。”
研究人员说,这项新技术让人惊奇的是,原本人们认为复杂而严密的分化发育过程竟然可以通过如此简单的方式实现逆转。更有意思的是,这条新途径的早期变化过程同低等动物再生的早期过程中所涉及的分子机制比较类似。
此外,这项研究成果还有助于人们更好地理解细胞命运决定和细胞命运转变的机制,使人类未来有可能通过使用小分子化合物的方法,直接在体内改变细胞命运。这样,治疗疾病所需要的细胞功能或许可以直接通过小分子化合物来重塑。
邓宏魁说:“如果这一目标得以实现,许多难以治疗的疾病将会得到全新的解决方案,整个再生医学领域也将会发生新的变革。”
原始出处:
Shu J, Wu C, Wu Y, Li Z, Shao S, Zhao W, Tang X, Yang H, Shen L, Zuo X, Yang W, Shi Y, Chi X, Zhang H, Gao G, Shu Y, Yuan K, He W, Tang C, Zhao Y, Deng H.Induction of pluripotency in mouse somatic cells with lineage specifiers. Cell. 2013 May 23;153(5):963-75.
New balance in pluripotency: reprogramming with lineage specifiers.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CEL#
109
#转分化#
90
#Cell#
109
#细胞转分化#
69
#iPS#
122