免疫学大牛!清华大学祁海教授发表多篇Nature、Science
2016-09-06 佚名 生物探索
<div>导语:8月30日,清华大学祁海(Hai Qi)教授在Nature Reviews Immunology杂志(<a class="channel_keylink" href="//m.capotfarm.com/sci/">影响因子</a>39.416)上发表了题为“T follicular helper cells in space-time”的综述文章。事实上,这位“大牛”8月初也在Nature上发表了一项重要的免疫学成果,揭示了一种新的CD8+T细胞亚群。小编注意到,近几年,祁海教授在Nature、Science等杂志上发表了多项研究成果。现在,就跟随小编来一起了解下这位“大牛”究竟积累了哪些成果吧。</div><div><br></div><div><p style="margin: 0px; padding: 0px; max-width: 100%; clear: both; min-height: 1em; box-sizing: border-box !important; word-wrap: break-word !important;"><img s

图片来源:清华新闻网
滤泡辅助性T细胞(T follicular helper,Tfh)通过控制生发中心(germinal centres)的形成以及细胞反应对体液免疫的发展起到了至关重要的作用。Tfh细胞具有独特的分子、细胞和组织动力学特征。这一综述中,祁海教授回顾了Tfh细胞生物学的近期进展,并从时空(spatiotemporal)和功能的角度探讨了这些进展对理解体液免疫中T细胞分化和记忆的影响。
综述第一部分内容,祁海教授首先简要总结了效应CD4+ T细胞谱系发展目前的范式(paradigm),然后讨论了Tfh细胞的多种特征。紧接着,祁海教授分8个部分,介绍了范式不兼容的(Paradigm-incompatible)Tfh细胞的特征、3个时空阶段(图1)、Tfh细胞的维持和启动等内容。
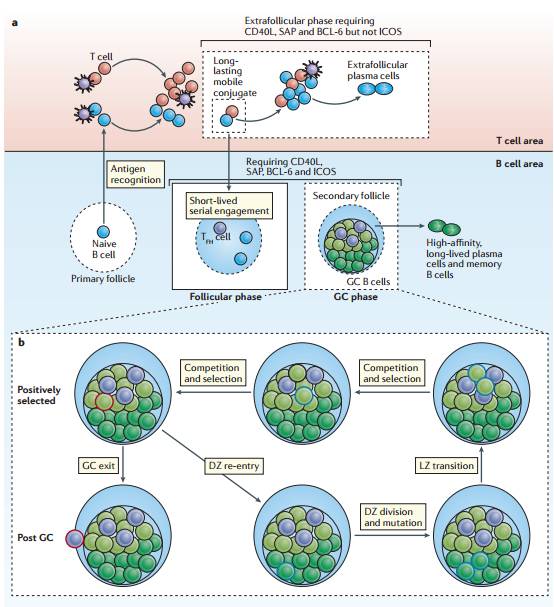
图1:Three phases of a T cell dependent B cell response.(来源:Nature Reviews Immunology)
除了月底发表的这一“重量级”综述,8月初,祁海教授以共同通讯作者的身份在Nature杂志上发表了一项免疫学新发现。在这项研究中,科学家们发现,在淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus , LCMV)慢性感染的小鼠中,表达趋化因子受体CXCR5的eCD8+ T细胞亚群对控制病毒复制起到关键的作用。
研究人员比较了CXCR5+ 和CXCR5- CD8+ T细胞的表型和功能。引人注目的是,与CXCR5-亚群相比,CXCR5+CD8+ T细胞表达了更低水平的抑制性受体分子PD-1和 Tim-3,以及更高水平的刺激性分子KLRG1。当利用T细胞过继转移治疗慢性感染小鼠时,CXCR5+CD8+ T细胞亚群比CXCR5−亚群表现出更好的治疗潜力。此外,联合抗PD-L1疗法还对降低病毒载量产生了协同效应。
研究还表明,HIV特异性CXCR5+CD8+ T过继转移或者靶向E2A/Id2轴有望更有效地清除HIV感染。此外,考虑到慢性病毒感染和癌症之间很大程度上共享了T细胞耗竭机制,这项研究可能为癌症免疫疗法带来新的曙光。【更多阅读《Nature:中国科学家发表免疫学重要成果,“找出”关键T细胞》】
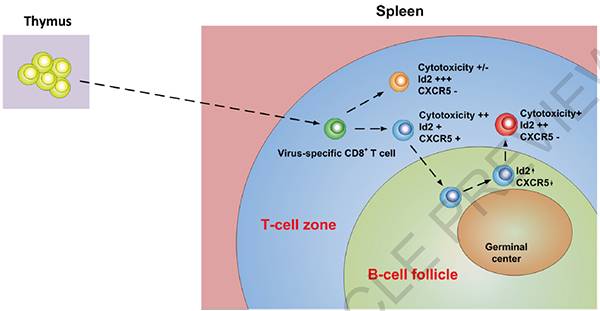
Diagrammatic summary of the fate of CXCR5+ CD8+ T cells during chronic viral infection.(图片来源:Nature)
据了解,自2009年起任职于清华大学的祁海教授2003年毕业于德克萨斯州加尔维斯顿医学院,获病理学博士学位,主要从事免疫寄生虫学研究;2003年6月至2009年4月在美国国立卫生研究院从事博士后研究,参与完善了基于双光子显微镜的在体免疫组织动态成像技术,主要关注体液免疫调节、多细胞在体交互作用机制、细胞与组织动态对免疫反应及记忆的影响。
近年来,他在Nature、Science等顶级杂志上发表了多项成果,在滤泡辅助T细胞和生发中心生物学方向获得突破性发现,为体液免疫调节研究领域作出了重要贡献。以下列举祁海教授近年来部分研究成果:
2006年:Science
2006年,祁海教授以第一作者的身份在Science杂志上发表了题为“Extrafollicular Activation of Lymph Node B Cells by Antigen-Bearing Dendritic Cells”的论文,证明了B细胞在体内受树突状细胞活化的过程。
2008年:Nature
2008年,祁海教授在Nature杂志上发表了题为“SAP-controlled T–B cell interactions underlie germinal centre formation”的论文,揭示了SAP分子参与调控T-B细胞的相互作用。
2013年:Nature
2013年,祁海教授以通讯作者的身份在Nature杂志上发表了题为“Follicular T- helper cell recruitment governed by bystander B cells and ICOS-driven motility”的论文,首次揭示了ICOS共刺激分子直接控制T淋巴细胞在体内迁移运动的新功能,为理解体液免疫调节提供了新线索。
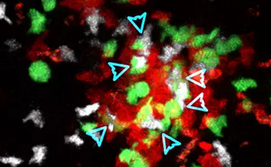
通过使用多种基因工程小鼠模型,结合经典细胞免疫学手段与双光子在体内实时成像技术,祁海教授研究小组的研究显示,ICOS通过PI3K信号诱导细胞伪足发生,促进T细胞在体内的持续性运动能力。在淋巴器官滤泡区,B细胞组成性表达 ICOS的配体(ICOSL),从而通过持续刺激ICOS信号使T细胞能够有效迁移到滤泡区。因此,ICOS信号在体内其实可以直接控制T细胞运动能力,直接决定它们在滤泡区组织中的迁移与分布。

图为通过双光子显微镜实时观察到的生发中心内T细胞(白色)更倾向与正常 (绿色)而不是ICOSL缺陷型(红色)B细胞纠缠互作的情况。(图片来源:清华大学)
2014年:Nature
2014年,祁海教授课题组在Nature杂志上发表了题为“T-B-cell entanglement and ICOSL-driven feed-forward regulation of germinal centre reaction”的论文,揭示了机体在免疫应答中逐步增高抗体亲和力的新机制,阐明了重要免疫疾病相关分子ICOSL(诱发共刺激分子配体)在这一过程中的决定性作用,为改善抗病毒抗体疫苗提供了一个可能操控的重要靶点。
研究结果证明了ICOSL分子驱动的细胞间互作正反馈循环,揭示出细胞竞争、选择这看似随机过程的内在调节规律。更重要的是,过去我们几乎不可能人为操控疫苗抗体亲和力特性,而这项研究创造了通过调节ICOSL相关通路来实现这一目标的可能,为开发更有效的抗病毒中和抗体疫苗开辟了潜在的新方向。
2016年:Nature
论文题目:Follicular CXCR5-expressing CD8+ T cells curtail chronic viral infection
据清华新闻网介绍,祁海教授现为教育部“***”特聘教授、国家自然科学基金委“杰出青年”、科技部“973”项目首席科学家,并在2014年入选科技部创新人才推进计划“中青年科技创新领军人才”(万人计划)。2015年,祁海教授获第八届谈家桢生命科学奖创新奖,不久前,刚刚获得第十一届华人生物学家协会青年奖。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#免疫学#
78
#Nat#
87
好文章,受益
149
大牛就是大牛?
91
#SCIE#
144
#清华#
59
继续学习
156
继续学习
99
谢谢分享!
97
继续关注!
79