川大张凌/刘振谧《自然·通讯》:细胞膜“减肥”后靶向更轻松
2023-09-08 BioMed科技 BioMed科技 发表于上海
细胞膜“减肥”后可逃避机体免疫监视,避免血液吞噬细胞清除,同时保留细胞膜蛋白的靶向性。本研究开发了一种简单、有效、安全且广泛适用的细胞膜“减肥策略”,为解决纳米药物的脱靶难题提供了新思路。
单核吞噬系统(MPS)对纳米粒的非特异性清除作用是纳米药物面临的重大挑战之一。有研究表明,MPS摄取了超过 95%静脉注射的纳米粒,严重影响纳米粒的靶向性和安全性。当纳米粒进入血液后,血液中大量的蛋白(如补体)会吸附在纳米粒表面,被标记的纳米粒很快地被血液中具有特异性受体(如补体受体)的吞噬细胞(包括单核细胞、中性粒细胞和淋巴细胞等)捕获和清除,这也是众多纳米药物在临床实验中未能展现靶向性的重要原因之一。
作为一种重要的仿生药物输送系统,细胞膜包覆的纳米颗粒近年来得到了广泛研究,并在药物靶向递送中表现出多种优势。然而,目前针对仿生纳米粒的研究大多采用免疫缺陷的裸鼠进行相关试验(裸鼠外周血的淋巴细胞数目较少,对异源性物质的排斥能力较弱),仿生纳米粒在免疫健全机体中的靶向性有待进一步改善。尽管仿生纳米粒所用的细胞膜也由磷脂、胆固醇和蛋白质等组成,但其大小、形态等与血液中正常细胞相比仍然有较大差异,易被机体的免疫系统识别为异物而清除,抑制MPS对仿生纳米粒的清除有望提升其肿瘤靶向性。修饰 PEG或者其它亲水性高分子材料在抑制 MPS 摄取仿生纳米粒的同时也会掩蔽其表面的靶向分子,削弱其靶向性。如何抑制 MPS 对仿生纳米粒的摄取并保持其良好的靶向性仍然是一个难题,亟需提出一种新的“隐身”策略。
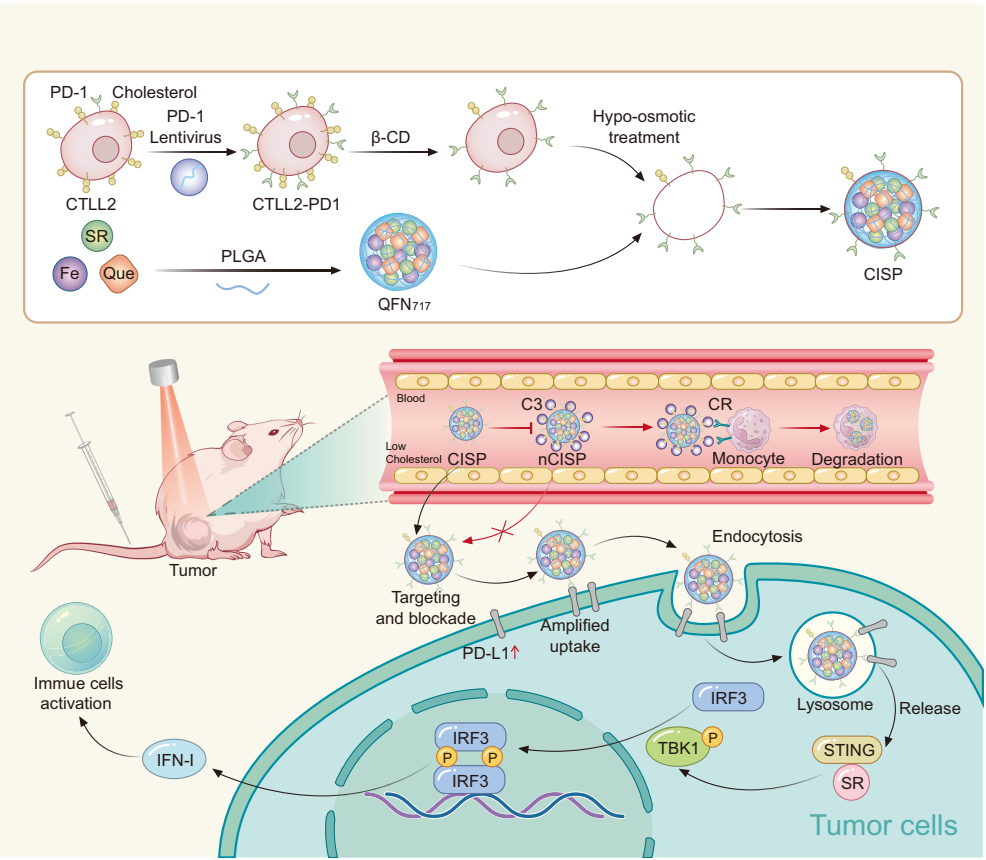
图1.CISP的制备以及CISP递送STING激动剂SR-717的机理示意图
在研究最初阶段,作为一种模型细胞膜,研究者使用过量表达PD-1的T细胞膜包裹STING激动剂SR-717(简称nCISP)。期望仿生纳米粒表面的PD-1能够识别并结合肿瘤细胞的PD-L1,随后PD-L1与纳米药物一同被肺癌细胞内吞,从而靶向激活肿瘤STING信号通路并解除肿瘤免疫逃逸的风险。然而,尽管nCISP在体外实验中展示出良好的靶向性,它在小鼠体内却没能显示出任何靶向。PEG融合几乎无差别地抑制巨噬细胞和肿瘤细胞对nCISP的摄取。PEG-nCISP也未能显示出肿瘤靶向性。
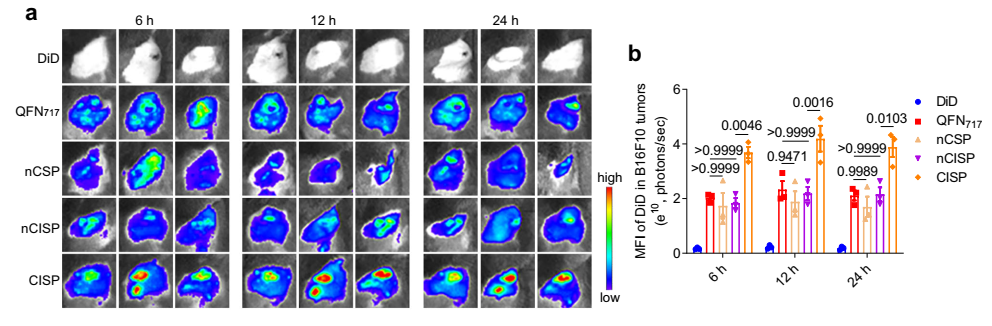
图2. CISP在体内的肿瘤靶向性
通过文献调研申请者注意到,脂质体对血液补体的吸附与脂质体的胆固醇含量相关,降低胆固醇的含量可以减弱补体对脂质体的影响,延长脂质体的血循环时间,提升其肿瘤靶向性。细胞膜和脂质体具有高度相似的磷脂双分子层结构,胆固醇作为脂质体和细胞膜组分之一,疏水性较强,可能通过影响磷脂双分子层的亲疏水性而影响其对补体等蛋白的吸附能力。申请者猜测,适当降低细胞膜的胆固醇含量能够减弱补体和其它蛋白对仿生纳米粒的吸附作用,从而降低MPS对仿生纳米粒的摄取,提升其肿瘤靶向性。为了验证这一科学设想,申请者采用甲基-β-环糊精处理T细胞,提取得到胆固醇含量降低的T细胞膜,并包裹搭载SR-717纳米粒,得到“减肥”型仿生纳米粒(简称CISP)。与普通膜相比,此种低胆固醇态细胞膜的肿瘤靶向性增加了~2倍。进一步的研究发现,细胞膜“减肥”后不宜被血液单核细胞吞噬,血液半衰期延长。
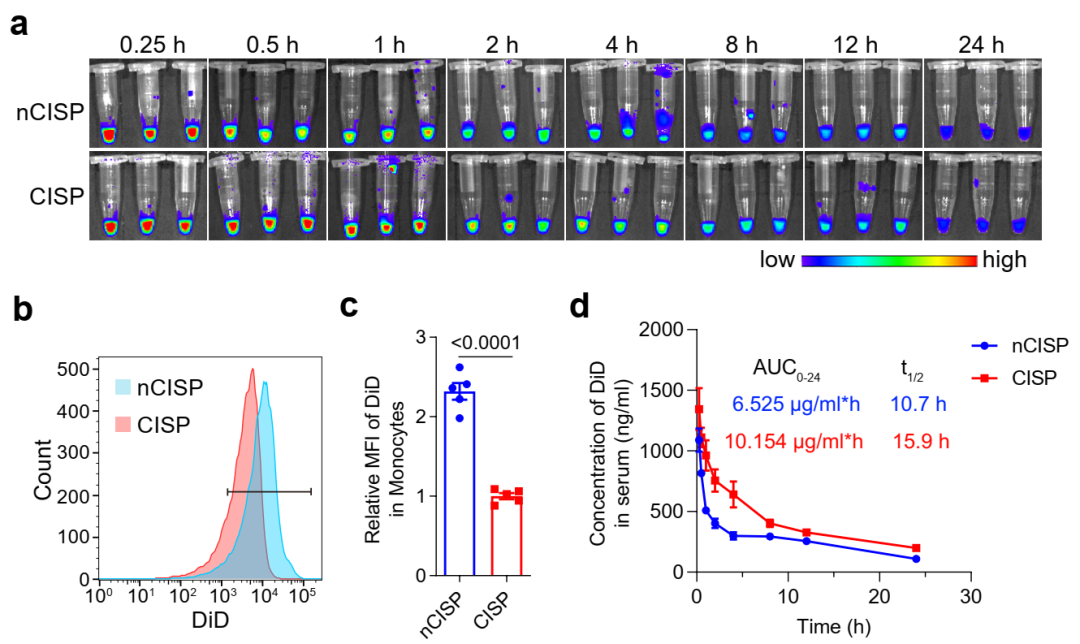
图3. CISP的血液循环规律
蛋白质组学和免疫荧光印记的结果表明细胞膜“减肥”后吸附的补体蛋白更少。用EDTA抑制补体活性则可显著减少血液单核细胞对细胞膜的摄取,存留于血浆中的制剂也更多。
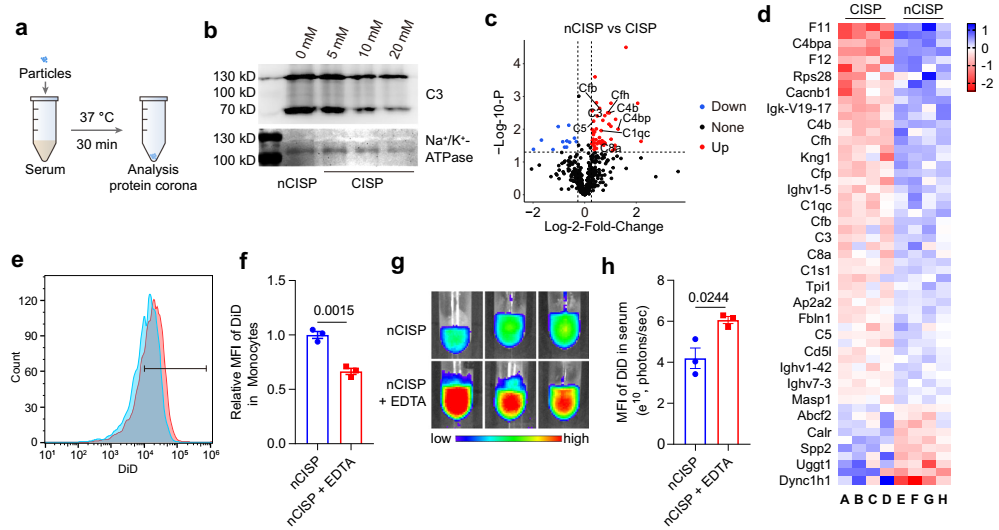
图4. CISP吸附的血浆蛋白
在小鼠黑色素瘤模型中,CISP经静脉注射和激光照射后,80 %的小鼠肿瘤消除且无复发;而在小鼠的结肠癌模型中,约40 %的小鼠在没有激光照射的情况下治愈;另外,CISP在小鼠肺癌和转移性黑色素瘤模型中也显示出显著疗效。
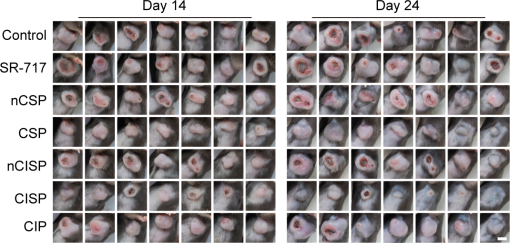
图5. CISP治疗结直肠癌的疗效
巨噬细胞膜被报道具有炎症靶向性,于是研究者采用巨噬细胞膜包裹PLGA纳米粒。普通巨噬细胞膜未能显著提升PLGA内核的关节炎靶向性,而“减肥”后的巨噬细胞膜则显示出良好的靶向性,说明该策略也适用于其它细胞膜。
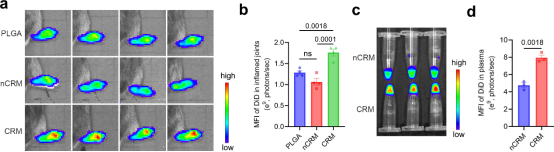
图6.“减肥策略”提高巨噬细胞膜的关节炎靶向性
综上,细胞膜“减肥”后可逃避机体免疫监视,避免血液吞噬细胞清除,同时保留细胞膜蛋白的靶向性。本研究开发了一种简单、有效、安全且广泛适用的细胞膜“减肥策略”,为解决纳米药物的脱靶难题提供了新思路。
相关工作近日以“Cholesterol removal improves performance of a model biomimetic system to co-deliver a photothermal agent and a STING agonist for cancer immunotherapy”为题在Nature Communications发表。论文第一作者为四川大学华西公共卫生学院的专职博后李林,四川大学高分子科学与工程学院的张凌研究员和华西公共卫生学院的刘振谧教授为论文的共同通讯作者,四川大学华西公共卫生学院(华西第四医院)为论文的第一通讯单位。团队得到了国家优秀青年科学基金项目(82022070)和区域创新发展联合基金(No: U20A20411)的支持。
原文链接:
https://www.nature.com/articles/s41467-023-40814-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








不错,学习了
59