Cell:曹雪涛组报道抗病毒免疫新机制附专家点评:
2017-07-28 BioArt BioArt
I型干扰素是目前临床用于治疗慢性乙型肝炎的常用药之一,然而其总体有效率较低,治疗效果亟待提高。因此,全面深入认识干扰素抗病毒效应的具体机制以寻找有效防治病毒感染的免疫措施具有重要意义。7月27日,曹雪涛院士研究团队在Cell杂志上发表了题为“Methyltransferase SETD2-Mediated Methylation of STAT1 Is Critical for Interfero
I型干扰素是目前临床用于治疗慢性乙型肝炎的常用药之一,然而其总体有效率较低,治疗效果亟待提高。因此,全面深入认识干扰素抗病毒效应的具体机制以寻找有效防治病毒感染的免疫措施具有重要意义。7月27日,曹雪涛院士研究团队在Cell杂志上发表了题为“Methyltransferase SETD2-Mediated Methylation of STAT1 Is Critical for Interferon Antiviral Activity”的研究论文,该研究报道了组蛋白甲基转移酶SETD2分子能够显着增强干扰素的抗病毒效应,从而促进机体对各类病毒的抵抗能力。该发现为机体抗病毒免疫的效应机制提出了新观点,也为有效防治病毒感染性疾病提供了新思路和潜在药物研发靶标。鉴于该工作的重要性,BioArt特别邀请到了中国科学技术大学朱书教授点评,以飨读者!
论文解读:
干扰素是机体抵抗病毒感染的关键性细胞因子,通过激活胞内JAK-STAT信号通路诱导一系列干扰素诱导性基因(IFN-stimulated genes ,ISGs)的表达,从而激活机体的抗病毒能力,为机体建立抵抗病毒感染、维持免疫稳态的重要防线【1】。干扰素信号调控异常与炎症性疾病、慢性感染性疾病发生发展等密切相关【2】。尽管IFNα诱导的信号通路在宿主抗病毒反应方面的重要作用已经认识的比较清楚,然而这一信号通路是如何被调控的,目前的研究并不是太多。此外,I型干扰素是目前临床用于治疗慢性乙型肝炎的常用药之一,然而其总体有效率较低,治疗效果亟待提高。因此,全面深入认识干扰素抗病毒效应的具体机制以寻找有效防治病毒感染的免疫措施具有重要意义。
近年来生物医学的一个研究热点是探究表观遗传学机制在众多生理病理过程中如何发挥重要调节作用。自2004年Danny Reinberg实验室在Nature上发表第一篇关于SET9介导p53蛋白甲基化调控其活性的文章以来【3】,非组蛋白甲基化(包含赖氨酸甲基化和精氨酸甲基化)修饰成为了近10多年来表观遗传领域的一个研究热点,目前已有上百个参与细胞内各个重要信号通路的蛋白被报道有甲基化修饰并且具有重要的调控功能【4】。
甲基转移酶通过调控组蛋白甲基化参与多种免疫应答过程与免疫性疾病的发生【5,6】,然而目前尚不清楚表观遗传酶分子如何直接调控细胞内信号转导蛋白质分子翻译后修饰机制及其在干扰素抗病毒免疫应答功能的具体作用。
在这项研究中,医学免疫学国家重点实验室主任曹雪涛院士与浙江大学医学院免疫学研究所博士生陈坤等发现组蛋白甲基转移酶SETD2分子能够直接催化干扰素下游信号蛋白分子STAT1的甲基化,从而增强干扰素效应信号,促进机体的抗病毒免疫功能。
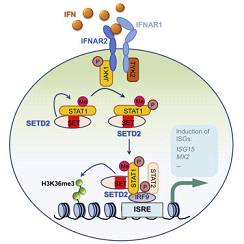
研究团队通过高通量RNA干扰筛选体系筛选了目前已报道的700余种表观遗传修饰相关基因,发现组蛋白甲基转移酶SETD2分子表达对于干扰素抵抗乙型肝炎病毒HB效应V的发挥至关重要。通过制备肝细胞中特异性敲除SETD2基因的小鼠模型体内实验,证实SETD2能显着增强干扰素抑制HBV体内复制的效应。机制研究表明,SETD2分子通过其SET结构域发挥甲基转移酶活性,直接催化信号蛋白STAT1的第525位赖氨酸发生单甲基化修饰(STAT1-K525me1),从而促进干扰素效应信号的活化(下图)。此外,SETD2还可以选择性地催化干扰素诱导性基因远端启动子区发生组蛋白H3K36me3的修饰,从而直接促进这些具有抗病毒作用基因的转录活化和表达。SETD2在促进干扰素基因的表达方面真可谓是一箭双雕。
总的来说,该研究揭示了甲基转移酶SETD2分子在促进干扰素抗病毒效应中的重要功能,为临床上研发新的抗病毒药物提供了潜在的研究靶标。该工作进一步完善了干扰素效应信号的调控网络,揭示了SETD2分子直接催化信号蛋白STAT1甲基化修饰的新机制,为免疫调控机制的研究提供了新的思路。
后记:曹雪涛院士实验室近年来在表观遗传与免疫调控方面做出了大量出色的工作,例如2013年在Immunity杂志上报道组蛋白甲基转移酶Ash1l通过诱导泛素编辑酶A20抑制了IL-6生成及炎症性自身免疫疾病【7】;2015年发表在Nature上的论文揭示了DNA去甲基化酶TET2可以通过招募组蛋白去乙酰转移酶HDAC2特异性抑制IL-6来消退炎症【8】;2016年在Nature Immunology杂志上报道DNA甲基化酶Dnmt3a能促进天然免疫细胞释放I型干扰素以抵御病毒感染【9】等。此外,曹雪涛院士还受邀发表了多篇有关综述【5,10】,可以说曹院士表观遗传与免疫调控领域的系列研究走在了国内外同行前列。
专家点评:
Comments:全世界范围内因HBV感染而导致的乙肝患者超过3.5亿,其中约1/3在中国。目前在临床上IFNα被用来治疗慢性乙肝,然而IFNα疗法仅对一小部分慢性乙肝患者有效。因此,阐明IFNα介导的抗HBV感染的免疫调控机制,对于提高针对慢性乙肝的IFNα疗效有着十分重要的意义。7月27日,曹雪涛团队在最新的一期Cell杂志上发表了题为“Methyltransferase SETD2-Mediated Methylation of STAT1 Is Critical for Interferon Antiviral activity”的研究论文。该研究团队发现甲基转移酶SETD2能够甲基化修饰IFNα信号通路中的关键蛋白STAT1。通过直接对STAT1 的K525位点进行甲基化修饰,SETD2能够稳固IFNα刺激下STAT1的磷酸化状态,从而增强IFNα信号介导的的抗HBV感染作用。该工作为HBV以及其他病毒感染性疾病的干预和治疗提供了新的靶点和思路.
HBV影响了全球超过3.5亿的乙肝患者,其中1/3的患者在中国。除了接种乙肝疫苗,目前临床上还使用IFNα来治疗慢性乙肝,然而IFNα疗法只对一小部分慢性乙肝患者有效果。值得一提的是,IFNα的抗HBV感染作用主要是通过激活IFNα信号通路而进一步诱导表达下游的ISGs(IFN-stimulated genes)实现的。因此,阐明IFNα信号通路的调控机制,进而提高针对慢性乙肝的IFNα疗效,有着十分重要的临床意义。然而对于IFNα信号通路的调控,尤其是IFNα介导的STAT信号以及ISGs的表达调控,仍有很多未知的地方。
为了阐明HBV感染情况下IFNα信号通路的调控机制,曹雪涛院士团队首先成功构建了感染HBV的HepG2.2.15细胞系。借助于构建好的HBV感染细胞模型,曹雪涛院士团队对包含有711个已知的表观调控分子的siRNA库进行了一次高通量筛选,发现了STAT1甲基化修饰的调控元件SETD2是干扰素通路的一个增强子。肝脏细胞特异性缺失SETD2的小鼠对HBV感染的抵抗力明显减弱。进一步深入的研究发现SETD2能够直接对STAT1 的K525位点进行甲基化修饰,稳固IFNα刺激情况下STAT1的磷酸化水平,从而增强IFN的抗HBV感染能力。值得一提的是,如果能构建STAT1 K525 mutant mice来验证STAT1的该处修饰对于其功能的重要作用将会非常有意义。此外,曹雪涛院士团队还发现SETD2能够选择性催化下游一些特定的ISGs(如ISG15)启动子区域H3K36 tri-methylation,很好的解释了SETD2为什么能够选择性调控一些特定ISGs的基因表达。曹雪涛院士团队的工作首次发现了STAT1的甲基化修饰的调控元件SETD2,找到了STAT1的甲基化修饰位点(K525),进一步阐释了病毒感染情况下IFNα信号通路的调控机制。该工作为其他基因的表观修饰研究和信号通路的调控研究提供了很好的借鉴。
基因的表观修饰对于基因的功能有着十分重要的影响。当前也有多项靶向表观遗传修饰分子的研究进入到临床实验当中。Methyltransferase也成为当前肿瘤和感染领域热门的靶点。比如靶向histone methyltransferases DOT1L和EZH2治疗多种肿瘤已经已经进入临床研究;靶向histone methyltransferases Suv39H1, G9a,EZH2或者DNA methyltransferases DNMTI在HIV治疗中也被用来激活 HIV latent reservoir来实现“Kick and kill”。曹雪涛院士团队的工作为靶向Methyltransferase增强IFNα信号通路治疗HBV提供了新的理论基础和思路,具有很高的理论和应用价值。
原始出处:
[1]Schneider, W. M., Chevillotte, M. D., & Rice, C. M. (2014). Interferon-stimulated genes: a complex web of host defenses. Annual review of immunology, 32, 513-545.
[2]McNab, F., Mayer-Barber, K., Sher, A., Wack, A., & O'garra, A. (2015). Type I interferons in infectious disease. Nature Reviews Immunology, 15(2), 87-103.
[3]Chuikov, Sergei, et al. "Regulation of p53 activity through lysine methylation." Nature 432.7015 (2004): 353.
[4]Biggar, K. K., & Li, S. S. (2015). Non-histone protein methylation as a regulator of cellular signalling and function. Nature reviews. Molecular cell biology, 16(1), 5.
[5]Liu, J., Qian, C., & Cao, X. (2016). Post-translational modification control of innate immunity. Immunity, 45(1), 15-30.
[6]Mowen, K. A., & David, M. (2014). Unconventional post-translational modifications in immunological signaling. Nature immunology, 15(6), 512-520.
[7]Xia, M., Liu, J., Wu, X., Liu, S., Li, G., Han, C., ... & Cao, X. (2013). Histone methyltransferase Ash1l suppresses interleukin-6 production and inflammatory autoimmune diseases by inducing the ubiquitin-editing enzyme A20. Immunity, 39(3), 470-481.
[8]Zhang, Q., Zhao, K., Shen, Q., Han, Y., Gu, Y., Li, X., & Cao, X. (2015). Tet2 is required to resolve inflammation by recruiting Hdac2 to specifically repress IL-6. Nature, 525(7569), 389.
[9]Li, X., Zhang, Q., Ding, Y., Liu, Y., Zhao, D., Zhao, K., & Cao, X. (2016). Methyltransferase Dnmt3a upregulates HDAC9 to deacetylate the kinase TBK1 for activation of antiviral innate immunity. Nature immunology, 17(7), 806-815.
[10]Bao, Y., & Cao, X. (2016). Epigenetic control of B cell development and B-cell-related immune disorders. Clinical reviews in allergy & immunology, 50(3), 301-311.
[11]Kun Chen, Juan Liu, Shuxun Liu,et al.Methyltransferase SETD2-Mediated Methylation of STAT1 Is Critical for Interferon Antiviral Activity.Cell.Volume 170, Issue 3, p492–506.e14, 27 July 2017.DOI: http://dx.doi.org/10.1016/j.cell.2017.06.042
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Cell#
71
#CEL#
0
#抗病毒#
83
#曹雪涛#
70
谢谢分享,很不错。
90
学习了新知识
102
曹院士的团队就是牛啊
115
学习学习学习
104
慢慢揭开生命的奥秘
92