CELLULAR ONCOLOGY:高plex空间转录组分析揭示了不匹配修复缺陷子宫内膜癌的理化性质
2023-10-24 Jenny Ou MedSci原创 发表于上海
本研究证实了MMRd-ECs中的异质TME状态,并表明这些EC可以根据病理环境中的潜在生物标志物(如HLA I类、DNMT3A和CD8)进行分层,以提高该子集患者的ICI治疗效果。
子宫内膜癌(EC)作为主要的妇科恶性肿瘤之一,每年新增病例超过417,000例。虽然大多数患者预后良好,但复发性疾病有几个已知的因素,如组织学类型和等级。临床标本的深入多组学分析揭示了不同的分子亚型,即由DNA聚合酶epsilon突变(POLEm)、不匹配修复蛋白缺乏症(MMRd)/微卫星不稳定性(MSI)、拷贝数低和拷贝数高定义的四个主要群体。
随访研究揭示了分子分层亚组的预后价值,高拷贝数患者表现出令人沮丧的无进展生存率和癌症特异性生存率,而POROM组表现出最佳结果。

尽管累积证据强调了分子分类在EC中的重要性,但对其MMRd/MSI状态知之甚少,其与肿瘤微环境(TME)相关的杂项性质更广。DNA不匹配修复(MMR)系统在保持遗传保真度方面发挥着重要作用,而这种途径的缺陷会增加患多种癌症的风险。因此,带有MMRd的肿瘤的特点是广泛的MSI和高突变负担,使它们更具免疫遗传性,并可能对抗PD-1/PD-L1免疫治疗产生反应。
然而,尽管新抗原负荷很高,但MMRd患者对免疫检查点抑制剂(ICIs)表现出不同的反应,超过一半的人对这种治疗有抗药性。对EC的重点研究报告了类似的发现。基于机制的研究揭示了MSI程度与其对抗PD-1免疫治疗的影响之间的真正关系。然而,在用彭布罗利珠单抗治疗的MMRd癌症中,响应者和非响应者之间肿瘤非同义突变的数量没有显著差异。这些观察表明,除了多突变介导的新抗原外,MMRd肿瘤中的其他因素可能在对免疫检查点抑制剂(ICIs)的敏感性方面发挥作用。
更重要的是,EC中TME的动态调节尚未完全建立。值得注意的是,大量的研究已经证明了TME中预先存在的CD8 + T细胞对有效ICI干预的重要性,缺乏T细胞浸润会使MMRd肿瘤对这种治疗不敏感。由于MMRd肿瘤的子集显示低密度的肿瘤浸润淋巴细胞(TILs),这些高度突变的肿瘤可能在TME内存在失调的途径,导致T细胞在围瘁期间保留。
最近,Vasaikaikar报告了MSI-H结肠癌中糖酵解活性与CD8 + T细胞浸润之间的负相关性,而Lu的团队证明,MMRd肿瘤中cGAS-STING途径的缺乏会显著减少CD8 + T细胞浸润,这表明可能的潜在机制可以促进肿瘤的发生和高突变负担。尽管如此,MMRd-EC中解决与MMRd肿瘤中T细胞浸润相关的关键机制的证据仍然很少,这可能有助于识别ICI的预测生物标志物,以及设计新策略来克服该亚组EC的治疗耐药性。
本文应用了高复杂空间生物学发现工具数字空间分析器(DSP)来获得MMRd-EC的高分辨率TME转录配置文件。通过对45名MMRd-EC患者的1800多个关键肿瘤免疫相关基因的全面分析,我们在肿瘤特异性区域中发现了一个14个基因特征,根据肿瘤独特的免疫活性和CD8 + T细胞浸润,将肿瘤分为“热”、“中”和“冷”组。
使用独立临床队列的额外验证证实了HLA I类基因和DNMT3A之间的密切潜在联系,这可能可以预测对抗PD-1/PD-L1治疗的反应。2023年10月17日发表在CELLULAR ONCOLOGY的文章,阐明了MMRd-EC现有的患者间异质性,并通过HLA I/DNMT3A类表达与CD8 + T细胞浸润状态之间的动态关联发现了关键组件。这些分子可能具有生物标志物潜力,可以对MMRd-EC患者进行分层,并识别那些可能从ICI治疗中受益的人。
本文应用了数字空间特征分析,一种覆盖1800多个基因的高复位空间转录方法,在45名MMRd-EC患者中获得了高度分辨的TME景观。本文使用免疫组织化学和多路复用免疫荧光识别的多个生物标志物,使用总共123名MMRd-EC患者的研究型和独立队列进行了交叉验证,并使用微卫星不稳定子宫内膜癌(MSI-EC)患者的外部TCGA数据验证了本文的发现。
研究结果显示,高层空间剖面在MMRd肿瘤富集区中确定了14个基因特征,根据其不同的免疫特征将肿瘤分层为“热”、“中间”和“冷”组,这一发现与相应的CD8 + T细胞浸润状态高度一致。我们的验证研究进一步证实了涉及HLA I类和DNMT3A的现有核心控制网络,该网络可能通过包含CCL5的动态串扰进行桥接。
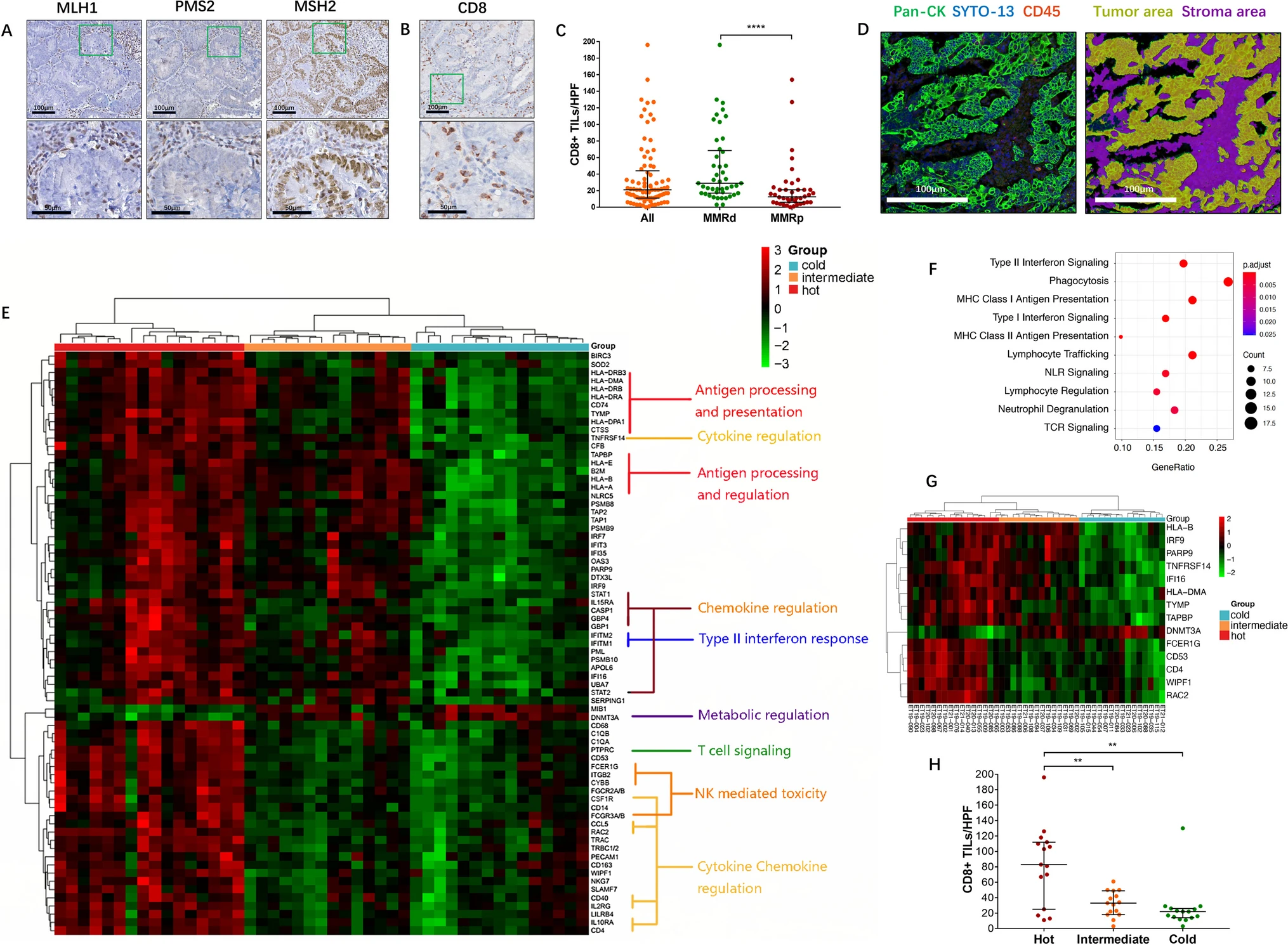
MMRd ECs的DSP空间转录组分析
综上所述,本文的全面空间分析解决了MMRd-ECs的病人间异质性,强调了一种对ICI治疗具有临床重要性的合理患者分层方法。基因签名和MHC I类和CD8 IHC可以用作生物标志物来选择ICI治疗的候选者。此外,解构MMRd-EC中HLA类I/DNMT3A/CD8 T细胞调制的基本机制将加速生物标志物翻译和高级EC的组合治疗方案的开发。
原文出处
Guo, J., Tang, B., Fu, J. et al. High-plex spatial transcriptomic profiling reveals distinct immune components and the HLA class I/DNMT3A/CD8 modulatory axis in mismatch repair-deficient endometrial cancer. Cell Oncol. (2023). https://doi.org/10.1007/s13402-023-00885-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言