CCR:AACR GENIE数据库中1407例超罕见肉瘤,约1/4检出潜在可干预基因变异
2024-03-21 苏州绘真医学 苏州绘真医学 发表于上海
本研究分析了1407份软组织和骨URS样本的基因组测序,发现相当一部分URS携带有可能在临床上采取治疗措施的突变。

超罕见肉瘤(URS)是一组每年发病率≤1/100万的罕见疾病。本研究的目的是评估URS中具有临床指导意义的基因组变异。使用cBioPortal从GENIE数据库中提取数据。OncoKB用于评估突变的临床可干预性。肿瘤突变负荷(TMB)由临床测序数据推测。
软组织(ST)URS占ST肉瘤的23.5%,骨URS占骨肉瘤的16.5%。4组中最常见的突变基因均为TP53。最常见的融合涉及EWSR1。最常见的拷贝数变异包括CDKN2A和CDKN2B缺失以及MDM2和CDK4扩增。所有四类肉瘤的TMB普遍较低,但有相当大的异质性,3.8%的ST URS和0.55%的骨URS具有高TMB。研究者发现,1级变异(FDA认可的生物标志物,可预测对FDA批准药物的反应)在ST URS中的发生率为10.0%,而在ST非URS、骨URS和骨非URS中的发生率分别为7.1%、1.1%和4.5%。1-3级变异(也包括预测标准治疗药物或临床证据支持药物反应的生物标志物)见于27.8%的ST URS、25.2%的ST非URS、20.9%的骨URS和17.4%的骨非URS。
URS很难在复发或转移的情况下进行治疗,这主要是由于其罕见性和缺乏循证治疗。本研究分析了1407份软组织和骨URS样本的基因组测序,发现相当一部分URS携带有可能在临床上采取治疗措施的突变。虽然肉瘤的TMB通常较低,但有些肉瘤的TMB较高,可能从免疫治疗中获益。晚期URS的基因组测序有可能指导相当一部分URS患者的治疗。因此,本研究建议对所有晚期URS病例进行基因组测序,以识别潜在可干预的变异。
研究背景
肉瘤是一种起源于结缔组织的相对罕见的癌症类型,但这种癌症类型是一组异质性疾病,迄今已确定了近100种不同的组织学亚型。超罕见肉瘤(URS)定义为发病率≤1/100万人/年的肉瘤亚型。根据发病率≤1/100万人/年的标准,56种软组织(ST)和21种骨URS肉瘤被定义为URS。URS占肉瘤的20%,然而,目前批准的针对组织学的治疗方法很少。这些肉瘤类型的罕见并不利于各癌症中心积累丰富的经验。这一点,加上对这些肉瘤类型的病理生物学的研究有限,阻碍了用于治疗这些罕见肉瘤的新药的开发和批准。最近,少许药物被FDA专门批准用于部分URS:EZH2抑制剂他泽司他(tazemetostat)用于SMARCB1缺失的上皮样肉瘤,西罗莫司白蛋白结合型纳米颗粒(nab-sirolimus)用于血管周上皮样肿瘤(PEComas),阿替利珠单抗(atezolizumab)用于肺泡性软组织肉瘤,克唑替尼(crizotinib)用于炎性肌纤维母细胞瘤。除了这些肿瘤特异性药物之外,NTRK、BRAF或RET抑制剂等组织未知型药物也可能使具有适当基因组特征的URS患者获益。除了这几种URS药物之外,大多数URS在肉瘤临床试验中作为一个组被一起治疗。认识这些罕见肿瘤群体面临着特殊的挑战,了解潜在的生物标志物可能有助于未来的治疗开发。
来自多个大规模肉瘤临床测序工作的越来越多证据正在帮助发现可能具有指导意义的基因组变异。在某些情况下,测序可帮助完善甚至重新分类诊断。例如,小蓝圆细胞肿瘤通常根据某些融合(如CIC-DUX4融合)的存在进行重新分类,CIC-DUX4融合现在定义了一类型URS。在某些情况下,测序数据可以帮助指导治疗,包括原本可能不会考虑的治疗。例如,较高的TMB预测对免疫检查点抑制剂的应答,而肉瘤的TMB一般较低,但存在明显的异质性,这提示存在一些TMB较高的肉瘤亚群,它们可能对免疫治疗有应答。最近,一项单一机构研究的结果表明,在1期试验中,在URS中进行基因组选择有助于确定可能从靶向治疗中获益的分子亚群。
本研究从AACR GENIE数据库中探索了ST和骨URS中可能具有指导意义的基因组变异,并在大约1/4的URS病例中发现了潜在可干预的基因组变异。
研究方法
根据结缔组织肿瘤学会共识声明的定义,URS定义为发病率≤1/100万人/年的肉瘤类型。肉瘤亚型分为ST URS、ST非URS、骨URS和骨非URS。以下分子定义的肉瘤被重新分类为ST URS或骨URS:CIC重排肉瘤、有EWSR1-non-ETS融合的圆细胞肉瘤、有BCOR变异的肉瘤和NTRK重排的梭形细胞肉瘤。子宫PEComa合并PEComa。近端型上皮样肉瘤合并上皮样肉瘤。常规脊索瘤合并脊索瘤。非特指(NOS)肉瘤,除可根据分子分型(例如CIC、BCOR、EWSR1-non-ETS和NTRK融合)分类的病例外,其他病例均被归类为ST非URS。
研究结果
URS在GENIE数据集中的分布:
在GENIE数据库中所有肉瘤亚型的6313例患者中,ST肉瘤有5211例(82.5%),骨肉瘤有1102例(17.5%)。5211例ST肉瘤中,1225例为ST URS(23.5%),3986例为ST非URS(76.5%;图1A和B)。在1102例骨肉瘤中,182例为骨URS(16.5%),920例为骨非URS(83.5%)。这与以前报道的URS约占肉瘤的20%相似。最常见的ST URS为促纤维组织增生性小圆细胞肿瘤(118/1225=9.6%),最常见的ST非URS为平滑肌肉瘤(622/3986=15.6%),最常见的骨URS为传统脊索瘤(98/182=53.9%),最常见的骨非URS为骨肉瘤(362/920=39.3%;图1C和D)。
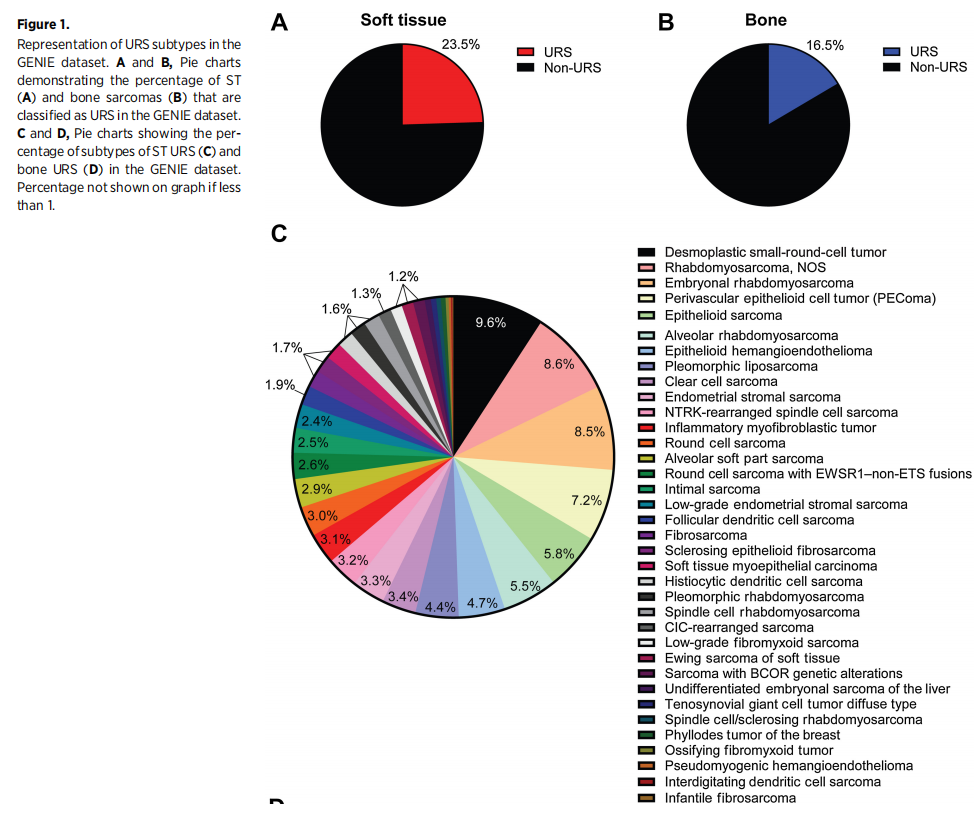
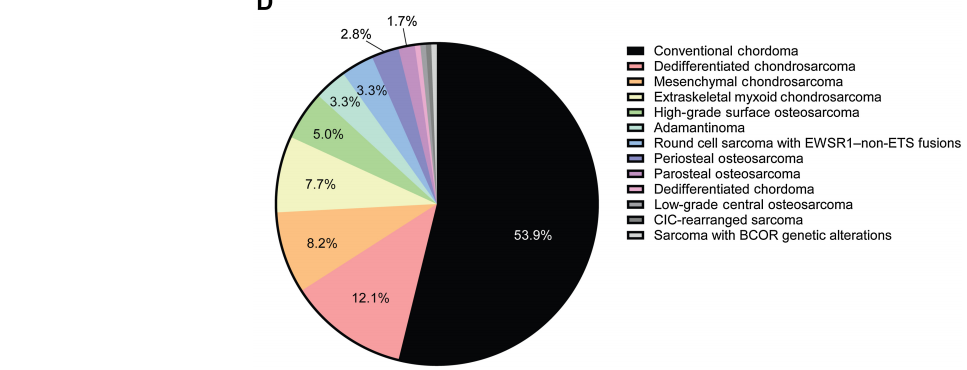
图1
URS中最常见的突变:
研究分析了GENIE数据库中肉瘤中最常见的基因组变异。在所有四组中最常见的突变基因是TP53, TP53是基因组稳定性的关键调节因子,其中ST非URS的TP53突变比例最高(806/2996=26.9%;图2A)。在TP53突变肿瘤中,26例(占TP53突变肉瘤的1.5%,占所有肉瘤的0.4%)的突变位点为Y220C,目前有一种相应的分子靶向药物正在研究中。
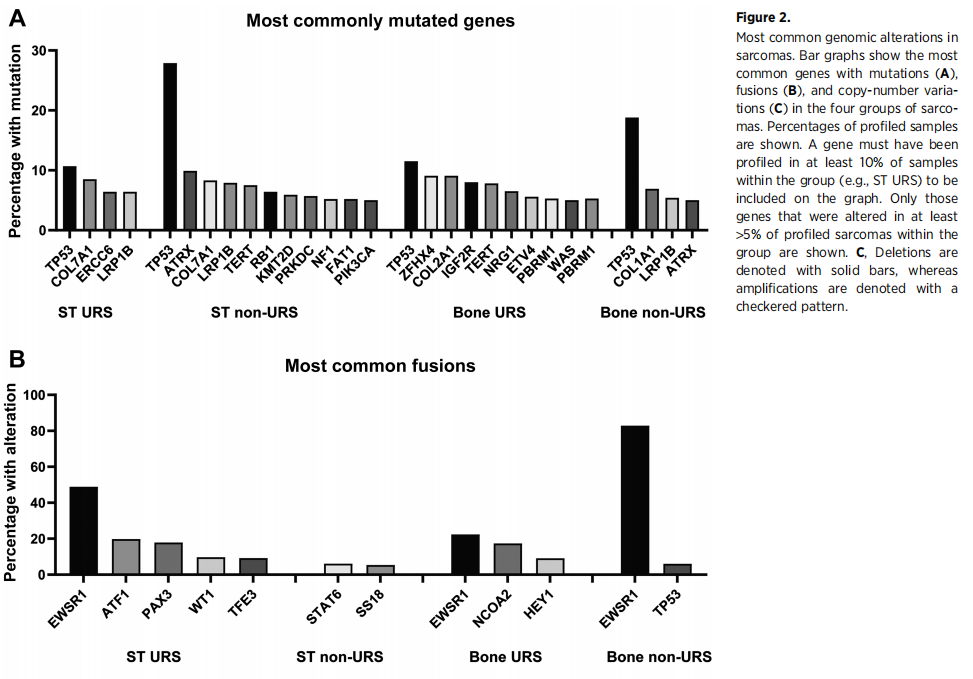
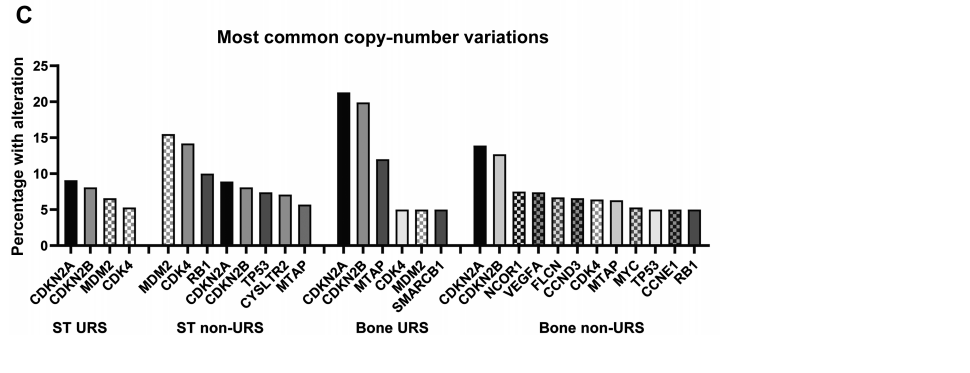
图2
AACR GENIE数据库中的融合:
由于许多肉瘤由融合驱动,研究还分析了AACR GENIE数据库中的融合。在8.3%(102/1225)的ST URS中发现了潜在临床上可干预的融合(OncoKB 1-4级),但在骨URS中较少见(3/18=1.7%)。1.6%(20/1225)的ST URS患者存在可干预ALK融合,2.7%(33/1225)的URS患者存在可干预NTRK1-3融合。值得注意的是,NTRK融合的病例通常被归类为“肉瘤,NOS”,但也有一些被归类为脂肪肉瘤(占NTRK融合病例的16.1%)、子宫肉瘤(16.1%)、血管肉瘤(6.5%)和骨肉瘤(6.5%)等。URS中观察到的其他潜在可干预的激酶基因融合包括ROS1(ST URS中7/1225-0.57%)、FGFR1(3/1225=0.24%)和BRAF(2/1225=0.16%)。
最常见的融合涉及EWSR1,见于16.1%(198/1225)的ST URS、0.83%(33/3979)的ST非URS、7.7%(14/182)的骨URS和22.4%(205/917)的骨非URS(图2B)。最常见的融合伴侣是FLI1(40.0%)、WT1(22.0%)、ATF1(6.1%)、ERG(5.1%)、CREB3L1(3.2%)、NR4A3(2.4%)、CREB1(1.8%)和DDIT3(1.2%)。EWSR1-ETS(即涉及ETS家族成员FLI1)是尤因肉瘤的诊断融合。在ST URS中,最常见的融合伴侣是WT1(占EWSR1融合的50.9%),这是促结缔组织增生性小圆细胞肿瘤的特征性表现。在骨URS中,最常见的融合伴侣为NR4A3(占EWSR1融合骨URS的62.5%),是骨外黏液样软骨肉瘤的特征。EWSR1融合的共变异见于TERT(在有EWSR1融合的肿瘤中占6.5%)和ARID1A(4.9%)。除了EWSR1融合,ST URS中报道的其他融合涉及FOXO1和多个融合伴侣(最常见的是PAX3和PAX7(主要见于腺泡状横纹肌肉瘤)),TFE3和最常见的融合伴侣ASPSCR1(主要见于腺泡状软组织肉瘤)。在FOXO1融合中,最常见的共变异是MYCN扩增(27.3%)、CDK4扩增(13.6%)以及HELQ(18.2%)、FAT1(12.5%)、ROS1(11.4%)和TET1(10.0%)突变。在TFE3融合中,最常见的共变异是CDKN2A缺失(8.7%)和ARAF(11.1%)、NTRK3 (11.1%)突变。在骨URS中,其他融合为NCOA2-HEY1(间叶性软骨肉瘤的特征),未见明显的共突变或变异。
URS中最常见的拷贝数变异:
最常见的拷贝数变异包括细胞周期调节因子CDKN2A和CDKN2B的缺失,以及MDM2和CDK4的扩增(图2C)。在ST非URS组中,最常见的事件是MDM2和CDK4扩增,这在高分化和去分化脂肪肉瘤中普遍存在。这些扩增显著同时出现(MDM2扩增的患者中86.6%同时存在CDK4扩增,CDK4扩增的患者中89.2%同时存在MDM2扩增;P<0.001)。同时伴有MDM2和CDK4扩增的肿瘤多为脂肪肉瘤。但也有少数其他类型的肉瘤,包括NOS肉瘤26例、骨肉瘤26例、内膜肉瘤16例、平滑肌肉瘤8例、子宫腺肉瘤6例、横纹肌肉瘤5例、子宫内膜间质肉瘤5例,以及少量其他亚型。仅观察URS,4.0%(49/1225)的ST URS和3.8%(7/182)的骨URS同时存在MDM2和CDK4扩增。
在同时进行TP53和RB1分析的所有肉瘤中,有9.1%(161/1769)的肉瘤同时存在TP53和RB1突变(69.5%的TP53突变病例同时存在RB1突变,72.2%的RB1突变病例同时存在TP53突变),显示出显著的共发生性(P<0.001)。
URS中的TMB:
TMB是指通过肿瘤DNA测序评估的每兆碱基的突变数量。较高的TMB与对免疫检查点抑制剂的应答相关。抗PD-1抗体帕博利珠单抗已被批准用于治疗高TMB的不可切除或转移性实体瘤成人和儿童患者,并且在之前的治疗后发生进展,没有令人满意的替代治疗方案,根据FDA批准的检测结果,高TMB的定义为≥10个突变/兆碱基(10 mut/Mb)。研究分析了GENIE中肉瘤的TMB。与之前的报道一致,尽管存在明显的异质性,但所有四组肉瘤的TMB总体均较低(图3A)。ST URS的中位TMB为1.39mut/Mb, ST非URS的中位TMB为2.15mut/Mb,骨URS的中位TMB为1.07mut/Mb,骨非URS的中位TMB为1.21mut/Mb。ST URS组、ST非URS组、骨URS组和骨非URS组的平均TMB(±95%CI)分别为14.36±11.31、26.77±13.61、1.85±0.52和12.79±15.70。1224例ST URS患者中有46例(3.8%),ST非URS患者中有6.7%(267/3979),骨URS患者中有0.55%(1/182),骨非URS患者中有4.4%(40/917)被归类为TMB-H,定义为至少10mut/Mb(图3B)。四组间TMB无显著差异。
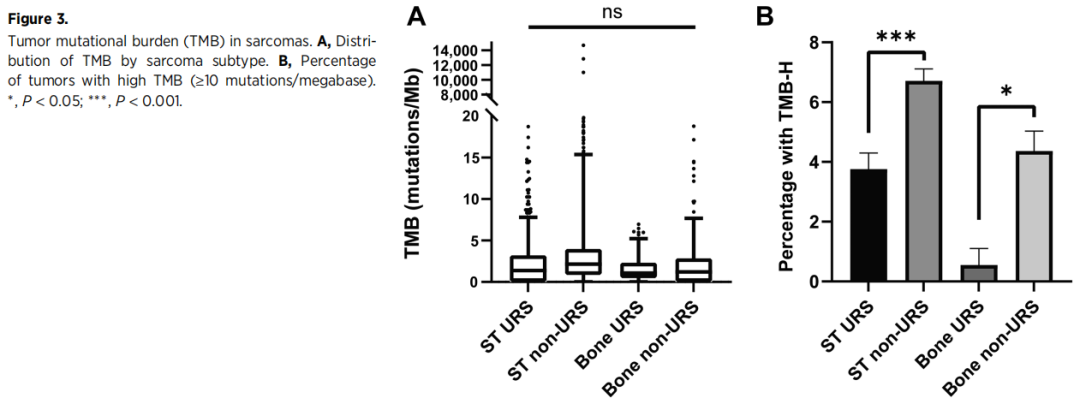
图3
普遍的临床可干预变异和OncoKB级别:
OncoKB用于注释突变、融合和拷贝数变异(表1)。1级变异是一种FDA认可的生物标志物,可预测对FDA批准药物的应答。2级变异是NCCN或其他专业组织推荐的生物标志物,可预测对FDA批准药物的应答。3A级变异是指有令人信服的临床证据支持该变异可预测对药物的应答。3B级变异是指预测用于其他适应证(通常是不同类型的肿瘤)的FDA批准或者正在试验药物反应的变异。4级变异是指有令人信服的生物学证据表明可预测对药物的反应。ST URS的1级变异比例(124/1225=10.0%)高于ST非URS(283/3986=7.1%)、骨URS(2/182=0.55%)和骨非URS(41/920=4.5%)。这主要是由涉及ALK、NTRK基因(NTRK1、NTRK2和NTRK3)的融合和TMB-H所驱动。2级变异最常见于骨非URS(41/920=4.5%),主要由IDH1突变驱动,而IDH1突变在软骨肉瘤中普遍存在。3A级变异不常见。ST URS组、ST非URS组、骨URS组和骨非URS组的3B级变异比例分别为16.1%(197/1225)、17.7%(707/986)、19.8%(36/182)和8.4%(77/920)。ST URS组、ST非URS组、骨URS组和骨非URS组的4级变异检出率分别为18.5%(226/1225)、49.4%(1986)、23.1%(42/182)和37.3%(343/920)。
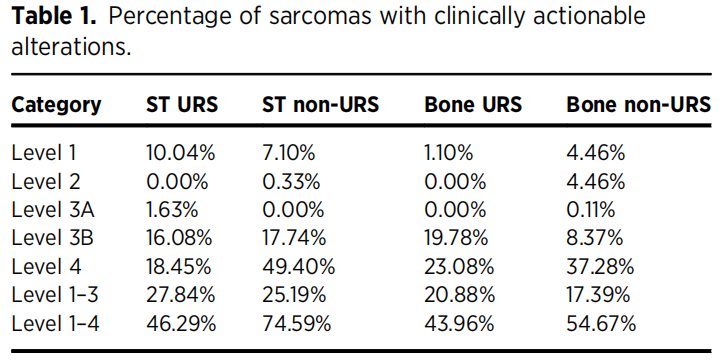
表1
综上所述,27.8%(341/1225)的ST URS、25.2%(1004/3986)的ST非URS、20.9%(38/182)的骨URS和17.4%(160/920)的骨非URS发生了1-3级变异(图4A)。46.3%(567/1225)的ST URS、74.6%(2973/3986)的ST非URS、44.0%(80/182)的骨URS和54.7%(503/920)的骨非URS存在1-4级变异(图4B)。可干预变异的发生率因亚型而有很大差异(图4C)。
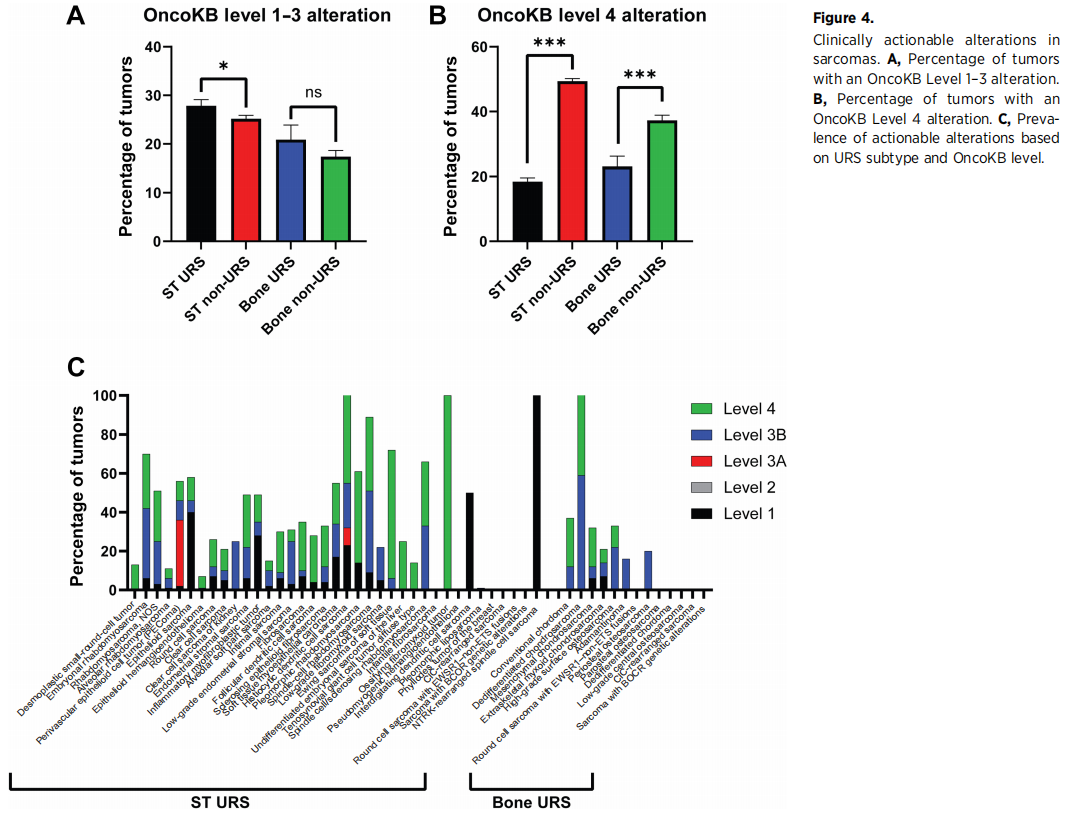
图4
肉瘤中最常见的变异通路之一是DNA损伤修复。DNA损伤修复相关基因(即同源重组修复通路基因BRCA1、BRCA2、PALB2和RAD51及其同源基因RAD51B、RAD51D、RAD52和RAD54L)变异见于8%的肉瘤。其中包括6%的ST URS,9%的ST非URS,3%的骨URS,5%的骨非URS。
种族和基因组变异:
在GENIE数据集中,69.9%的肉瘤标本来自白种人患者,6.8%来自黑种人患者,6.3%来自亚洲患者,0.3%来自美国原住民或太平洋岛民患者,16.7%来自未知或其他。通过比较、监测、流行病学和最终结果数据表明,64%的肉瘤患者为非西班牙语裔白种人,12%为非西班牙语裔黑种人,16%为西班牙语裔,9%为美国印第安人、阿拉斯加原住民或亚太岛民。
基因组分析使URS临床获益:
为了探讨接受NGS的URS患者的临床获益,研究介绍了几个转移性URS患者的病例,在这些病例中,NGS的使用改变了这些患者的治疗,并产生了显著的临床获益。病例1,一名27岁的女性透明细胞肉瘤患者发生了骨、肺和肝转移。基因组分析揭示了EWSR1-CREB1融合,已知该融合通过诱导转录因子MITF激活MET通路,而MITF直接激活MET的转录。MET抑制剂克唑替尼已被证明对EWSR1-CREB1融合的肉瘤有活性。该患者参加了一项克唑替尼联合帕唑帕尼的试验(clinicaltrials.gov NCT01548144),并获得了超过48个周期的RECIST部分缓解的临床获益(图5A)。病例2,一名42岁的上皮样肉瘤女性患者在多个部位复发,并被发现携带SMARCB1/INI1的特征性缺失和SMARC4的致病性突变。该患者接受了实验性EED/EZH2通路抑制剂治疗。EZH2和EED都是PRC2复合体的组成部分,PRC2复合体是一种转录抑制复合体,催化组蛋白H3K27位点的甲基化。在过去的3年里,患者继续接受这种治疗(图5B)。病例3,一名患未分类梭形细胞肉瘤的56岁女性患者在接受标准化疗后出现疾病进展。患者的肿瘤被发现携带KIAA1549-BRAF融合和PTEN缺失。患者接受了替西罗莫司(治疗PTEN缺失)+索拉非尼(PTEN缺失)+贝伐珠单抗(治疗双重VEGF阻断)治疗9个月,直到患者死亡。病例4,一名患者初始诊断为STUMP(恶性潜能不确定的平滑肌肿瘤),发现aDCTN1-ALK融合,并接受ALK抑制剂克唑替尼联合帕唑帕尼治疗获得部分缓解。在普拉替尼治疗RET融合阳性癌症的泛癌ARROW试验中,一名60多岁的恶性间叶肉瘤患者最初被诊断为色素绒毛结节性滑膜炎,但伊马替尼治疗无效。二代测序结果显示RET-CCDC6融合。该患者被纳入了普拉塞替尼RET抑制剂临床试验,并在报告时达到了完全缓解。

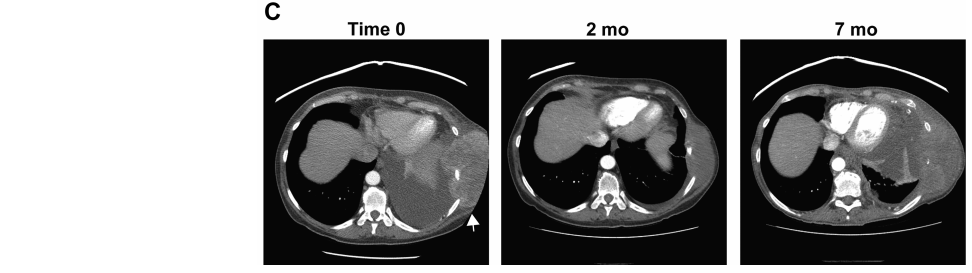
图5
除了观察到这些临床获益的URS病例之外,研究者最近在MD Anderson 1期临床试验单位探索了URS 基于NGS的临床获益。在106例URS患者中,在接受分子匹配治疗的患者中,24%(8/33)达到客观缓解,而在一项不匹配的1期试验中,只有8.2%(6/73)的患者达到了客观缓解(P=0.024)。
讨 论
URS是一种罕见的疾病,其最高水平的数据通常来自轶事病例报告和病例系列。非常需要了解URS的病理生理学,从而为这些罕见疾病开发新的治疗策略。了解这些疾病的基因组基础是治疗这些疾病的一种方法。在这项研究中,对GENIE数据库(一个大型多机构公开访问的真实世界患者数据登记系统)中的临床测序所做的分析显示,相当大一部分URS发生了可干预的变异。研究发现OncoKB 1-3级变异在ST URS组、ST非URS组、骨URS组和骨非URS组的发生率分别为27.8%、25.2%、20.9%和17.4%,OncoKB 1-4级变异在ST URS组、ST非URS组、骨URS组和骨非URS组的发生率分别为46.3%、74.6%、44.0%和54.7%。这与之前的报道相当,之前的报道表明,30%-60%的ST肉瘤有潜在的可干预变异,约30%的ST肉瘤发生了获得批准的说明书或说明书外药物相关变异,不同肉瘤亚型之间有相当大的差异。与骨URS相比,ST URS中更常见致癌性和可作为治疗靶点的变异。此外,与非URS患者相比,OncoKB 1-3级变异在ST和骨URS患者中更常见。测序应被视为URS常规标准治疗的一部分。
在ST URS中,一些最常见的可干预1级变异是融合(特别是涉及ALK和NTRK基因)和SMARCB1缺失。这些强调了使用能够评估融合和拷贝数变异,而不是仅评估点突变的分子检测的重要性。NRAS和HRAS基因突变也很常见。这些突变也见于其他恶性肿瘤,在黑色素瘤中,MEK抑制剂比尼替尼对有NRAS突变的肿瘤显示出一些治疗益处。此外,DNA损伤应答通路相关基因在相对较高的变异频率,这可能提示了PARP抑制剂在URS中的探索。
研究结果提示TP53缺失是肉瘤发展中常见的关键事件。在体外和体内研究中,TP53突变均与STS和骨肉瘤的化疗耐药相关。TP53在DNA损伤和其他应激源引起的细胞凋亡中起着关键作用。人们试图将突变型TP53作为靶向治疗的靶点,通常是试图恢复野生型(WT)TP53的表达或消除突变型TP53,但迄今这些努力大多未成功。TP53突变仍然是包括肉瘤在内的许多不同癌症的不良预后特征。然而,研究者发现了一个新的小分子可以选择性地与Y220C突变体中的半胱氨酸反应并恢复野生型的热稳定性。试验正在进行中(clinicaltrials.gov NCT04585750)。
CDKN2A基因编码p16(INK4A)和p14(ARF)蛋白。P16抑制CDK4和CDK6。因此,理论上和实验上,CDKN2A缺失与CDK4/6激活相关。然而,在一项针对CDKN2A缺失肿瘤的2期篮式试验中,CDK4/6抑制剂瑞博西利无效。由于这些细胞周期通路的变异通常与多个通路的变异同时发生,因此在联合治疗中应进一步评估CDK抑制剂。
免疫治疗应答与TMB-H、肿瘤PD-L1表达和肿瘤浸润淋巴细胞增加相关。免疫疗法在肉瘤中的应用通常令人失望,据报道客观缓解率为5%-20%。原因可能是多方面的。一个可能的解释是在肉瘤中观察到的普遍低TMB。在本研究中,在所有四组中均观察到低平均TMB,并且在URS组和非URS组之间没有显著差异。然而,在所有人群中,有一小部分TMB-H患者可能从免疫治疗中获益。这种异质性之前已经报道过。观察这些TMB较高的肉瘤对免疫治疗的反应是否更好将是值得探索的。事实上,CD8 T-细胞浸润和PD-1表达与肉瘤对抗PD-1抗体联合IL2通路激动剂bempegaldesleukin的客观缓解率改善相关。鉴于URS的现有治疗方法缺乏,因此检测TMB并考虑免疫治疗可能是值得的。
本研究还表明,在基因样本和公共数据库中增加种族多样性是有必要的。在GENIE数据集中,6.8%的肉瘤标本来自黑种人患者。相比之下,美国11%-12%的肉瘤患者是黑人。这与其他报道一致,在精准肿瘤学研究中,白种人患者比例过高,而少数人种和民族患者比例过低。与此相关,基因测序数据中的代表性不足可能导致TMB被高估。当进行仅肿瘤的测序(即不与胚系测序进行比较)并与欧洲血统占比过高的参考标准进行比较时,这看起来似乎非洲和亚洲血统的患者有较高的TMB。事实上,最近的一项研究开发了一种方法,使用基于肿瘤的祖先推断修正了仅针对肿瘤样本的TMB计算。这可能有助于选择从免疫检查点抑制剂中获益的TMB-H患者。
本研究有几个局限性。首先,数据来自许多机构,这些机构使用不同的平台和panels进行测序。因此,如果一些机构的基因panels中没有包括一些基因的变异,那么它们可能会被低估。其次,这些是来自临床测序的数据,告诉我们具有已知或推测临床意义的基因变异。然而,这无法识别未测序的新基因变异、新融合和非编码区变异。
研究结果表明,URS的常规NGS有可能为这些URS患者提供额外的治疗选择。我们需要在未来的工作中评估使用这些数据的临床影响,以及这些基因变异对URS疗效的预测作用是否与对其他癌症的预测作用一样。
参考文献:
Denu, Ryan A et al. “The Landscape of Alterations from 1407 Ultra-Rare Sarcomas from the AACR GENIE Database: Clinical Implications.” Clinical cancer research : an official journal of the American Association for Cancer Research vol. 29,22 (2023): 4669-4678. doi:10.1158/1078-0432.CCR-23-0876

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#超罕见肉瘤# #肉瘤#
94