临床真实世界研究中的实验性研究设计
2018-11-07 何俏, 时景璞. 中华流行病学杂志
何俏, 时景璞. 临床真实世界研究中的实验性研究设计[J]. 中华流行病学杂志, 2018, 39(4): 519-523 随机对照试验(RCT)即解释性随机对照试验(explanatory randomized controlled trials,ERCT),对研究对象的选择、干预措施的应用有严格的限定,以保证其内部有效性,但同时却大大削弱了其普适性,加之ERCT的开展要耗费巨
何俏, 时景璞. 临床真实世界研究中的实验性研究设计[J]. 中华流行病学杂志, 2018, 39(4): 519-523
随机对照试验(RCT)即解释性随机对照试验(explanatory randomized controlled trials,ERCT),对研究对象的选择、干预措施的应用有严格的限定,以保证其内部有效性,但同时却大大削弱了其普适性,加之ERCT的开展要耗费巨大的人力、财力和时间,愈来愈多专家认识到ERCT的局限性。真实世界研究(real world study,RWS)作为对ERCT的补充和进一步验证,旨在评价干预措施在真实医疗环境中的实际疗效,被广泛用于疾病治疗、诊断、预后、病因分析等方面。然而对RWS的认识还存在许多误区,错误将RWS等同于观察性研究,实际除了观察性研究外,RWS还可采用实验性研究的设计方案,其结论更可靠、证据级别更高、实用性更强。因此本文结合实例介绍RWS中如何实现实验性研究方案。
一、ERCT的局限性以及RWS的特点在临床上ERCT常被认为是评价干预措施的“金标准”,采用严格限定的样本人群和标准单一化的干预措施并通过随机、对照、盲法、客观的效应指标对实验结果进行测量和评价,以获取干预的治疗效力(efficacy)[1],保证其内部有效性。然而,在实际临床环境中,存在疾病共存、特殊人群用药、联合用药、依从性较低等许多复杂问题,传统RCT只能提供在“理想”状态下干预措施的结果信息,因此在外推到更广泛的目标人群时将受到一定限制,而且其实施难度和成本较高,愈来愈多专家指出RCT的实际临床应用价值存在局限性[2]。
真实世界研究源自实用性临床试验,属于药物面世后研究,是指在较大的样本量下,采用观察性或实验性设计方案对不同干预措施或策略在真实医疗实践环境中的实际疗效(effectiveness)进行长期评价,强调外部有效性,是对ERCT的进一步补充和验证。目前国内外已开展了大量真实世界研究,其中属于观察性研究的注册登记研究(registry study)在临床实践中运用尤其广泛,是实现RWS的重要手段[3]。然而,在认识RWS时,存在错误将RWS等同于一种观察性研究,认为干预措施均是非随机化的[4-5]。实际上,真实世界研究的基本设计既包括观察性研究,还包括实验性研究设计方案[6]。
二、RWS常用设计方案1.观察性研究:目前真实世界研究使用最为广泛的设计方案,包括横断面研究、注册登记研究、病例对照研究及其衍生类型、队列研究(前瞻性、回顾性或双向性)等。患者接受的干预措施是事先存在的,并且是由患者和医生根据患者实际情况共同决定而不是研究实施者随机分配的。
2.实验性研究:是指实用性临床试验,包括实用性随机对照试验(pragmatic randomized controlled trials,PRCT)和基于注册登记研究的随机对照试验(registry-based randomized controlled trials,RRCT),也可采用非随机对照、前后对照、自适应设计等其他实验性研究方案。
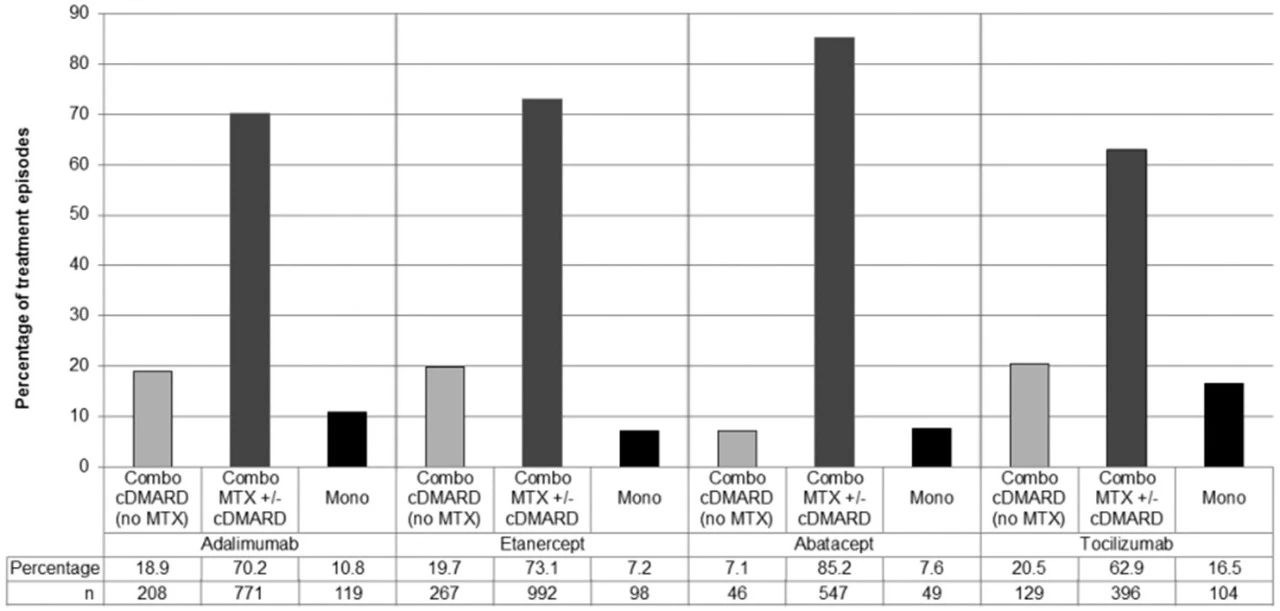
PRCT与ERCT主要通过收集医院现有患者,并将其随机分为干预组和对照组,在尽量贴近临床实际情况下对两组人群进行干预和随访,针对患者、临床医生或医疗卫生决策者有重要价值的结局进行评价[5]。除所研究的干预措施外,其他常规护理可根据患者和医生意愿灵活选择,随机化分组方式也较灵活,可使用个人随机、整群随机化以及结合患者意愿随机等,对盲法和依从性没有严格要求,依从性可作为一种可行性的结局指标进行分析[7]。因此,PRCT是评价实际临床中干预措施的效果,而ERCT则是在理想状态下研究干预措施的效力。但PRCT和ERCT并非完全对立的二分类事件,而是一个连续的过程,很少有研究是绝对的PRCT或是绝对的ERCT。Thorpe等[8]在2009年发表PRECIS(pragmatic-explanatory continuum indicator summary)并于2015年发表改进版PRECIS-2,旨在帮助试验研究者在设计阶段确保试验设计与试验目的相匹配。其中PRECIS-2是由入选、招募、试验场景、试验组织、灵活性(给予干预)、灵活性(依从性)、随访、首要结局和首要分析共9个维度组成的轮状模型,每个维度评分为1~5分,其中1分表示高度解释性,5分为高度实用性,某个维度越偏向实用性,其维度得分越接近5分。因此运用PRECIS-2可直观并综合评价试验的实用或解释程度[9](表 1)。

PRCT将随机化融入到真实世界研究中,除了真实世界研究的基本特点以外,还可弥补观察性真实世界研究混杂和偏倚以及ERCT外部有效性低的缺点。ALLHAT(antihypertensive and lipid lowering treatment to prevent heart attack trial)是一项大样本的高血压实用性RCT,包括抗高血压试验和降血脂试验,其中抗高血压试验是一个随机对照双盲阳性药物对照试验,旨在比较传统廉价的利尿剂与其他3种新型较昂贵的降压药(钙拮抗剂、血管紧张素转换酶抑制剂或α受体阻断剂)的心血管事件发生率,研究纳入>55岁合并至少一项其他心血管危险因素的高血压患者,随机分配到试验组(给予利尿剂氯噻酮)和对照组(钙拮抗剂氨氯地平、血管紧张素转换酶抑制剂赖诺普利或α受体阻断剂多沙唑嗪中一种),平均随访6年后比较两组心血管事件的发生率,最终发现试验组主要心血管事件发生率低于对照组。该试验研究对象来自美国625个临床中心,样本量超过42 000例,特点为研究人群多样化、来自多个临床实践环境,同时采用阳性药物作为对照、随访时间较长,可以直接为医疗工作者提供决策[10-11]。此外由英国53个初级保健院组成的多中心PRCT,比较了白三烯受体拮抗剂与吸入性糖皮质激素在真实世界中作为哮喘控制一线治疗药物的近期、远期疗效的差异[12];Heddle等[13]比较了澳大利亚、加拿大、美国和以色列6所医院分别输入储存期短和储存期长的血液后患者院内死亡率;以及来自9个国家11 093例急性脑卒中患者中开展的实用性整群随机交叉对照试验,比较卒中后患者头部位置对疾病预后的影响[14]。但这类PRCT以拟招募医院现有患者为研究对象,且要求大样本量和较长随访期,需要耗费巨大的资源和财力,目前仍较少开展[15]。
随着电子信息化的迅速发展,RRCT已引起医疗领域的广泛关注。近些年RRCT已经在美国、英国以及一些北欧国家陆续展开,如TASTE(thrombus aspiration during ST-segment elevation myocardial infarction trial)、SAFE-PCI for Women(Study of Access site for Enhancement of Percutaneous Coronary Intervention for Women)、REDUCE MRSA(Randomized Evaluation of Decolonization versus Universal Clearance to Eliminate MRSA)、CHAP(Cardiovascular Health Awareness Program)、VALIDATE-SWEDEHEART等[16-20]。以下结合实例介绍真实世界研究中的RRCT。
三、RRCT概述1. RRCT的概念:在瑞士开展的一项评价冠脉血栓抽吸联合经皮冠状动脉介入治疗(PCI)是否能改善ST段抬高型心肌梗死患者预后研究的设计方案中,首次将RRCT定义为一种借助高质量的注册数据库作为平台来进行病历记录、数据收集、随机化和随访的实用性RCT[21]。有学者评价该试验将可能成为临床研究领域下一个颠覆性的技术[22]。
2. RRCT的优点:
(1)增加了试验结果的外推性。RRCT本质上亦是一种实用性RCT,与ERCT相比,其纳入/排除标准较宽松,干预条件、患者监测和随访都接近实际情况。因此其结果的普适性更高。随访和结局指标数据还可以来自其他注册登记数据库或卫生行政管理数据库。
(2)事件发生数通常较大,可以用于罕见疾病的研究。
(3)偏倚少,采用随机化的方法降低了可能存在的混杂因素的影响。随机化过程可使用电话、网络、置于注册数据库中的随机化工具,以及采用整群随机化的方式[18, 23]。
(4)与ERCT相比,费用较低。RRCT可直接利用已有的注册数据库或结合其他数据库资源来获得相关数据。另外,还可减少对患者的频繁访问次数、研究中心合作者的培训费用和工作量、利用现有合作网络进行研究中心的选择、对关键变量的风险监测都将大大降低试验的成本[24]。如TASTE研究纳入7 200名受试者,共投入30万美元即平均每个受试者50美元,仅相当于传统RCT成本的2%[24]。而SAFE-PCI for Women研究采用注册登记数据库选择研究中心和受试者减少了研究中心合作者近65%的工作量[17, 24]。
(5)迅速连续纳入研究对象,提高了研究效率。利用注册数据库中已有的临床信息实现研究对象的快速筛选和入组,而不需要填写冗长入选标准表格。TASTE研究在约近3年的时间就完成了76.9%合格研究对象的随机化[24]。
(6)获得更完整和准确的随访数据:使用唯一的患者识别码,可以完成对注册数据库中绝大部分患者的追踪。同时还可以对那些符合纳入和排除标准但未得到随机化的以及不符合纳入和排除标准的人群进行描述和随访。SAFE-PCI for Women研究虽然提前终止,但其受试者随访率在两个队列组中分别达到了99.9%和99.3%[17]。而TASTE研究没有一例研究对象失访[25]。
3. RRCT的挑战:
(1)注册数据库以及多中心数据库链接:是否有相关的注册登记研究?如果有,注册数据库中是否包含所有研究感兴趣的数据?这些数据的质量如何?RRCT的数据来源主要是注册数据库,因此注册数据库的有无,数据的质量在很大程度上影响着该试验成败。北欧国家在注册登记研究上做得相对突出,可以获得全国卫生数据以及全国范围内疾病注册数据。例如,瑞士现约有100个疾病注册登记研究,涉及牙科、糖尿病及艾滋病等多个领域,但还有很多卫生保健干预和护理领域并未开展注册登记研究[23]。而现有的注册数据库可能还存在数据缺失,或无法获取重要研究因素的情况而影响研究结果。研究结局事件的判定通常不包含在注册数据库中,因此通常推荐RRCT采用临床“硬终点”如死亡来减少测量偏倚[4]。在SAFE-PCI for Women试验中终点事件是由额外的调查表收集并通过统一的临床事件委员会判定[26]。另外单个数据库往往不能提供足够的数据,因此应联合使用多个注册数据库,但需注意不同的注册登记研究因初始的研究目的不一样,其基线变量的定义、收集以及精确性可能存在差异[24],以及在与其他数据库连接时是否有患者统一识别码进行统一识别。作为RRCT的研究基础,高质量的注册数据库以及多中心之间数据库链接是未来RRCT的重要工作。
(2)方法学:RRCT是基于真实世界背景下的实用性试验研究,盲法及标准化的干预实施、固定的随访以及结局测量的统一判定较困难;如何确保纳入人群的代表性,例如注册与未注册人群是否存在系统差异,RRCT是借助现有的注册登记研究作为平台,因此研究问题、设计、数据类型都将受到所使用的注册登记研究的质量和特点的限制。
(3)伦理问题:包括如何获取注册数据库的访问;在利用注册登记研究数据的同时如何确保数据的安全以及保护患者隐私;链接多个注册数据库时所面临的数据共享问题。
4. RRCT实例:以SAFE-PCI for Women试验简述(图 1)。
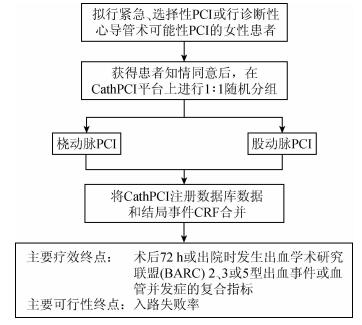
注:PCI为经皮冠状动脉介入治疗;CRF为病例报告图 1 SAFE-PCI for Women流程
(1)研究背景:出血是PCI最常见的并发症,并能增加患者近期和远期发病率和死亡率,增加医疗成本。与传统经股动脉入路相比,经桡动脉入路行PCI能显著降低出血事件和血管并发症的风险。女性PCI术后出血和血管并发症的风险高于男性,但因其桡动脉较细,在介入术中易发生动脉痉挛而导致介入失败。另外在之前发表的有关比较桡动脉与股动脉入路行PCI的研究中,女性的代表性较差。因此,目前还不清楚经桡动脉入路行PCI的女性患者的疗效和安全性。
(2)研究假设:与传统经股动脉入路相比,经桡动脉入路能显著降低行PCI女性患者的出血和血管并发症的风险。
(3)研究人群:在2011年9月至2013年7月共纳入美国60个研究中心参与该项研究。纳入标准为:各研究中心将接受紧急PCI、选择性PCI或诊断性导管术后可能行PCI的女性患者,年龄>18周岁并能签署知情同意。排除标准包括:患有无法进行经桡动脉或股动脉介入术的疾病;已知的需要进行瓣膜术的心脏瓣膜病患者,计划行右心导管插入术患者;ST段抬高型心肌梗死患者;已知存在双侧乳内冠状动脉旁路移植术的患者;在入组前1个月内参与过其他药物或设备临床研究的患者;以及首次介入治疗后30 d内行二次PCI的患者。
(4)干预措施:经桡动脉入路行PCI对比经股动脉入路行PCI。
(5)主要终点:①主要疗效终点:术后72 h内或出院时发生出血学术研究联盟(BARC)2、3或5型出血事件或血管并发症。②主要可行性终点:穿刺点的交叉。
(6)研究设计:借助一项正在进行的注册登记研究,即美国国家心血管数据注册研究CathPCI注册登记研究为平台筛选合格的试验中心,在获得患者知情同意后,使用一种安装到注册研究数据库的在线随机化模块,将患者按1 : 1的比例随机分成桡动脉PCI组和股动脉PCI组。将研究对象的人口学资料、病史、合并用药、手术细节以及院内临床结局数据,常规输入到该注册有登记的数据收集系统中,并自动生成数据调查表。其他有关该试验的特异性信息,如血管穿刺点和研究结局指标并未包含在CathPCI注册中,而是由额外的调查表收集,再通过患者唯一识别码横向合并两个数据库后进行分析。研究定义了两个人群队列,所有进行PCI的患者(PCI队列)和所有随机化患者(整体随机化队列,包含PCI队列的患者和诊断性心导管术后未进行PCI的患者),分别在两组人群中对主要疗效和可行性终点进行意向性治疗分析(ITT;PCI队列组采用改良意向性治疗分析,即modified ITT)。
(7)研究结果:由于主要疗效终点事件发生率远低于预期率,该研究提前结束。最终共1 787例患者得到随机化,其中691例进行了PCI(345例行桡动脉PCI,346例行股动脉PCI)。对主要疗效指标进行ITT分析发现,在PCI队列组中,桡动脉组出血或血管并发症发生率为1.2%,股动脉组为2.9%,差异无统计学意义(P=0.12);如加上诊断性心导管术未行PCI的患者即整体随机化队列组,桡动脉组出血或血管并发症发生率明显低于股动脉组(0.6% : 1.7%,OR=0.32,95%CI:0.12~0.90,P=0.03)。符合方案集分析结果与上述结果相同。分析还发现行PCI和行诊断性心导管术未行PCI的患者间并没有明显的交互作用,推测PCI队列未出现有统计学意义的结果,可能是因为PCI队列的样本量较小。对主要可行性终点分析发现,在两个队列中,桡动脉组穿刺点交叉率均高于股动脉组(PCI队列:6.1% : 1.7%,OR=3.65,95%CI:1.45~9.17,P<0.01;整体随机化队列:6.7% : 1.9%,OR=3.70,95%CI:2.14~6.40,P<0.01),交叉的主要原因是发生了桡动脉痉挛。
(8)研究结论:进行诊断性心导管术或PCI的女性患者采取桡动脉穿刺是合理的,但部分患者可能会转换到股动脉穿刺。
该试验是美国第一个基于注册数据库的多中心RCT,利用已有的注册登记数据库进行研究中心的选择、患者入组、随机化分配和基线数据收集。与ERCT或PRCT采用调查表相比,减少了近65%的工作量,成为临床新典型。
四、结语
真实世界研究是一种以患者为中心,旨在比较不同干预措施在真实临床环境下的实际疗效,为患者、医生和医疗卫生决策者提供直接信息的研究,其设计方案除了运用较广泛的观察性研究外,还包括实验性研究,如PRCT。而RRCT作为新兴的实用性RCT,仍面临需客观对待其研究结果的挑战和问题,尤其是如何获得高质量的注册登记研究。总之,不管选择哪一种研究设计方案,都需要综合考虑拟解决的研究问题和现有的研究条件。
利益冲突: 无
参考文献
[1] 李敏, 时景璞, 于慧会. 真实世界研究与随机对照试验、单病例随机对照试验在临床治疗性研究中的关系比较[J]. 中华流行病学杂志, 2012, 33(3): 342–345.
Li M, Shi JP, Yu HH. Relationship between the 'Real World' research, randomized controlled trial and number of one randomized controlled trial in clinical therapeutic study[J]. Chin J Epidemiol, 2012, 33(3): 342–345. DOI:10.3760/cma.j.issn.0254-6450.2012.03.021
[2] Grapow MTR, Von Wattenwyl R, Guller U, et al. Randomized controlled trials do not reflect reality:Real-world analyses are critical for treatment guidelines![J]. J Thorac Cardiovasc Surg, 2006, 132(1): 5–7. DOI:10.1016/j.jtcvs.2006.03.035
[3] 曹越, 尹庆锋, 曾宪涛. 真实世界研究概述[J]. 武警医学, 2017, 28(4): 400–403.
Cao Y, Yin QF, Zeng XT. Overview of real world study[J]. Med J Chin PAP, 2017, 28(4): 400–403. DOI:10.14010/j.cnki.wjyx.2017.04.024
[4] James S, Rao SV, Granger CB. Registry-based randomized clinical trials-a new clinical trial paradigm[J]. Nat Rev Cardiol, 2015, 12(5): 312–316. DOI:10.1038/nrcardio.2015.33
[5] 孙鑫, 谭婧, 唐立, 等. 重新认识真实世界研究[J]. 中国循证医学杂志, 2017, 17(2): 126–130.
Sun X, Tan J, Tang L, et al. Revisiting real-world study[J]. Chin J Evidence-Based Med, 2017, 17(2): 126–130. DOI:10.7507/1672-2531.201701088
[6] Roche N, Reddel H, Martin R, et al. Quality standards for real-world research. Focus on observational database studies of comparative effectiveness[J]. Ann Am Thorac Soc, 2014, 11(Suppl 2): S99–104. DOI:10.1513/AnnalsATS.201309-300RM
[7] 青雪梅, 房繄恭, 刘保延, 等. 实用性随机对照试验及其方法学特征思考[J]. 北京中医药大学学报, 2008, 31(1): 14–18.
Qing XM, Fang YG, Liu BY, et al. Pragmatic randomized controlled trials and its methodological features[J]. J Beijing Univ Tradit Chin Med, 2008, 31(1): 14–18.
[8] Thorpe KE, Zwarenstein M, Oxman AD, et al. A pragmatic-explanatory continuum indicator summary (PRECIS):a tool to help trial designers[J]. J Clin Epidemiol, 2009, 62(5): 464–475. DOI:10.1016/j.jclinepi.2008.12.011
[9] Loudon K, Treweek S, Sullivan F, et al. The PRECIS-2 tool:designing trials that are fit for purpose[J]. BMJ, 2015, 350: h2147. DOI:10.1136/bmj.h2147
[10] Grimm RH, Margolis KL, Papademetriou VV, et al. Baseline characteristics of participants in the Antihypertensive and Lipid Lowering Treatment to Prevent Heart Attack Trial (ALLHAT)[J]. Hypertension, 2001, 37(1): 19–27. DOI:10.1161/01.HYP.37.1.19
[11] ALLHAT Collaborative Research Group. Major cardiovascular events in hypertensive patients randomized to doxazosin vs chlorthalidone:the antihypertensive and lipid-lowering treatment to prevent heart attack trial (ALLHAT)[J]. JAMA, 2000, 283(15): 1967–1975. DOI:10.1001/jama.283.15.1967
[12] Price D, Musgrave SD, Shepstone L, et al. Leukotriene antagonists as first-line or add-on asthma-controller therapy[J]. N Engl J Med, 2011, 364: 1695–1707. DOI:10.1056/NEJMoa1010846
[13] Heddle NM, Cook RJ, Arnold DM, et al. Effect of short-term vs. long-term blood storage on mortality after transfusion[J]. N Engl J Med, 2016, 375: 1937–1945. DOI:10.1056/NEJMoa1609014
[14] Anderson CS, Arima H, Lavados P, et al. Cluster-randomized, crossover trial of head positioning in acute stroke[J]. N Engl J Med, 2017, 376: 2437–2447. DOI:10.1056/NEJMoa1615715
[15] Tunis SR, Stryer DB, Clancy CM. Practical clinical trials:increasing the value of clinical research for decision making in clinical and health policy[J]. JAMA, 2003, 290(12): 1624–1632. DOI:10.1001/jama.290.12.1624
[16] Fröbert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction[J]. N Engl J Med, 2013, 369: 1587–1597. DOI:10.1056/NEJMoa1308789
[17] Rao SV, Hess CN, Barham B, et al. A registry-based randomized trial comparing radial and femoral approaches in women undergoing percutaneous coronary intervention:The SAFE-PCI for Women (Study of Access Site for Enhancement of PCI for Women) Trial[J]. JACC:Cardiovascu Intervent, 2014, 7(8): 857–867. DOI:10.1016/j.jcin.2014.04.007
[18] Hayden MK, Lolans K, Haffenreffer K, et al. Chlorhexidine and mupirocin susceptibility of methicillin-resistant Staphylococcus aureus isolates in the REDUCE-MRSA trial[J]. J Clin Microbiol, 2016, 54(11): 2735–2742. DOI:10.1128/JCM.01444-16
[19] Kaczorowski J, Chambers LW, Dolovich L, et al. Improving cardiovascular health at population level:39 community cluster randomised trial of Cardiovascular Health Awareness Program (CHAP)[J]. BMJ, 2011, 342: d442. DOI:10.1136/bmj.d442
[20] Erlinge D, Koul S, Eriksson P, et al. Bivalirudin versus heparin in non-ST and ST-segment elevation myocardial infarction-a registry-based randomized clinical trial in the SWEDEHEART registry (the VALIDATE-SWEDEHEART trial)[J]. Am Heart J, 2016, 175: 36–46. DOI:10.1016/j.ahj.2016.02.007
[21] Fröbert O, Lagerqvist B, Gudnason T, et al. Thrombus Aspiration in ST-elevation myocardial infarction in Scandinavia (TASTE trial). A multicenter, prospective, randomized, controlled clinical registry trial based on the Swedish angiography and angioplasty registry (SCAAR) platform. Study design and rationale[J]. Am Heart J, 2010, 160(6): 1042–1048. DOI:10.1016/j.ahj.2010.08.040
[22] Lauer MS, D'Agostino RB. The randomized registry trial-the next disruptive technology in clinical research?[J]. N Engl J Med, 2013, 369: 1579–1581. DOI:10.1056/NEJMp1310102
[23] Ramsberg J, Neovius M. Register or electronic health records enriched randomized pragmatic trials:the future of clinical effectiveness and cost-effectiveness trials?[J]. Nordic J Health Econ, 2015. DOI:10.5617/njhe.1386
[24] Li GW, Sajobi TT, Menon BK, et al. Registry-based randomized controlled trials-what are the advantages, challenges, and areas for future research?[J]. J Clin Epidemiol, 2016, 80: 16–24. DOI:10.1016/j.jclinepi.2016.08.003
[25] Lagerqvist B, Fröbert O, Olivecrona GK, et al. Outcomes 1 year after thrombus aspiration for myocardial infarction[J]. N Engl J Med, 2014, 371: 1111–1120. DOI:10.1056/NEJMoa1405707
[26] Hess CN, Rao SV, Kong DF, et al. Embedding a randomized clinical trial into an ongoing registry infrastructure:unique opportunities for efficiency in design of the Study of Access site For Enhancement of Percutaneous Coronary Intervention for Women (SAFE-PCI for Women)[J]. Am Heart J, 2013, 166(3): 421–428.e1. DOI:10.1016/j.ahj.2013.06.013
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#实验性#
82
#真实世界#
84