Circulation 浙江大学陈静海研究员团队发现减少线粒体蛋白翻译促进心肌细胞增殖与心脏再生
2023-11-09 论道心血管 论道心血管 发表于上海
该研究发现减少心肌细胞线粒体蛋白翻译能够有效促进小鼠在出生后、青少年期、成年后、以及心梗后心肌增殖及心脏再生修复能力,且这一现象在人iPSCs诱导的心肌细胞中也得到验证。
新生哺乳动物的心脏在出生后的短暂时期内能够完全再生,但这种再生能力在出生后数天内逐渐丢失。随着哺乳动物心脏失去再生能力的同时,心肌细胞的线粒体逐渐发育成熟,并且心肌细胞的代谢方式从糖酵解转变为线粒体氧化磷酸化。最近的研究表明,抑制心肌细胞对脂肪酸的利用,或促进心肌细胞代谢方式由线粒体氧化磷酸化向糖酵解偏移均能够有效促进内源性心肌细胞增殖。这些研究表明,将线粒体代谢引导至相对不成熟的状态,减少活性氧的产生和DNA损伤,可能参与调控内源性心肌细胞增殖的过程,奠定了线粒体对心肌增殖再生的关键性调控作用,但关于线粒体如何调控心肌细胞增殖及机制仍有待深入探索。
浙江大学医学院附属第二医院/浙江大学转化医学研究院陈静海课题组长期从事心肌细胞增殖及心梗后心脏再生机制的研究,先前发现miR-17-92基因簇(Circ Res 2013)及其家族成员miR-19 (Nat Commu 2019)与其下游直接靶点PTEN (Circulation 2020) 对心肌增殖及心梗后心脏再生修复的关键作用。2023年10月31日,陈静海课题组和美国南佛罗里达大学心脏研究所王大之课题组合作在Circulation杂志在线发表题为“Reduced Mitochondrial Protein Translation Promotes Cardiomyocyte Proliferation and Heart Regeneration”的研究论文。该研究发现减少心肌细胞线粒体蛋白翻译能够有效促进小鼠在出生后、青少年期、成年后、以及心梗后心肌增殖及心脏再生修复能力,且这一现象在人iPSCs诱导的心肌细胞中也得到验证。并进一步揭示抑制线粒体蛋白翻译促进心脏再生的分子机制:线粒体蛋白翻译进程受到抑制直接引起线粒体应激反应(Mitochondrial Stress Response, MSR)及整合应激反应(Integrated Stress Response, ISR),并特异性上调活化转录因子4 (Activating Transcription Factor 4, ATF4)的翻译进程,ATF4进一步入核调控一系列心肌增殖分裂相关靶基因的转录表达,并激活心肌细胞增殖及心梗后心脏再生修复途径。

这项研究最初的发现是源自于陈静海课题组于2023年3月22日在Nat Commun杂志发表的题为“A defect in mitochondrial protein translation influences mitonuclear communication in the heart”的研究论文(Nat Commun 浙江大学陈静海教授团队揭示心肌细胞中线粒体自身编码蛋白翻译机制缺陷触发线粒体-细胞核的信号互作调控网络)。在这项研究中,研究人员聚焦线粒体翻译功能障碍后通过代谢物及转录因子介导翻译功能受损的线粒体与细胞核的信号互作网络并促进心肌肥厚及心衰的病理进程。研究人员通过心肌特异性敲除线粒体核糖体蛋白S5 (Mitochondrial Ribosomal Protein S5, MRPS5)模拟线粒体翻译功能障碍。令人惊喜的是,研究人员观察到心肌特异性Mprs5杂合型敲除小鼠心脏明显变大,心重体重比显著增高。但与心肌特异性Mprs5纯合型敲除导致小鼠心肌肥大不同的是,杂合型敲除Mprs5小鼠的心肌细胞明显变小、数量显著增多。研究人员进一步通过对出生后1天直至2个月的小鼠心脏进行心肌增殖标志物染色,发现杂合型Mprs5敲除组小鼠的心肌增殖率显著提高。值得注意的是,小鼠成年后心肌特异性敲降Mprs5仍可显著促进心肌细胞再次进入细胞周期,并增殖分裂。
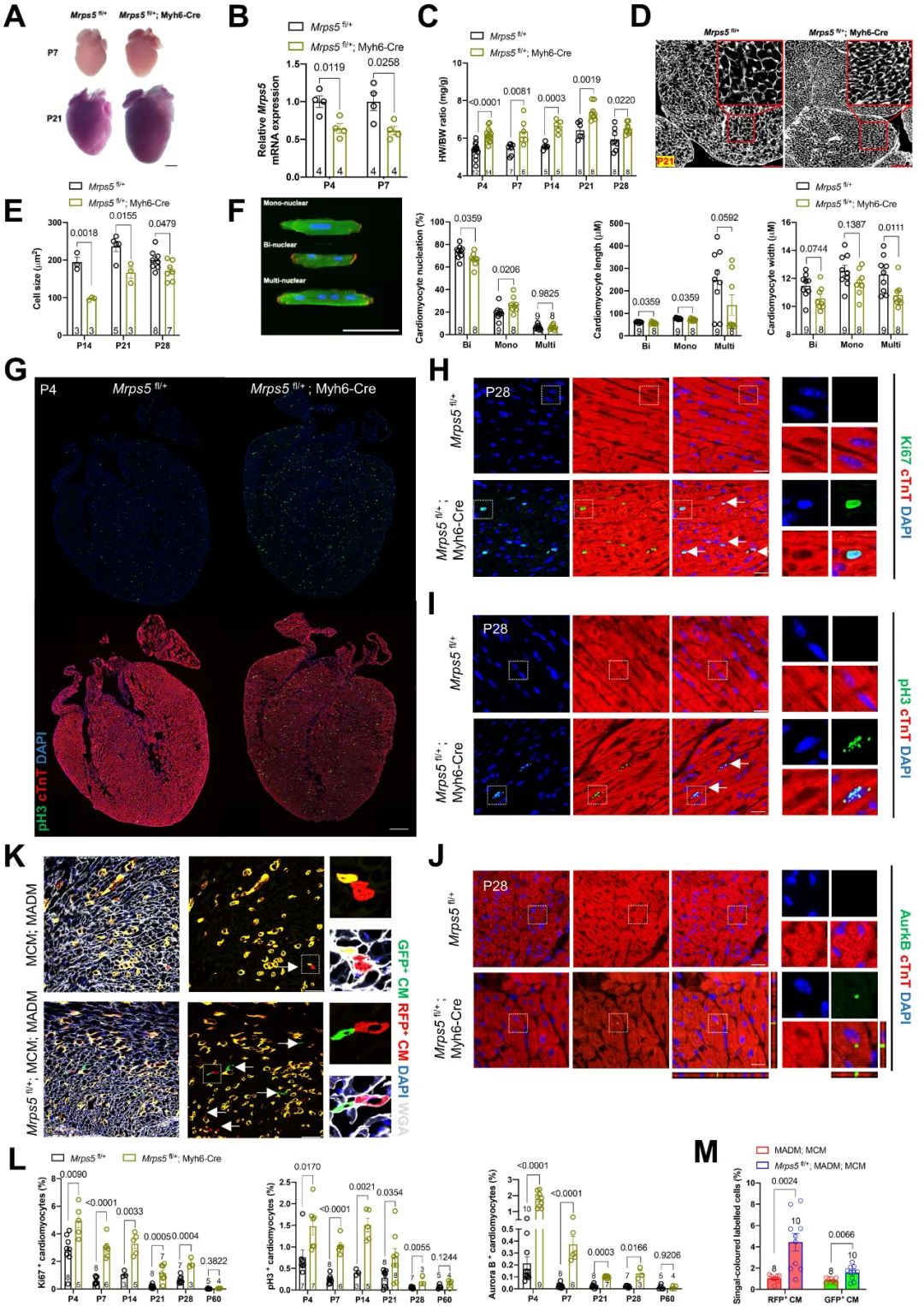
图1. 心肌特异性敲降Mprs5促进心肌细胞增殖
研究人员进一步探索在心梗模型中Mprs5敲降能否促进心肌增殖再生。在成年小鼠心脏中敲降Mprs5后通过主动脉左前降支永久性结扎模拟小鼠心肌梗死模型,发现Mprs5敲降组小鼠术后心脏功能得到显著改善,心脏梗死面积明显降低,心梗后心肌增殖再生率显著提高,此外心肌细胞凋亡率同样得到抑制。以上数据表明,抑制Mprs5的表达能够有效促进心梗后心脏再生并改善心脏功能。
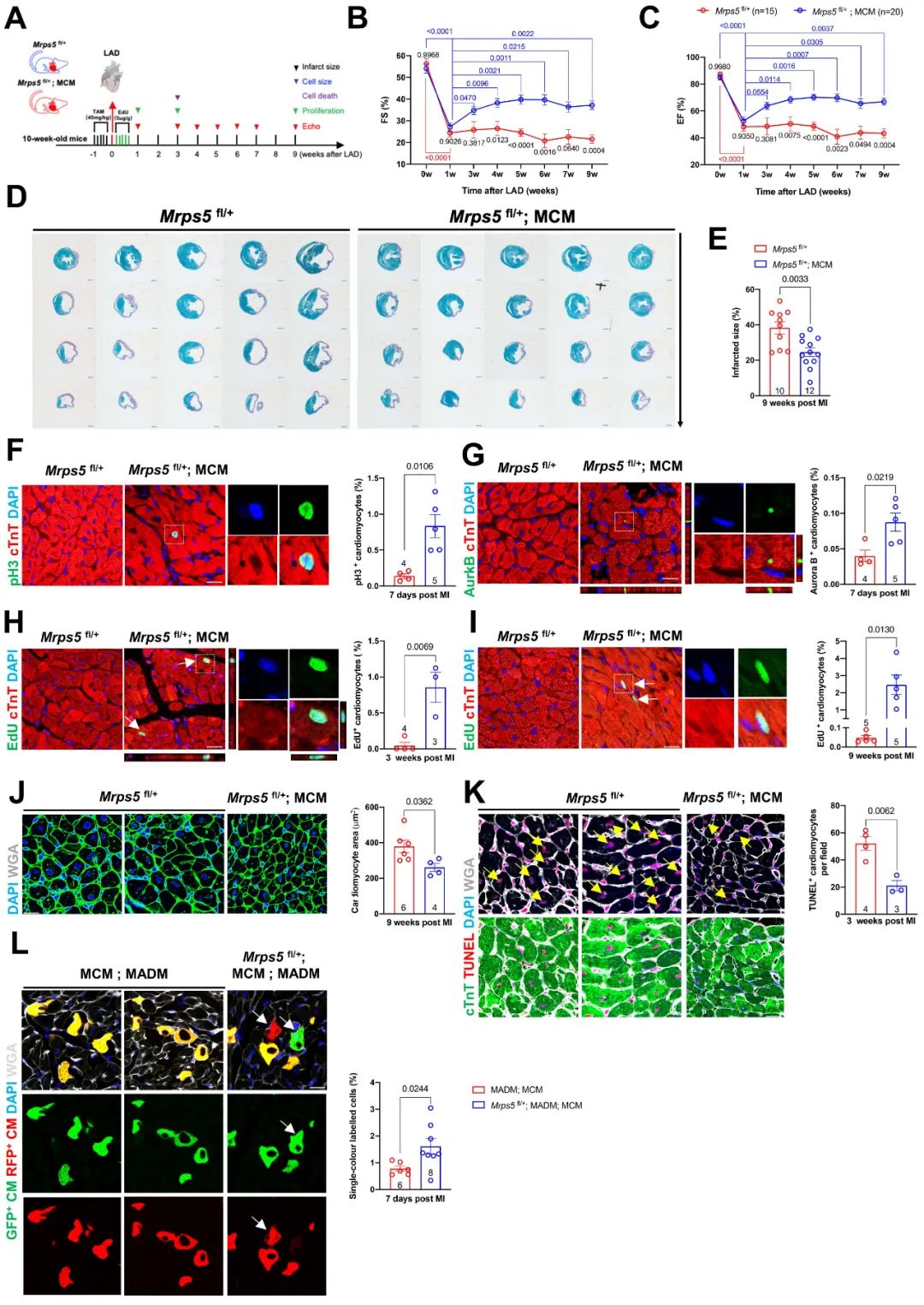
图2. 抑制Mprs5表达水平促进成年小鼠心脏再生
在心肌特异性Mprs5纯合型敲除小鼠的研究工作中,研究人员发现Mprs5敲除组小鼠线粒体自身编码的13种蛋白质无法完成翻译进程,进而导致心肌线粒体嵴结构严重损伤,线粒体氧化磷酸化功能障碍,进而加速心肌肥厚及心衰的病理进程。而在本项研究中,研究人员发现心肌Mprs5杂合型小鼠的线粒体形态结构及功能正常,仅出现轻微的MSR以及ISR。通过检测ISR下游的3个关键转录因子的蛋白表达水平,发现Mprs5敲降特异性地上调ATF4蛋白表达,ATF5蛋白表达水平无明显变化,CHOP蛋白水平则明显下降。
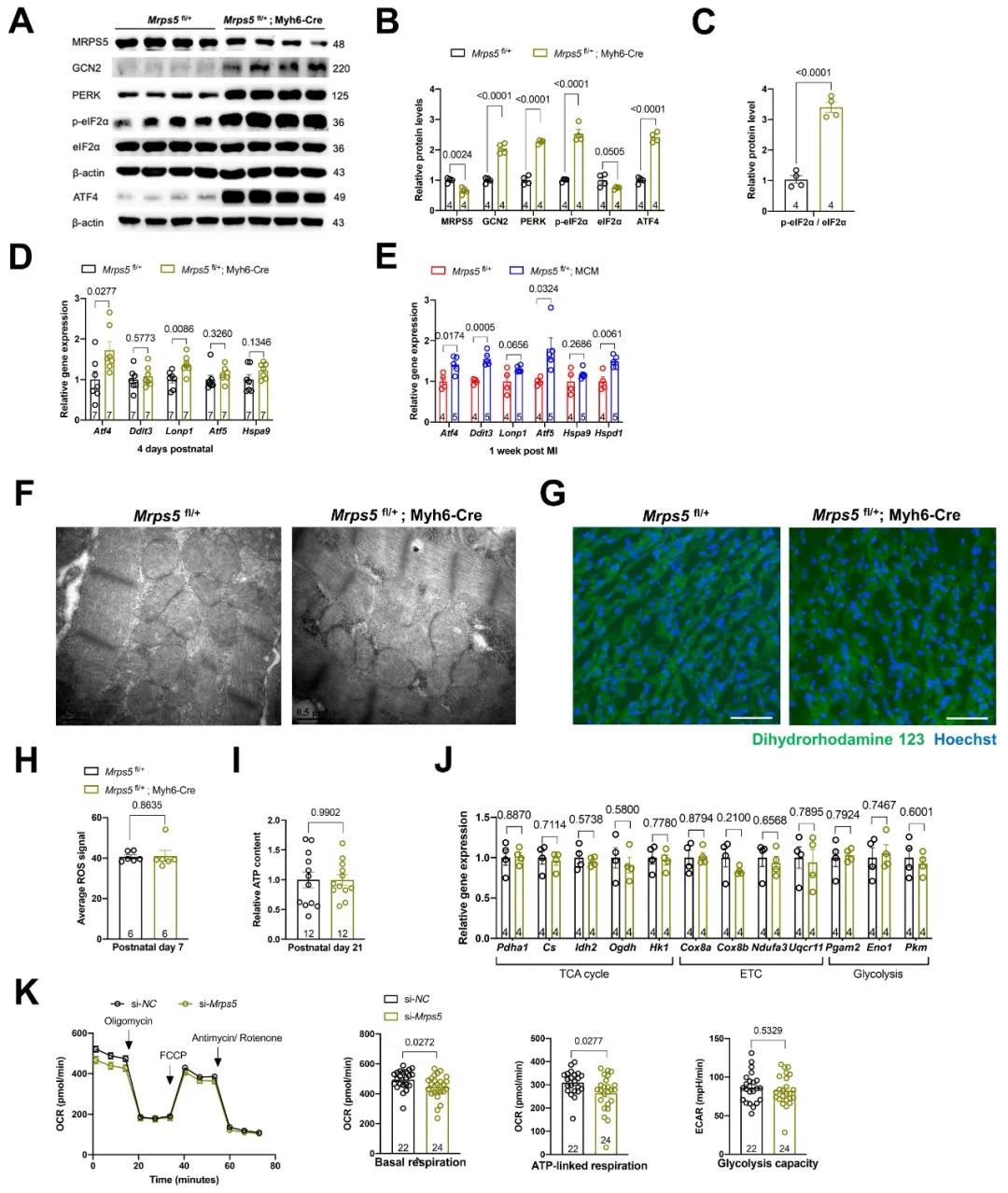
图3. 抑制线粒体翻译进程触发线粒体应激反应及ATF4信号通路
在先前关于ATF4功能缺失实验中观察到细胞增殖明显减少,表明ATF4对于维持细胞增殖至关重要。此外,一项在果蝇的研究中表明,ATF4通过诱导Warburg效应促进细胞增殖,进一步证明了ATF4在调节细胞增殖中的作用。基于此,研究人员进一步构建了心肌特异性Mprs5和Atf4双杂合型小鼠,并发现在Mprs5敲降的基础上降低ATF4的表达能够逆转在心肌Mprs5杂合型小鼠心脏中观察到的心脏变大、心重体重比增高、心肌细胞变小,以及心肌细胞增殖率增加等表型。
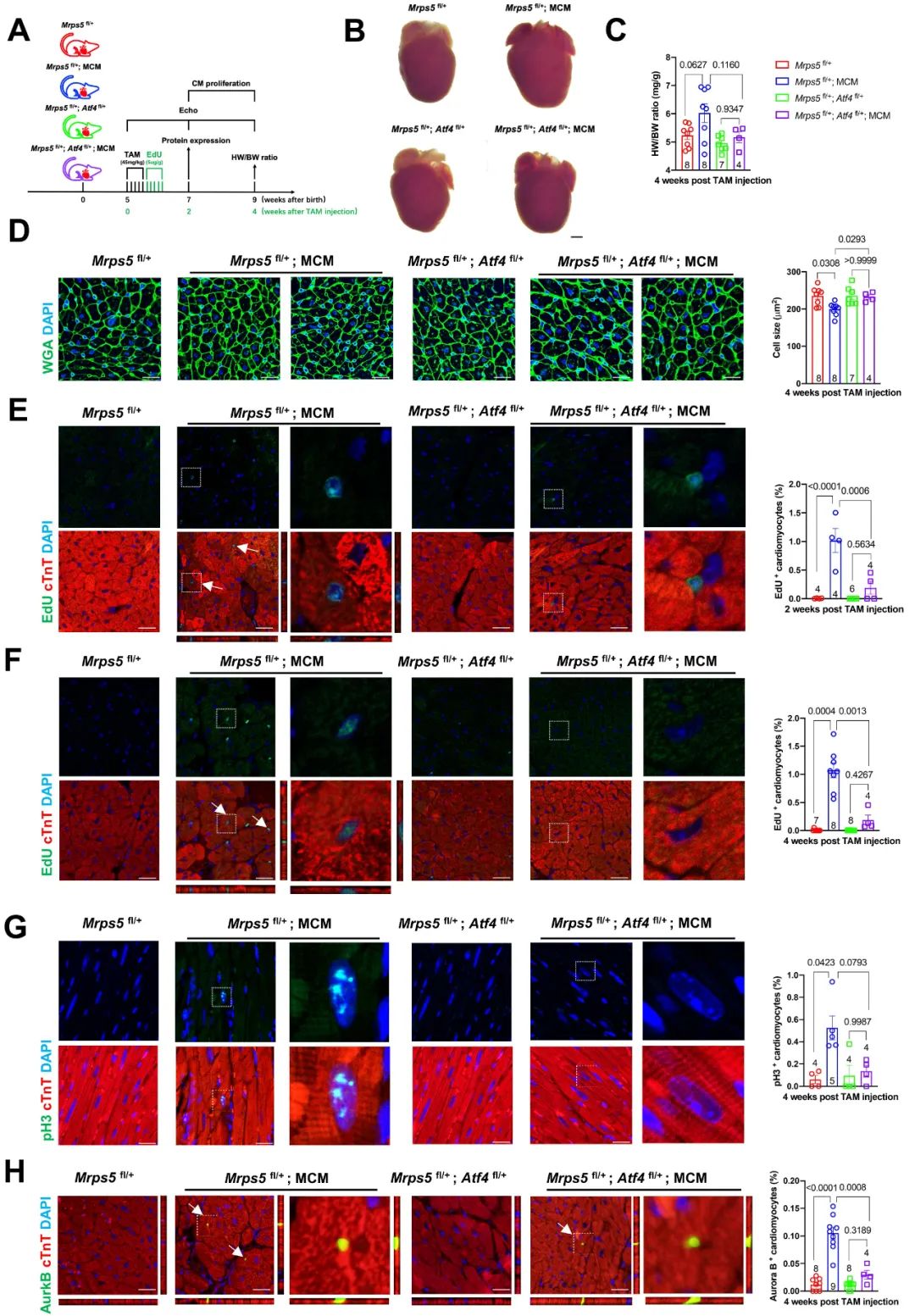
图4. 抑制ATF4表达取消Mprs5敲降导致的心肌细胞增殖表型
研究人员进一步探索ATF4是否同样介导Mprs5敲降对心梗后心脏再生及修复进程。通过观察成年Mprs5和Atf4双杂合型小鼠在心梗后的心脏功能及梗死面积发现,仅心肌Mprs5杂合型小鼠呈现出心梗后心脏功能的保护作用,而心肌Mprs5和Atf4双杂合型小鼠心梗后心脏功能、梗死面积与对照组小鼠无统计学差异。通过细胞增殖标志物的基因检测及免疫荧光染色分析,发现抑制Atf4表达抑制阻断了Mprs5敲降所引起的心脏再生及对梗死后心脏的保护作用。
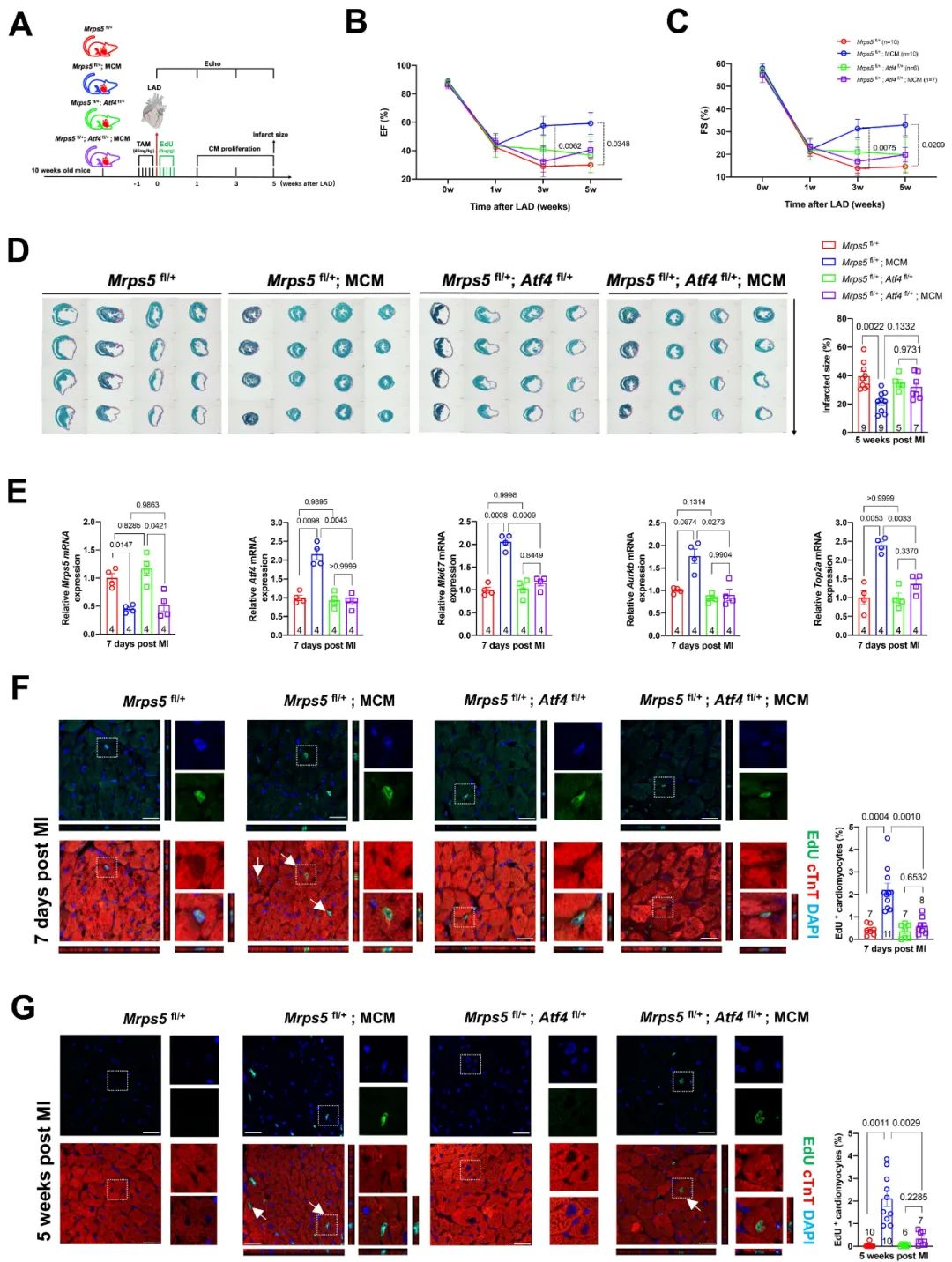
图5. 抑制ATF4表达取消Mprs5敲降导致的心梗后心脏再生
接下来,研究人员通过RNA-seq探索心肌Mprs5敲降促进心肌增殖再生的分子机制,发现心肌Mprs5杂合型小鼠心肌中细胞增殖分裂相关的信号通路均显著上调。研究人员进一步通过ATF4 ChIP-seq,并与心肌Mprs5杂合型小鼠心肌组织的RNA-seq进行联合分析,发现在Mprs5杂合型小鼠心肌中筛选所得的具有统计学差异的基因中,约有25%的差异表达基因为ATF4的下游靶基因。进一步通过GO富集分析发现,这一部分基因全部为调控细胞增殖分裂相关的核心基因。值得注意的是, 研究人员证实位于细胞动粒的动粒支架蛋白1 (Kinetochore Scaffold 1, KNL1)为ATF4的直接下游靶基因,ATF4结合KNL1基因启动子区域并激活Knl1转录表达。KNL1对于维持细胞动粒的结构及功能具有重要作用,并直接参与调控细胞分裂进程。以上研究从基因表达层面揭示了ATF4对心肌Mprs5杂合型小鼠心肌增殖再生的关键性调控作用。
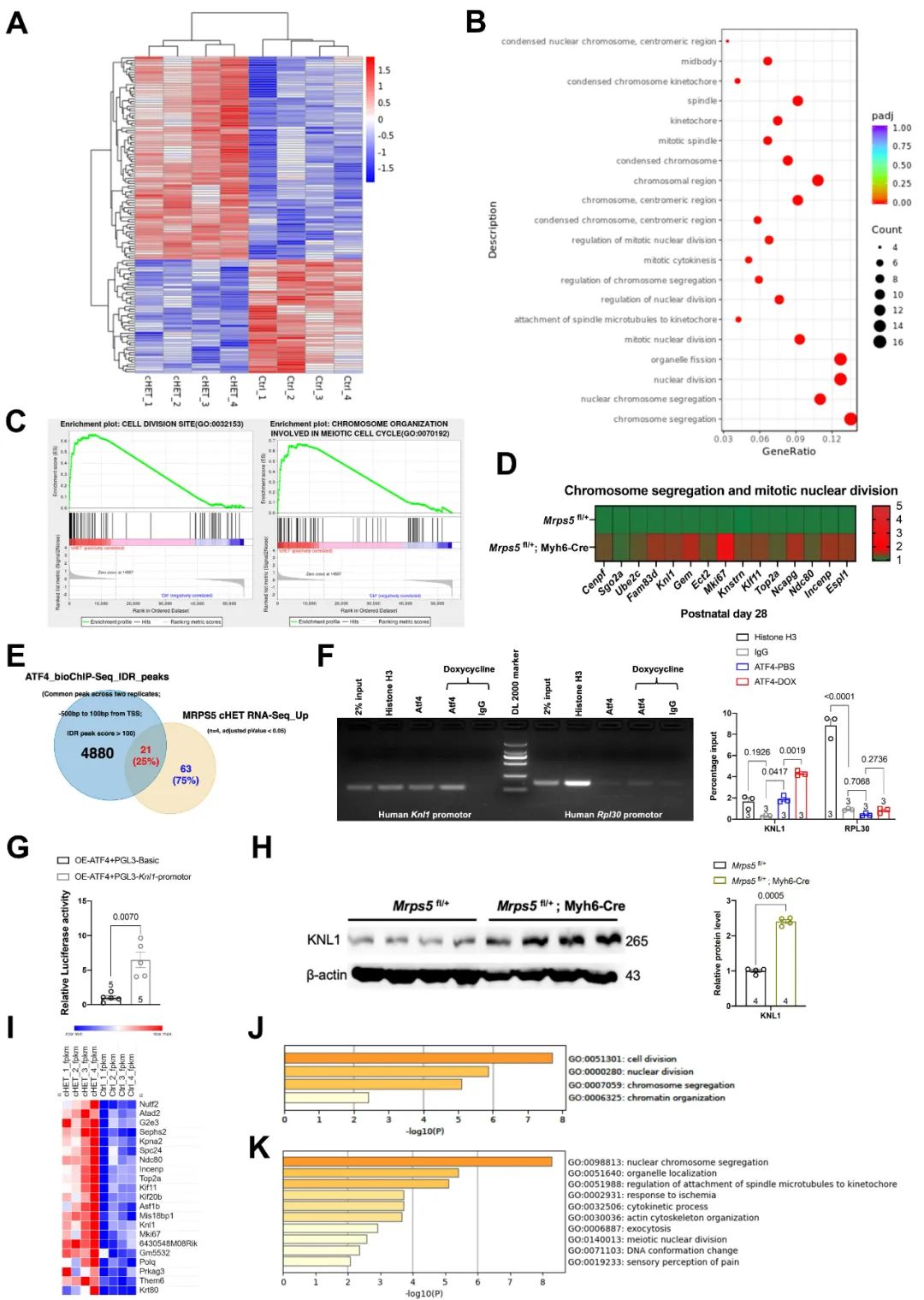
图6. ATF4通过调控细胞增殖分裂相关基因表达介导心肌Mprs5杂合型小鼠心肌增殖再生
为进一步探索以抑制线粒体翻译进程为靶点促进心脏再生及心梗后心肌修复在临床应用的可能性,研究人员通过小分子药物模拟线粒体翻译抑制作用。多西环素为临床上常用的抗菌药物,因其能够靶向抑制细菌核糖体的翻译进程,能够广泛抑制细菌、立克次氏体、支原体、衣原体引起的感染。关于线粒体起源的内共生学说认为线粒体源自于与真核细胞内共生的细菌,正因如此,多西环素对真核细胞的线粒体核糖体翻译进程同样具有抑制作用。因此研究人员通过腹腔注射给予成年小鼠多西环素并进行心梗手术,发现多西环素预给药组小鼠心梗后心脏功能显著提升、心肌梗死面积显著降低、心肌增殖率显著升高。通过分析蛋白表达,发现多西环素预给药组小鼠心肌中ATF4信号通路显著激活、其下游靶点KNL1蛋白表达水平显著上调,说明通过多西环素抑制线粒体翻译进程能够促进心梗后心肌增殖及心脏的再生修复。此外,研究人员还发现在心梗手术后6小时通过腹腔注射多西环素仍可显著改善心梗后心脏功能,呈现出较好的心梗后治疗作用。
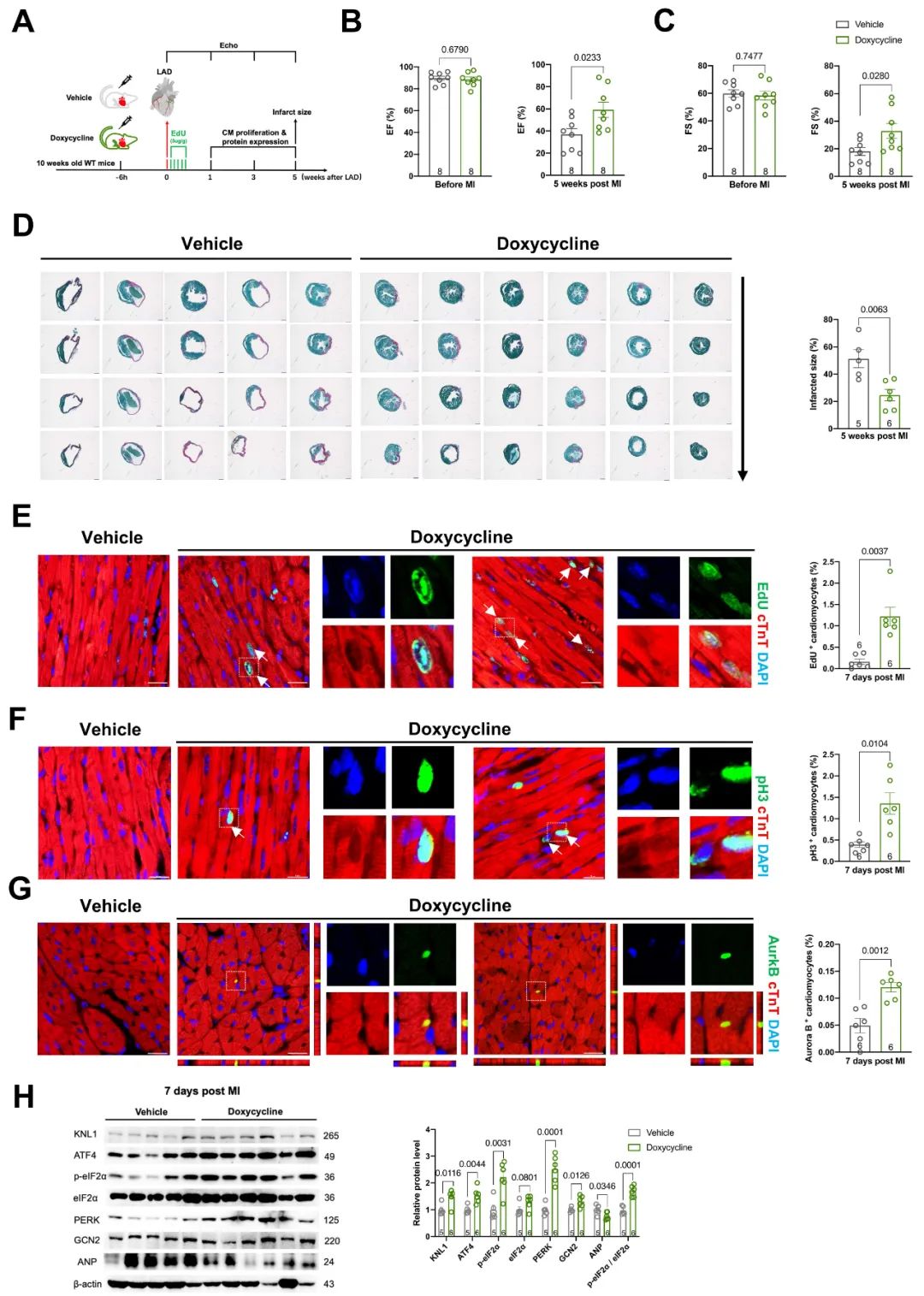
图7. 多西环素通过激活线粒体应激反应及ATF4信号通路促进心脏再生
最后,为了探索这一现象在小鼠和人的物种间的保守性。研究人员应用人多能诱导型干细胞来源的心肌细胞,分别通过RNA干扰和多西环素抑制线粒体翻译进程,并通过细胞增殖标志物基因检测和免疫荧光染色分析,发现抑制线粒体翻译进程能够有效促进人多能诱导型干细胞来源的类心肌细胞增殖。
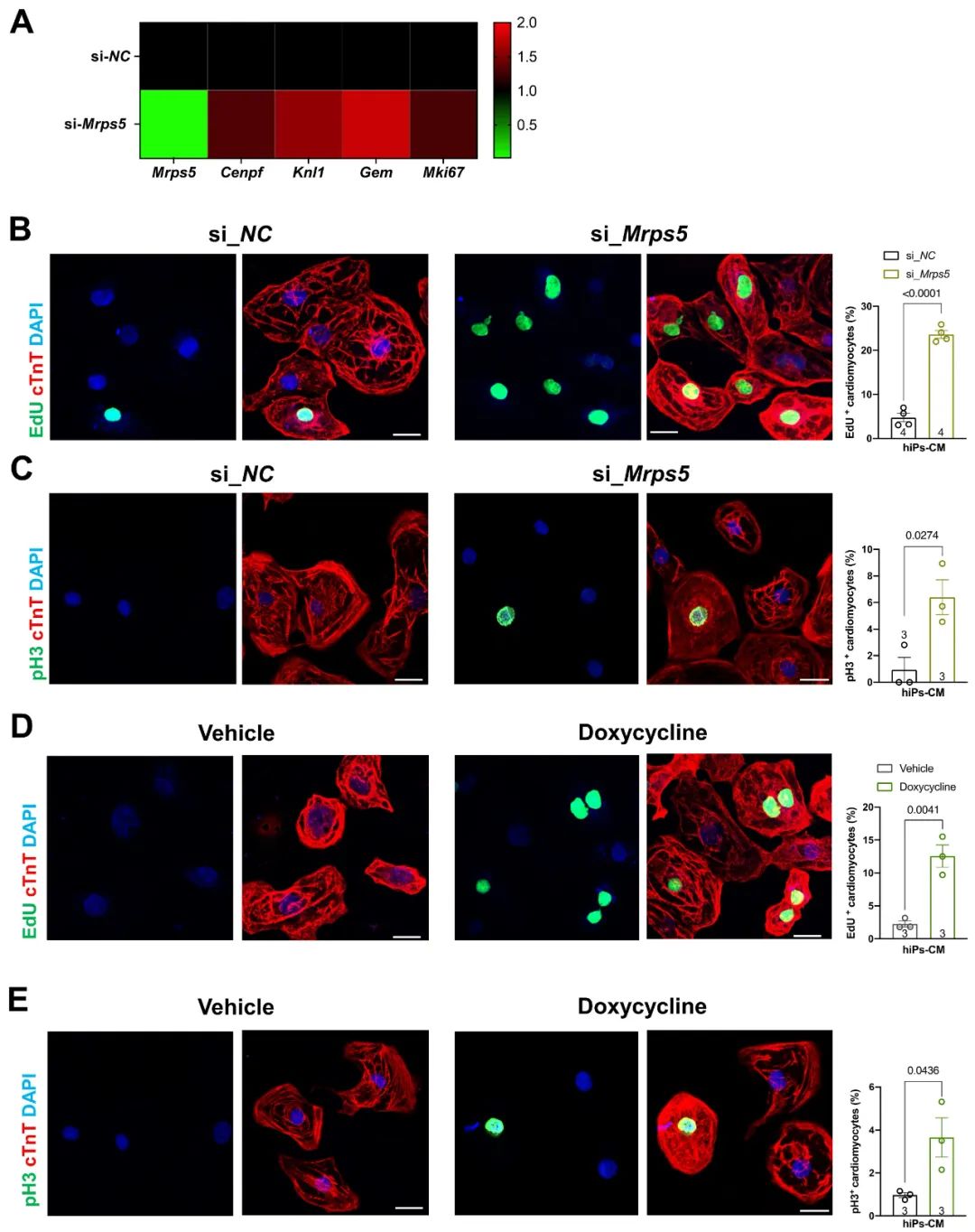
图8. 抑制线粒体翻译进程促进人多能诱导型干细胞来源的心肌细胞增殖
综上所述,本项研究的结果证实,减少线粒体蛋白翻译能够促进小鼠出生后、青少年期、以及成年期心肌细胞增殖;促进成年小鼠心梗后心脏再生修复、改善小鼠心梗后心脏功能,且这一现象在人心肌细胞中同样得到证实。通过抑制线粒体蛋白翻译进程激活MSR/ISR-ATF4信号轴,上调细胞增殖分裂相关基因表达,进而促进心肌细胞增殖及心脏损伤后再生修复。
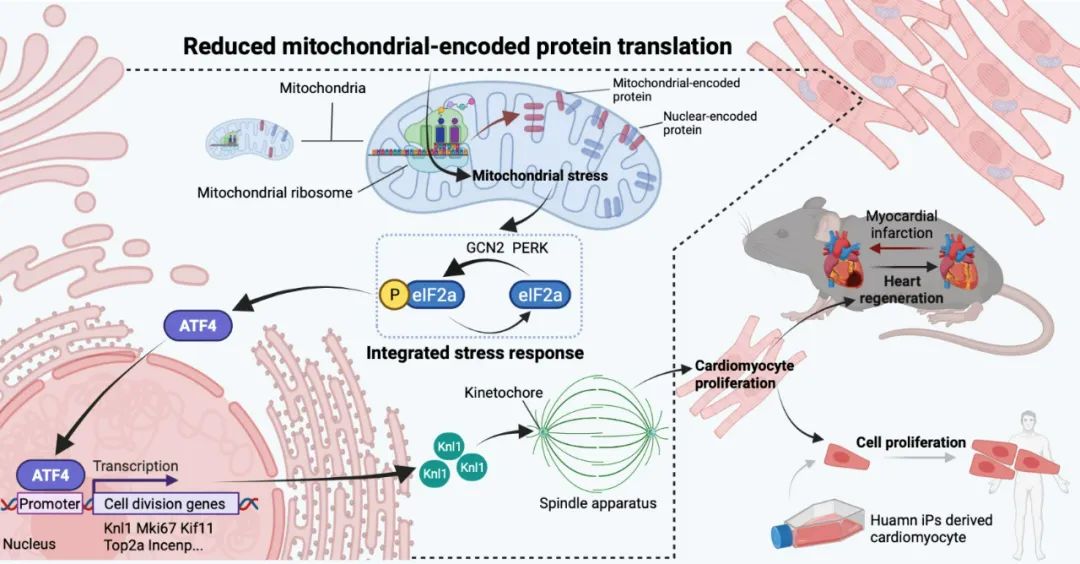
图9. 抑制线粒体翻译进程促进心脏再生
该项研究由浙江大学医学院附属第二医院、浙江大学转化医学研究院、美国南佛罗里达大学心脏研究所、哈佛大学医学院波士顿儿童医院多家机构合作完成。浙江大学医学院附属第二医院特聘研究员高峰、浙江大学转化医学研究院博士生梁甜、哈佛大学医学院波士顿儿童医院Yao Wei Lu博士为并列第一作者。浙江大学医学院附属第二医院陈静海研究员、王建安教授、美国南佛罗里达大学心脏研究所王大之教授为论文的共同通讯作者。该项目得到国家自然科学基金、浙江省自然科学基金、中国博士后科学基金等项目资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.122.061192
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言