神经肌肉阻滞管理:循证原则和实践
2024-03-11 重症医学 重症医学 发表于上海
本文综述了麻醉师协会(AoA)、美国麻醉师协会(ASA)和欧洲麻醉学和重症监护协会(ESAIC)的最新指南,以及与临床实践相关的神经肌肉生理学和药理学的关键方面。
重点:
近期指南涉及神经肌肉阻断药物和拮抗剂的监测。
残余神经肌肉阻滞是常见的,并未被识别会对患者导致伤害。
从神经肌肉阻滞中恢复需要经过校准的TOF比≥0.9。
定量监测对于优化手术条件和避免残余神经肌肉阻滞至关重要。
与新斯的明相比,舒更葡糖的拮抗作用更容易预测,但如果没有定量监测,则不能保证恢复。
神经肌肉阻滞的监测和逆转已被广泛地回顾,包括在本杂志。尽管20世纪80年代引入了中期神经肌肉阻滞药物(NMBDs),2008年引入了逆转剂舒更葡糖,并且越来越多的定量神经肌肉监测仪用于临床实践,但神经肌肉阻滞(NMB)和残留阻滞的管理问题仍然存在。本文综述了麻醉师协会(AoA)、美国麻醉师协会(ASA)和欧洲麻醉学和重症监护协会(ESAIC)的最新指南,以及与临床实践相关的神经肌肉生理学和药理学的关键方面。一种临床实践策略是对所有接受神经肌肉阻断药物的患者使用定量神经肌肉监测,并为神经肌肉阻断拮抗剂提供指导。这些信息主要用于指导成年患者的围手术期护理,但这些原则同样适用于儿科患者和重症监护。
神经肌肉阻滞管理指南
经过数十年的证据、专家意见和编辑评论,美国AoA、ASA和ESAIC发表了三篇具有里程碑意义的论文。这些出版物突出的主题是,当患者接受神经肌肉阻断药物时,需要对神经肌肉进行定量监测。AoA监测标准的第6版(2021年)是一份共识文件,其中声明:无论何时使用神经肌肉阻滞药物,从神经肌肉阻滞开始之前到确认四组(TOF)比例恢复到> 0.9,整个麻醉阶段都应使用定量神经肌肉监测。该指南进一步要求所有接受神经肌肉阻滞药物治疗的患者都要配备定量监测设备。
ASA成员的一个工作组已经制定了关于神经肌肉阻滞管理的临床实践指南(2023),根据现有证据的强度提出了8项建议。对于最佳麻醉护理,专家组强烈建议定量监测而不是使用临床体征或定性外周神经刺激器(PNS),使用拇内收肌进行神经肌肉监测,并建议不要监测眼肌对面神经刺激的反应。
ESAIC工作组(2023)同时根据三个关键主题制定了神经肌肉阻滞围手术期管理指南:神经肌肉阻滞药物促进气管插管的必要性;深度阻滞对腹部手术预后的影响以及最佳诊断和治疗残余神经肌肉阻滞的策略。关于残留神经肌肉阻滞的风险和对患者的伤害的关键发现完全符合ASA指南,并呼吁“使用尺神经刺激和拇内收肌定量神经肌肉监测来排除残留麻痹。”这两份指南都提供了舒更葡糖和新斯的明的拮抗作用和剂量建议的指导,依赖于阻断水平,并以定量监测为基础。然而,这两个指南都没有涉及到儿科或重症护理人群的神经肌肉管理。
回顾主要的药理学原理
神经肌肉阻滞水平的定义
在使用定量监测时,神经肌肉阻滞的深度可根据四组比值(TOF比)、TOF计数和强直后计数(PTC)来定义(图1)。这使得在理解应用药理学及其与安全临床护理的相关性上保持一致性。上腹部肌肉、喉部和膈肌的放松需要完全(PTC =0)或深度(PTC ≥1,TOF计数=0)的神经肌肉阻滞。尽管证据存在相互矛盾,腹腔镜手术中深度神经肌肉阻滞可能改善手术结果。在许多研究中,使用深度阻滞的患者的手术条件得到了改善(PTC=0-5),但临床效益是有限的,研究的缺点也很明显,相反,个性化滴定的深度神经肌肉阻滞最好由监测和手术条件指导。在大多数手术中,只要保持足够的麻醉水平,适度阻滞(TOFC=1-3)可能足以使患者保持不动。
相反,在大多数手术中,个体化滴定的深度神经肌肉阻滞最好在监护和手术条件指导下进行,如果维持足够的麻醉水平,适度阻滞(TOFC¼1e3)可能足以使患者保持不动。咳嗽、呼吸困难和其他不自主运动可通过加深麻醉水平(使用额外的挥发性麻醉剂、异丙酚或阿片类药物)来解决。在给予额外的神经肌肉阻滞药物之前,应确认麻醉是否充分,包括使用经过处理的脑电图。第五次国家审计项目(NAP5)关于全身麻醉下意外意识的研究强调了在神经肌肉阻滞期间确保充分麻醉的必要性。在TOF序列的第4次抽动返回时,可以定义两个级别的阻滞:浅阻滞(TOF比<0.4)和最小阻滞(TOF比0.4-0.9)(图1),拔管患者即使在最小阻滞时,也有多种症状和体征,例如出现肺活量和握力降低、吞咽障碍、吸入性风险增加、上气道阻塞、复视、主观虚弱感、延迟恢复和化学感受器介导的缺氧反应降低。当TOF比例恢复到0.9时,就可以达到可接受的恢复,但即使TOF比例=1.0,大多数突触后受体仍然被神经肌肉阻断剂占据;因此,用力肺活量仅部分恢复,急性缺氧通气反应较正常下降
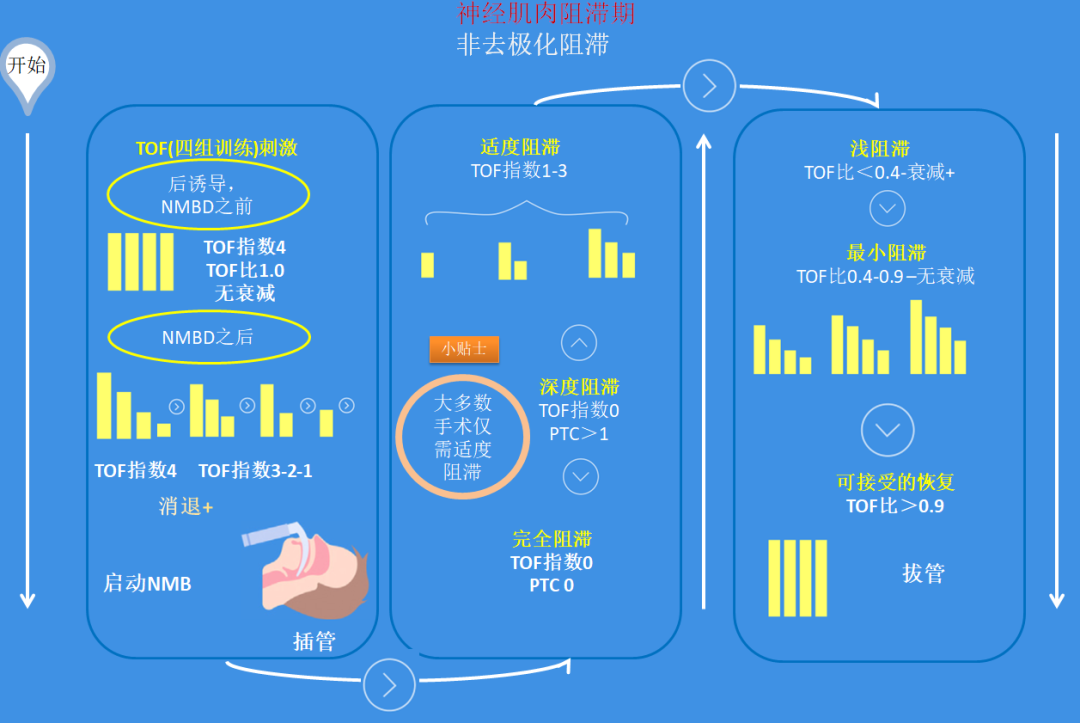
表1:神经肌肉阻滞的阶段。完全阻滞(PTC=4),深度阻滞(PTC≥1,TOF计数),中等阻滞(TOF计数=1-3),浅阻滞(TOF比<0.4),最小阻滞(TOF比=0.4-0.9),恢复(TOF比>0.9),NMB:神经肌肉阻滞;NMBD:神经肌肉阻断药物;PTC:搐搦后计数;TOF:四个成串刺激;TOF计数:四个成串刺激计数;
肌肉敏感度差异(图2)
喉部、膈肌、上腹部和上睑提肌对神经肌肉阻滞表现出相对的抵抗力。它们丰富的血液供应保证了非去极化神经肌肉阻滞的快速发作(冲刷),但峰值效应有限,会恢复迅速(冲刷)。相比之下,最敏感的肌肉(眼肌、咽肌和颏舌肌)恢复得最慢。其他因素,如突触后受体的数量相对于纤维大小,也会导致肌肉敏感度的差异。恢复不充分的迹象包括复视、吞咽困难、颏舌肌无力,并导致上呼吸道阻塞和肺误吸的风险增加。拇内收肌和眼轮匝肌反应显示出相似的敏感性。尺神经/拇内收肌单元被推荐用于定量神经肌肉阻滞监测,因为它易于接触手部,并且与大多数敏感肌肉的恢复密切相关,提供了额外的安全水平。
神经肌肉阻断药物的药效学变化
神经肌肉阻滞药物的药效学差异阻滞起效时间和恢复时间差异很大。标准插管剂量罗库溴铵2* ED95预期起效时间为2 ~ 3分钟; (ED95=减少基线抽搐高度95%所需的药物量),但受多种因素影响:年轻、女性、快速注射速度、药物联合使用、与麻黄碱合用等均可缩短起效时间;而艾司洛尔会增加时间。神经肌肉阻滞的持续时间可能随着年龄、女性、怀孕、合并肾病或肝病以及镁、艾司洛尔和氨基糖苷类抗生素等药物的使用而延长。尽管存在这些因素,但在抽动时间和TOF比降低和实现插管的理想条件方面存在很大的差异。恢复时间也有很大差异。单次插管使用维库溴铵、罗库溴铵或阿曲库溴铵2小时后,37%的患者TOF比值<0.9,11%的患者TOF比值<0.7。
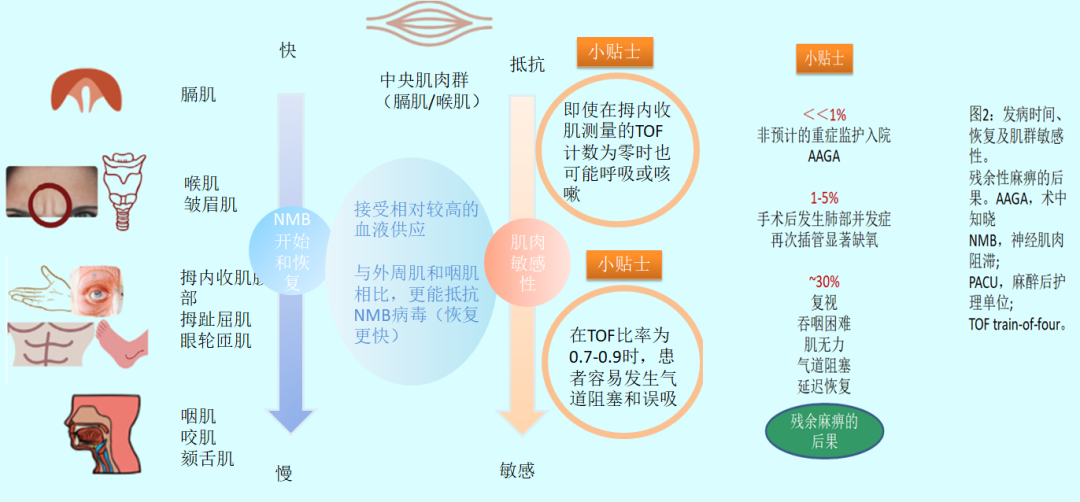
表1:肌群的反应时间、恢复和敏感性。残余麻痹的后果。AAGA:术中知晓;NMB:神经肌肉阻滞;PACU:麻醉后护理病房;
顺阿曲库溴铵的中位(范围)作用时间为57 (37-81) min,罗库溴铵为63 (33-119) min,维库溴铵为62 (35-137) min,提示部分患者神经肌肉阻滞药物作用时间易变且常延长。即使是小剂量的罗库溴铵(20-25mg,或1*ED95)也可能导致多达20%的患者在2小时后不完全自发恢复。认识到肌肉敏感性的差异,可以解释为什么患者仍然对喉镜和插管有反应,为什么即使测量的拇内收肌TOF比率降低到零,这些反应仍然可能出现,以及为什么“基于时间的”插管(或拔管)准备情况的决定是有缺陷的。在整个麻醉过程中进行监测,可以根据不同的神经肌肉反应,了解患者之间的差异。
监测以优化和防止残留的神经肌肉阻滞
目前对残余神经肌肉阻滞的定义是TOF <0.9;其发病率范围为0% - 90.5%(中位数30%)加拿大的RECITE研究(在加拿大注册舒更葡糖之前进行)显示,在气管拔管时,残余神经肌肉阻滞率为65%,患者的治疗由麻醉师进行管理,使用新斯的明和对周围神经刺激器(PNS)反应的主观(定性)。一项对40年来53项研究和12664名患者的荟萃分析显示,在没有神经肌肉监测(由临床医生经验和患者临床症状指导管理)的情况下,残留神经肌肉阻滞率为33.1%,而在使用定性评估时,残留神经肌肉阻滞率为30.6%。临床康复试验(持续抬头、持续握力、压舌试验)都不能可靠地检测残留的神经肌肉阻滞。敏感度为10-30%,阳性预测值(精密度)~50%,除非TOF比值<0.4,否则残留神经肌肉阻滞不能排除,会使患者受到相当大的伤害。使用PNS可以主观(触觉或视觉)检测TOF计数和PTC,但仅通过评估第四次抽搐与第一次抽搐(T4/T1)反应的减退来恢复估计是不可靠的。虽然使用PNS可以检测到中度(TOF计数1-3)和深度(PTC >1)阻塞,但不能通过主观(非定量)手段确定是否准备好拔管(定义为TOF比值>0.9)。诸如“存在四次强烈抽搐”或“没有消退”这样的说法显然是错误的,并不能保证充分的神经肌肉恢复。当TOF比为>0 .4时,主观评价(视觉或触觉手段)不能可靠地检测出阻滞消退,而当采用主观监测时,会产生较大的差距(TOF比0.4-0.9)。只有在使用TOF比率的定量测量时,才能了解这种消退程度,当使用双爆刺激(DBS)时,当DBS (或TOF)比值为> 0.6时,不能可靠地检测到两种微强直反应的第二次消退。虽然使用主观手段时,DBS(TOF比0.6-0.9)比TOF (TOF比0.4-0.9)的差距更小,但两种模式都不能安全可靠地确定恢复的充分性,应放弃使用他们(图1)。
定量监测
加速肌图(AMG)和肌电图(EMG)监测是临床上最适用的监测方法。目前既有独立的便携式设备,也有集成到广泛使用的患者监测系统中的设备。
AMG肌肉加速度描记图法
虽然TOF-Watch不再在商业上可用,但它是第一个广泛应用于临床实践的设备,并已根据肌力描记术(MMG)的“黄金标准”进行了评估。加速肌力仪利用牛顿定律的原理:F=ma。当压电传感器应用于拇指(固定质量)并受到刺激时,刺激反应的加速度与收缩力成正比。合成电信号被处理并显示为数值/比率。使用AMG有一些注意事项。首先,必须允许拇指不受阻碍地移动,否则读数不准确,例如,当手臂被塞在手术单下时,并且在手术中无法触及时。在决定采取行动(需要补充剂量,确定阻滞水平,确保逆转后恢复)之前,应始终以15秒的间隔进行两次或三次连续TOF测量(图2)。其次,与MMG和EMG不同,基线TOF比率往往超过1.0(100%),最高可达1.4(140%)。这种“反向消退”是该技术的一个特性,因为超最大电流(刺激)应该总是诱导最大的响应(图3)。这一机制尚不确定,但可能是因为每次TOF刺激后拇指的弹性后坐力没有回到基线。因此,在神经肌肉阻滞前,AMG设备应以基线(超最大值)值进行校准,并“归一化”,以确定恢复的目标比值为0.9。例如,基线值为1.2,恢复到0.9需要1.08的比率。一些AMG设备将该比率限制在1.0(100%),并将TOF比率计算为第四个刺激(T4)与第二个刺激(T2)的比较,或T4/T2比值,而不是典型的T4/T1比较。在临床实践中,这些操作可能会产生相对较小的差异,但它们呈现了AMG衍生值的局限性。也有证据表明AMG先于肌电恢复,对于AMG,恢复到0.95或以上是必需的,以避免术后肺部并发症,ESAIC指南建议在使用原始(未校准的非标准化)比值时恢复到1.0。新一代的AMG设备通过使用三向传感器来提高准确性,这可以解释拇指内收在尺神经刺激下的多向运动。一些制造商声称他们的产品不需要校准。实际上,使用AMG的TOF比值应该尽可能接近1.0,因为即使在这个恢复水平,大多数(>75%)突触后受体仍然被阻断。尽管存在这些问题,因为其应用和使用简单,AMG监测仪仍被广泛使用,广泛的证据基础显示其优于周围神经刺激治疗的临床和定性方法
肌电图学
肌电图装置测量肌肉动作电位波形曲线下的峰对峰幅度或面积,以测量反应强度。肌电图和MMG监测是紧密匹配的。使用电子信号比使用机械信号有许多优点。肌电图更准确地反映了神经肌肉接头处的反应(所有神经肌肉阻滞剂都起作用的地方),不受肌肉收缩力和反应的变化影响与手的位置和拇指的运动无关。低温确实会影响肌电反应(但小于AMG或MMG),手术电灼的干扰也是如此。尺神经刺激的反应可在拇内收肌、小指外展肌和第一背侧骨内肌测量。现在市面上已经有几种肌电图设备。这需要专有的刺激记录条的使用和放置,易于使用,快速校准,并提供精确的“接近黄金标准读数”。在TOF比率为> . 0.9时,目标回收率是可以接受的。肌电图监测是“理想的定量监测”,这是专家组基于证据的共识。
其他监测方式
运动学(KMG)测量放置在拇指和食指之间的压电传感器对尺神经刺激的变形(与收缩力成正比)。它受到很大的偏差影响,其一致的限制是广泛的,和AMG一样,它是位置依赖的,尽管没有相关的反向消退。
TOF-袖带(RGB医疗设备)使用了一种压缩肌压描记术,在一个血压袖带中集成了刺激和记录传感器;它测量上臂肌肉对臂丛神经的神经刺激的反应。AMG和EMG显示,起始和恢复与尺神经的反应无关,似乎更密切地反映了抵抗性中枢肌肉,包括喉部和膈肌。
监测位点
最近的指南已经确定了常规临床实践中神经肌肉阻滞监测的理想位置;拇内收肌对尺神经刺激的反应最适合于围手术期监测。这最接近敏感肌肉群,且需要更长的恢复时间。可以使用胫骨后神经刺激,但拇短屈肌的恢复时间与拇内收肌的恢复时间可能相差几分钟。面神经不宜应用于监测。ASA的实践指南强烈建议不要使用眼肌来进行神经肌肉监测。如果对面部肌肉进行监测,则有必要降低刺激电流,以减少直接刺激肌肉的风险。此外,一些眼部肌肉对神经肌肉阻滞药物的相对抗性可能会错误地表明存在神经肌肉传递,从而导致过量剂量用药。当情况和事实相反时,可能会有充分恢复的假象,导致过早觉醒和气管拔管。面神经残留神经肌肉阻滞的风险是尺神经监测的5倍,如果在麻醉过程中监测面神经,则应在手术结束、唤醒患者和拔管前测量尺神经反应。
逆转神经肌肉阻滞的药物
新斯的明
新斯的明是一种抗胆碱酯酶药物,需要与格隆溴铵或阿托品联合使用以对抗其毒蕈碱作用。新斯的明的特点是有天花板效应,一种可变(且缓慢)的拮抗作用,需要高水平的自发恢复才能保证安全(完全)的拮抗作用。给药(无论是氨基甾体类药物还是苄基异喹啉类药物)取决于逆转时的阻滞水平,并应根据患者的实际体重。对于最小阻滞(TOF比>0.40)的拮抗作用,新斯的明推荐剂量为30µg /kg , 10分钟内可达到最大拮抗作用(图3)。在存在中等(TOF计数1-3)或较浅(TOF比<0.4)的阻滞作用时,新斯的明逆转时间可能会延长,并且必须伴有定量监测以证明有足够的恢复。新斯的明的最大剂量为50µg/kg,逆转可能需要一个可变周期(20-30分钟)。研究人员比较了使用新斯的明逆转时,在肢体再次出现1-4次抽搐时的TOF比率,测量了使用MMG达到TOF比0.9的时间。在第四次抽搐重现时,平均时间为10分钟,但范围为5-26分钟。接受静脉注射的病人麻醉后10分钟全部恢复,相比之下,接受七氟醚治疗的患者只有60%在十分钟内恢复,
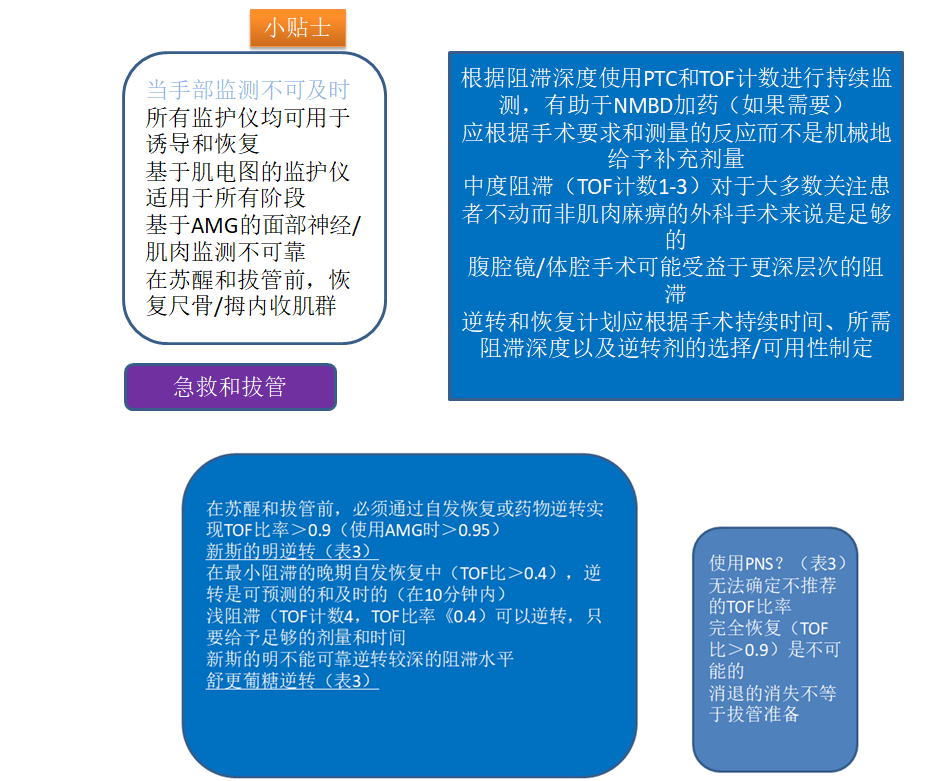
当拮抗剂的自发恢复达到晚期水平(TOF比>0.4)时,新斯的明或舒更葡糖的逆转同样有效且可预测,且可预测在自然恢复的高级水平(TOF比0.4)给予拮抗剂。ASA和ESAIC指南都建议,只有在达到尽可能高的恢复水平后,才使用新斯的明进行逆转治疗,最好是最小的阻断水平(TOF比>0.4),但至少,一旦TOF比值恢复到0.2,定量监测对于在觉醒和拔管前提供充分恢复的确定性是必不可少的。
关于使用新斯的明的一个有趣的观察和关注是,当给予高水平新斯的明恢复时,存在去极化型阻滞的风险。这在清醒的志愿者当中得到了证实,会存在持续20-30分钟的不愉快的虚弱感。
与安慰剂相比,新斯的明逆转(40µg/kg)对使用1*ED95 剂量罗库溴铵后自发恢复到TOF 比率大于0.9的患者的影响已被报道,对肌肉力量没有影响;事实上,在恢复过程中,全身肌肉无力得到了改善。这可能反映了这样一个事实,即在TOF比为0.9时,高达75%的神经肌肉接点受体仍可能被非去极化神经肌肉阻断药物占据(图3)·。小剂量的新斯的明会增加乙酰胆碱受体的占用;相反,清醒的“未瘫痪”患者可能会经历由无对抗的乙酰胆碱受体活动引起的胆碱能型虚弱。
舒更葡糖
舒更葡糖是一种选择性的氨基类固醇结合剂,允许剂量依赖性逆转罗库溴铵和维库溴铵诱导的阻断,但不拮抗异喹啉(阿曲库铵,顺阿曲库铵)神经肌肉阻断药物。它的特点被描述得很好,舒更葡糖比新斯的明逆转速度更快:中度阻滞2vs12.9分钟,深度阻滞2.9vs48分钟。制造商推荐的逆转剂量为:当PTC =0(抢救逆转)时为16 mg/kg,深度阻滞为4 mg/kg (PTC 1-2),中度阻滞为2 mg/kg(TOF计数≥2)。剂量研究已经测试了最小阻滞(TOF比>0.5)和浅阻滞(TOF比0.2)的逆转所需的舒更葡糖。5 min内达到TOF比>0.9所需的舒更葡糖剂量分别为0.22 mg/kg和0.49 mg/kg。尽管提供了更快和更多可预测的反应,在没有定量监测的情况下,使用舒更葡糖并不能保证充分的恢复。根据“临床评估”给药时,有报道称4.3%的TOF比值<0.9(可信区间1.7-9.4%)。其他研究人员检查了术中使用周围神经刺激的老年患者术后肺部并发症的发生率,发现使用舒更葡糖的残余神经肌肉阻滞率为10%;尽管与新斯的明相比,使用舒更葡糖后残留神经肌肉阻滞的发生率较低,但在没有定量监测指导的情况下逆转并不保证避免残留神经肌肉阻滞。
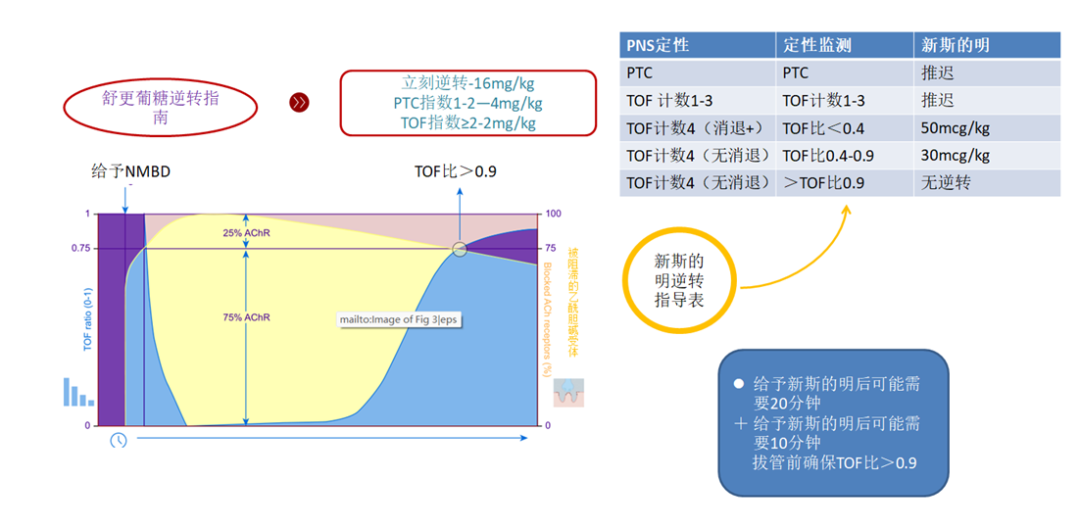
表3:乙酰胆碱受体占用率和四连续刺激比率。新斯的明和舒更葡糖的逆转指导。蓝色:TOF比;黄色:乙酰胆碱受体占据率;该图显示,当TOF 比值为0.9 时,多达75%的乙酰胆碱受体可能仍被占据,这表明神经肌肉传导的安全系数很大。AChR,乙酰胆碱受体;NMBD,神经肌肉阻滞药;PTC,强直后计数;
舒更葡糖和新斯的明的药物不良事件
向FDA报告的严重心脏不良事件数据显示,2015年引进舒更葡糖后,心动过缓和心搏停止的报告病例有所增加。然而,一项大型回顾性队列研究显示,89,753例患者(18%接受舒更葡糖;82%的新斯的明),发现主要不良反应(心动过缓、心搏骤停、支气管痉挛、过敏反应)在临床上无显著差异。志愿者研究表明,过敏反应的发生率很高,特别是在大剂量时。日本广泛使用舒更葡糖的经历引起了人们对过敏反应风险的担忧。据报道,“罗库溴铵-舒更葡糖”联合用药的过敏反应发生率为1:50 000。人们担心,随着舒更葡糖使用量的增加,尤其是在专利期满后,随着成本的降低和更广泛的使用,会出现过敏反应的风险。考虑到这些主要并发症发生在手术结束时、在苏醒和拔管时存在挑战,因此需要保持警惕。考虑到舒更葡糖对心率的影响,应在定量监测的基础上限制给药剂量,并在给药后继续进行心电图监测。舒更葡糖不推荐用于逆转疑似罗库溴铵引起的过敏反应。还有其他并发症的报告,包括支气管痉挛、喉部痉挛、“减轻麻醉”,以及已知的药物相互作用,包括孕激素捕获,对使用含孕激素避孕药的人有影响。这进一步说明,没有药物是没有副作用和并发症的,以及药物只有被需要时才应用,并且应使用正确的剂量。
残余神经肌肉阻滞和术后并发症
残余的神经肌肉阻滞和它对术后恢复的影响之间的联系是很确定的。大规模队列研究表明,使用神经肌肉阻滞药物与不良后果有关,定量监测可减少残留神经肌肉阻滞、缺氧发作、气道支持的需求、气管再插管、复苏室和住院时间。也有证据表明,如果避免残留的神经肌肉阻滞,可以减少术后肺部并发症,如肺炎、呼吸衰竭和计划外再插管。来自于POPULAR的观察研究的最初数据表明,随着神经肌肉阻滞的实施,使用神经肌肉阻滞药物与术后肺部并发症的发生率增加有关。作者最初无法将神经肌肉监测(使用AMG或周围神经刺激)与降低肺部并发症的风险联系起来。然而,对数据的再分析表明,在接受AMG定量监测的患者中,气管拔管前TOF比> 0.95时,术后肺部并发症的风险降低。这表明,当定量监测被适当使用时,对术后肺部并发症是有好处的。
确保气管拔管前完全恢复的其他有益效果包括避免术后肌肉无力。进行术中定量监测的成人患者整体虚弱程度明显低于接受主观监测的患者,并且认为其恢复质量优于主观监测的患者。儿科外科患者也有报告出现残余神经肌肉阻滞(28%的TOF比率<0.9),而6.5%的患者报告出现严重残留神经阻滞(TOF比<0.7)。已有报道指出肌电图监测在儿童术中的可行性和方便性
神经肌肉阻滞拮抗与术后并发症
几项大型回顾性队列研究调查了与新斯的明相比,使用舒更葡糖是否能降低术后肺部并发症的风险。在STRONGER研究中,22,856名接受舒更葡糖的患者与接受新斯的明的匹配队列患者进行了比较,结果显示复合肺部并发症的发生率降低了30% (3.5% vs 4.8%)。相比之下,其他研究发现,在肺并发症发生率方面没有差异,包括引入舒更葡糖后的观察性队列研究。可能解释结果差异的潜在混杂因素是,不同研究对术后肺部并发症的定义不同,定量神经肌肉监测的应用也不一致。这些回顾性研究是在引入各种安全措施的时期内进行的,包括:肺保护性通气、术前识别高危患者、建立早期动员和加强康复计划。由于需要大量的患者,不太可能进行明确的前瞻性研究。然而,越来越多的证据表明,适当的定量神经肌肉监测使用和靶向拮抗,无论使用何种药物,都可以避免残留的神经肌肉阻滞及其有害的临床影响

临床实践指南
实用的神经肌肉阻滞治疗方法需要了解所综述的药理学和生理学,在患者接受神经肌肉阻滞药物时使用定量神经肌肉监测仪,了解不同监测模式的属性,以及灵活的个体化方法,考虑了不同的患者和手术因素(图4)。关于执行和监测的位置需要与外科团队相沟通。神经肌肉阻滞的方法应以药物给药为目标,包括加药要求,基于客观监测,而不是依靠死记硬背或计时。
结论
残余的神经肌肉阻滞分布广泛,常常无法测量和观察到。作为平衡麻醉技术的一部分,需要一种管理神经肌肉阻滞的策略,神经肌肉阻滞及其逆转需要定量监测。这一策略将取决于患者相关因素和手术因素,以及药物的可得性,例如,是否可得舒更葡糖。这种策略的实施需要有改变实践的意愿,接受文献中的证据和个体从业者的时间投入。改变现行的(不充分的)实践需要麻醉部门的拥护和领导,需要持续的培训、教育、审核和质量倡议。尽管最近的国家和国际指南将有助于指导未来成人患者的神经肌肉监测和管理实践,但类似的指南在其他具有术后并发症显著风险的患者群体中严重缺失(儿科和ICU患者)。消除残余神经肌肉阻滞的目标是可以实现的,并将对患者的质量和安全带来重大好处
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#神经肌肉阻滞# #NMB#
49