益生菌具有调节免疫系统功能和肠道菌群平衡的作用,是促进营养吸收和保持肠道健康所需的有益活性微生物。
一直以来,口服是最直接和便捷的益生菌补充方式。但是历经炎症肠道独特的病理微环境,益生菌的效果常常被打折扣。
为此,浙江大学高分子系毛峥伟教授联合新加坡国立大学陈小元教授和浙江大学医学院附属第二医院王伟林教授团队,以人体所需的双歧杆菌为代表,首次构建了益生菌/人工酶复合材料,有效提高益生菌在氧化应激的炎症微环境中的存活和增殖,进而提高其在炎性肠道中的定植和菌群调控能力,为肠炎治疗提供新策略。
这一研究于北京时间3月27日,被《自然》子刊《纳米科技》在线报道,第一作者为曹芳芳博士,共同通讯作者为毛峥伟教授、陈小元教授和王伟林教授。
益生菌“益”在哪?
肠道是一个多细菌共存的器官。定植在肠腔内的细菌包括益生菌、有害菌以及共生菌,其中益生菌不具有致病性,主要负责修复肠黏膜,抑制有害菌增长,维持肠道菌群平衡。
人体的益生菌被称为驻守肠道的“护卫军”,当人体免疫系统与有害菌进行斗争时,他们各司其职。发现有害菌的“哨兵”会让“通信兵”第一时间向免疫细胞传递信息,以便快速且有针对性地发起进攻,“工兵”则积极修复肠粘膜,维持肠道菌群的稳态。
口服益生菌首先要抵御胃酸、胆汁等物质的侵蚀,才能安全抵达肠道。此前的科学家旨在利用“盔甲”在益生菌表面形成一道物理屏障。
然而,现有的物理屏障对直面战火的“护卫军”如同“赤膊上阵”。每当遇到来势汹汹的侵略时,有害菌会分泌的大量有害物质让益生菌失去活力。免疫细胞则会通过释放大量活性氧进行杀菌,同时也让无法适应氧化应激的益生菌纷纷凋敝。
为此,如何让益生菌免于战火,更好发挥效用成为了浙大团队研究的突破口。
新铠甲“新”在哪?
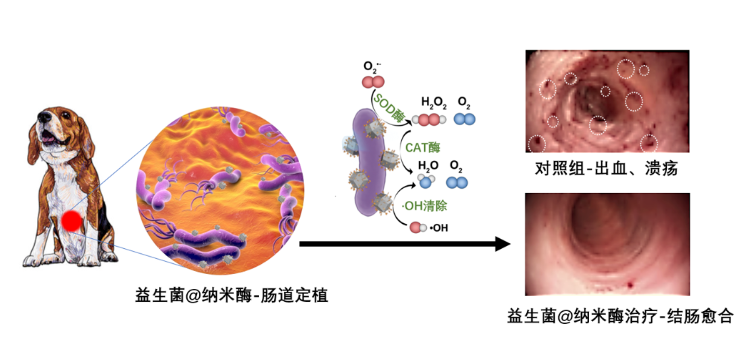
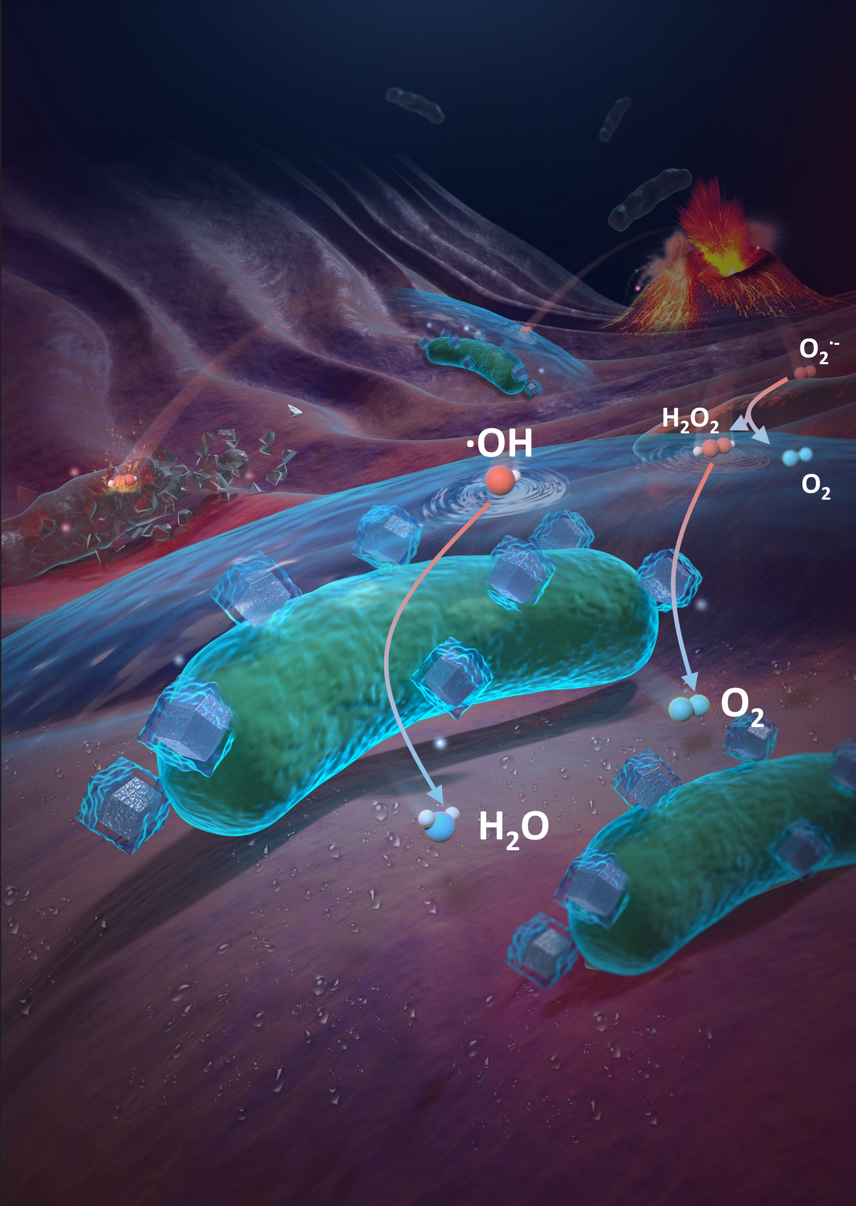
益生菌不耐氧,浙大研究人员以益生菌中常见的双歧杆菌为代表,发现其因为缺乏超氧化物歧化酶、过氧化氢酶等一系列代谢酶而无法自主清除活性氧自由基。
“我们大胆设想用人工方式把这些代谢酶与益生菌结合,使益生菌可以自主代谢有毒物质变成对其无毒的产物。”毛峥伟介绍,这种策略可以有效提高益生菌在炎症肠道中的存活,发挥其维持肠道菌群平衡、修复肠黏膜等功能。
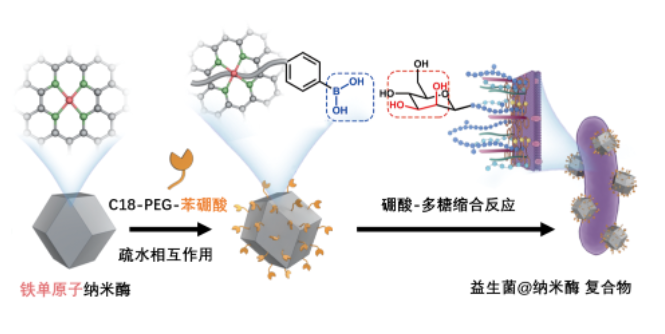
为此毛峥伟和陈小元团队合作,选择了具有多酶催化功能的Fe/C基单原子纳米酶(B-SA),首次构建益生菌/纳米酶活性复合材料,新型铠甲的研制让益生菌更好地抵御免疫反应中的“战火”。
如何把这件新铠甲穿到益生菌身上呢?
毛峥伟团队在B-SA上修饰苯硼酸基团,利用硼酸与细菌表面多糖邻二醇的超分子作用,在温和条件下实现B-SA与双歧杆菌的复合,最大限度保留了益生菌和人工酶的活性。
后续研究中,毛峥伟和王伟林团队合作,在多种小动物的结肠炎模型和比格犬的大动物模型中开展验证性实验。他们发现,益生菌/人工酶复合材料均比益生菌和人工酶的混合物、以及临床上一线药物联合疗法具有更好的炎症治疗效果和促肠道菌群平衡的作用。
益生菌/人工酶复合材料结构和功能示意图
走向临床还有多远?
“要治愈肠道炎症,包括肠易激综合征、溃疡性结肠炎、克罗恩病等,最主要的是消除炎症和恢复肠道菌群的平衡。”王伟林说,“我们的治疗策略可以同时起到消除炎症和恢复肠道菌群平衡的作用。”
从国内情况看,益生菌疗法已经进入临床,益生菌的产业化具有稳固的基础,其安全性也得到了验证。而对于纳米酶,其具有安全、催化效率高、稳定、经济和规模化制备的特点,也可实现稳定地批量生产。
因此,毛峥伟对这项研究的未来充满信心。他说,基于产业化潜力与应用安全性,团队将积极把益生菌/人工酶复合材料推向临床应用。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













