CFDA全面接轨FDA,年底试行药品电子通用技术文档系统(eCTD)
2017-07-30 MedSci MedSci
2017年5月30日,CFDA药品审评中心的工作人员却并未休息,两部关于eCTD(药品电子技术通用技术文档)的征求意见稿选择在这一天发布,分别是《药品电子通用技术文档机构(征求意见稿)》以及《化学仿制药电子通用技术文档申报指导原则(征求意见稿)》。这也是既毕井泉局长在2月27日国务院新闻发布会上透露将建立eCTD系统并争取2017年底能够实现按新系统实行电子申报和审评以来,在推行eCTD进程方
2017年5月30日,CFDA药品审评中心的工作人员却并未休息,两部关于eCTD(药品电子技术通用技术文档)的征求意见稿选择在这一天发布,分别是《药品电子通用技术文档机构(征求意见稿)》以及《化学仿制药电子通用技术文档申报指导原则(征求意见稿)》。这也是既毕井泉局长在2月27日国务院新闻发布会上透露将建立eCTD系统并争取2017年底能够实现按新系统实行电子申报和审评以来,在推行eCTD进程方面所公布的第一个实质性举措。药审中心也表示,此举是贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》中关于eCTD的相关要求,组织信息、药学、药理毒理、临床、统计和临床药理学等专业审评人员来起草征求意见稿,社会各界有建议或修改意见可通过电子邮件进行反馈。
作为在国外已经逐步推行的药品审评中的资料提交方式,eCTD在中国的推行注定是药品注册进程中的一项关键性革命,同时也是与国际接轨的必经之路。征求意见稿的出台则让中国药审进入eCTD时代的一天变得清晰可见。
1、什么是eCTD?
所谓eCTD,即Electronic Common Technical Document的缩写,翻译为中文为“药品电子技术通用技术文档”,即药品的质量、安全和有效性方面的通用文件。这是制药企业向药物监管机构进行信息传输的一种形式,其内容需满足通用技术文件(CTD)的要求。
一般而言,eCTD电子递交流程大体上可以分为三个阶段,即撰写、文档编辑与提交。申请者首先要将各类资料、数据、实验数据等进行撰写,之后由第三方专业编辑服务外包商来根据相关法规要求构建eCTD结构化文档,再由申报负责人通过事先建立好的电子传输通道,将申报文件提交至药监部门。在整个过程中,便捷、高效、规范、环保是其主要特点,因此eCTD(药品电子技术通用技术文档)因其在药品注册申报环节中的诸多优势而受到美国、日本等国家药审部门的青睐。
eCTD正成为全球药品注册申报的重要趋势,这是因为其在创建、传输、复制、审阅、检索、存档以及文件生命周期管理等方面存在诸多优势。具体而言,对于申请者来说,如一个产品在多个市场申请,则部分资料可以进行共享,大大降低成本并提高效率,对于审评者而言,eCTD资料的审阅、管理、传输以及归档十分便捷,eCTD格式同时也利于各个国家和地区的药监部门的审评意见交流。
相比较传统的纸质文件递交,eCTD格式的电子申报具有高效率、方便查看/导航、可快速溯源、实现生命周期管理、节约纸张等优势。
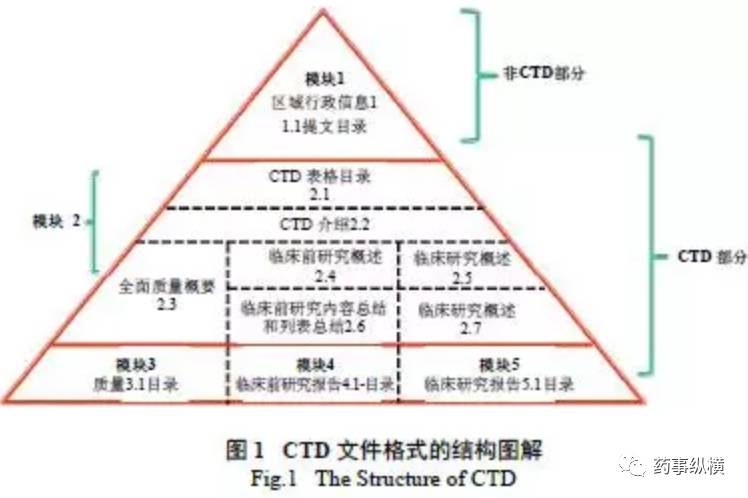
eCTD格式包含了CTD格式内容+模块1(见下图)。模块1的内容及要求根据申报的国家和地区各不相同,模块2~4国际通用。
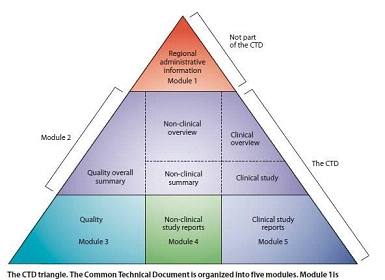
图:eCTD格式内容
2、中国eCTD进行时
同国外相比,中国eCTD的进程无疑要慢许多,但随着国务院《关于改革药品医疗器械审评审批制度的意见》中明确提及eCTD以及食药监总局毕井泉局长在国务院新闻发布会上的表态,中国的eCTD进程已有了显著加速。
2017年2月7日,毕井泉局长在国务院新闻发布会上进行讲话,其中就提及要建立建立eCTD系统并争取2017年底能够实现按新系统实行电子申报和审评。这是官方第一次在公开场合提及eCTD并给出了初步时间表。
而此次CDE所出台的文件则使eCTD的进程更为清晰。征求意见的《药品电子通用技术文档结构》同国际标准一样分为五个模块,分别为:行政管理信息;总结与综述;质量资料(药学);非临床研究报告(药理毒理学);临床研究报告,对要提供信息的具体结构进行了明确划分,以帮助企业进行申报。
然而,由于编辑制作eCTD格式文件往往较为复杂,并非所有的企业都有能力与精力来完成自己产品的eCTD申报,在这种情况下,专业的第三方eCTD外包服务商便迎来了发展春天,对于一些申报产品不多的小型生产企业,或是申报数量巨大的大型跨国制药公司,这类外包公司都将是优先选择。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













学习了,涨知识了
61
#eCTD#
86
#CFDA#
77
学习了受益匪浅
107
谢谢分享,学习了
99
很好
98
学习
86
学习谢谢分享
72