【论著】| 中国尿路上皮癌患者HER2表达及其与临床病理学特征的关联分析
13小时前 中国癌症杂志 中国癌症杂志 发表于陕西省
本研究拟进行一项大型的多中心全面调查,探究HER2在中国UC患者中的表达情况,并阐明HER2表达与UC患者临床病理学特征之间的关系,旨在为中国UC患者实现精准和有效的个体化治疗奠定理论基础。
[摘要] 背景:人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)与尿路上皮癌(urothelial carcinoma,UC)的疗效及患者预后密切相关。HER2是多种肿瘤的重要生物标志物和治疗靶点,抗HER2抗体药物偶联物对HER2高表达的UC患者具有显著的临床疗效,因此深入了解中国UC患者HER2表达及其特点,对于指导治疗决策、优化治疗方案和实现个体化治疗具有重要意义。本研究旨在充分探究中国UC患者的HER2表达情况及其与临床病理学特征的相关性。方法:本研究是一项多中心研究,回顾性纳入了中国5个地理区域(华北、华东、华南、华中和西北)共8个三甲医院的泌尿外科2023年1月—2024年3月采集组织样本的UC患者。纳入标准:① 年龄18岁以上;② 经组织病理学或细胞学检查确诊的UC;③ 需有肿瘤原发灶免疫组织化学(immunohistochemistry,IHC)检测HER2表达的完整资料。排除标准:① 已确诊合并其他部位肿瘤者;② 医师评估其他不适合纳入本研究的情况。收集患者的HER2 IHC检测结果及疾病信息,根据《中国尿路上皮癌人表皮生长因子受体2检测临床病理专家共识》的标准对HER2表达进行判读,将HER2 2+及3+定义为HER2高表达。分析HER2的表达情况及其与临床病理学特征的关联。本研究已获得复旦大学附属肿瘤医院医学伦理委员会批准(伦理编号:2301268-12),并于中国临床试验注册中心注册(注册编号:ChiCTR2300069746)。结果:共纳入1 054例UC患者,其中以膀胱UC为主(n=807,76.6%),平均年龄为(66.8±10.5)岁,多数(78.5%)患者为男性。HER2高表达率为58.4%(n=616),此外还有23%的患者为HER2 1+表达(n=242),少数(n=196,18.6%)患者为HER2零表达。HER2表达与多种临床病理学特征存在显著关联,包括美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、心脑血管疾病病史、脂代谢病病史、吸烟史、UC疾病部位、分化程度、病理学类型和肿瘤分期。结论:本多中心回顾性分析显示,中国UC患者中HER2表达普遍存在,高表达率达58.4%,并且HER2表达与多种临床病理学特征密切相关。因此,准确评估UC患者的HER2表达对于指导个体化治疗具有重要意义。
[关键词] 尿路上皮癌;人表皮生长因子受体2;临床病理学特征;中国
[Abstract] Background and purpose: Human epidermal growth factor receptor 2 (HER2) is closely associated with drug efficacy and prognosis in urothelial carcinoma (UC). HER2 is a significant biomarker and therapeutic target in various tumors. In recent years, anti-HER2 antibody-drug conjugates have shown significant clinical efficacy in UC patients with HER2 overexpression. Therefore, an in-depth understanding of HER2 expression and its characteristics in Chinese UC patients is crucial to guide treatment decision-making, optimize treatment strategies and achieve personalized therapy. This study aimed to thoroughly investigate correlation of HER2 expression and clinicopathological characteristics in Chinese patients with UC. Methods: This study was a multicenter study that retrospectively included UC patients from urology departments of 8 tertiary hospitals in 5 geographical regions of China (North China, East China, South China, Central China and Northwest) whose tissue samples were collected from January 2023 to March 2024. Inclusion criteria: ① age above 18 years; ② UC diagnosed by histopathological or cytological examination; ③ complete results of HER2 expression detection using immunohistochemistry (IHC) in the primary tumor site were required. Exclusion criteria: ① diagnosed patients with tumors in other parts of the body; ② physicians evaluated other situations that were not suitable for inclusion in this study. IHC results for HER2 expression and clinicopathological data were collected. HER2 expression was determined according to the criteria outlined in “Clinical pathological expert consensus on HER2 testing in urothelial carcinoma in China”, with HER2 2+ and 3+ defined as HER2 overexpression. The HER2 expression and clinicopathological features were analyzed. This study was approved by the medical ethics committee of Fudan University Shanghai Cancer Center (ethical number: 2301268-12) and was registered at China Clinical Trial Registry (registration number: ChiCTR2300069746). Results: A total of 1054 patients with UC were included. Most of the tumors were bladder UC (n=807, 76.6%). The mean age of patients was (66.8±10.5) years, and the majority were male (78.5%). The HER2 overexpression rate was 58.4% (n=616), with an additional 23% of patients having HER2 1+ expression (n=242), and a small proportion exhibiting negative HER2 expression (n=196, 18.6%). HER2 expression was significantly associated with various clinical and pathological characteristics such as Eastern Cooperative Oncology Group (ECOG) performance status, history of cardiovascular disease, history of metabolic disorders, smoking, UC disease location, differentiation grade, pathological type, and tumor stage. Conclusion: Retrospective analysis of multi-center data shows that HER2 expression is frequently observed in Chinese UC patients, with an overexpression rate of up to 58.4%. Furthermore, HER2 expression is closely associated with various clinical and pathological features of UC patients. This study underscores the critical importance of accurately assessing HER2 expression in UC patient to guide personalized therapies.
[Key words] Urothelial carcinoma; Human epidermal growth factor receptor 2; Clinicopathological characteristics; China
尿路上皮癌(urothelial carcinoma,UC)是泌尿系统中常见的恶性肿瘤之一,是起源于尿路覆盖上皮的恶变,而膀胱UC是主要类型,其中上尿路UC包含肾盂癌和输尿管癌,占所有UC的5%~10%[1]。2014—2020年中国膀胱UC的发病率从5.7/10万上升至5.9/10万[2]。晚期UC患者的预后较差[3],目前的治疗手段仍较为局限。近年来,研究发现了一些与UC相关的癌基因,如人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2),在UC中有不同程度的表达[4-5]。以HER2为治疗靶点的临床研究正在积极进行中[6],靶向HER2的抗体药物偶联物(antibody-drug conjugate,ADC)如维迪西妥单抗已在临床试验中取得了令人鼓舞的治疗效果[7]。
由于判读标准及检测试剂的差异等因素的影响,以往研究[8-9]报道,UC患者的HER2表达情况存在很大差异,而目前基于中国人群探究HER2表达与UC疾病特征之间关联的研究多为小样本单中心研究。鉴于HER2-ADC在UC中的卓越疗效,深入了解中国UC患者的HER2表达情况及其相关的临床病理学特征对于指导个体化治疗决策至关重要。因此,开展针对中国人群的相关研究将填补这一领域的空白。综上所述,本研究拟进行一项大型的多中心全面调查,探究HER2在中国UC患者中的表达情况,并阐明HER2表达与UC患者临床病理学特征之间的关系,旨在为中国UC患者实现精准和有效的个体化治疗奠定理论基础,并为临床实践和治疗决策提供科学依据。
1 资料和方法
1.1 研究对象
本研究是一项多中心研究,回顾性纳入了中国5个地理区域(华北、华东、华南、华中和西北)共8个三甲医院的泌尿外科2023年1月—2024年3月采集组织样本的UC患者。纳入标准:① 年龄18岁以上;② 经组织病理学或细胞学检查确诊的UC;③ 需有肿瘤原发灶免疫组织化学(immunohistochemistry,IHC)检测HER2表达的完整资料。排除标准:① 已确诊合并其他部位肿瘤者;② 医师评估其他不适合纳入本研究的情况。本研究已获得复旦大学附属肿瘤医院医学伦理委员会批准(伦理编号:2301268-12),并在中国临床试验注册中心完成注册(注册编号:ChiCTR2300069746)。
1.2 HER2的IHC检测
由各研究中心的病理科进行HER2的IHC检测,收集IHC检测的病理图像资料,根据2021年版《中国尿路上皮癌人表皮生长因子受体2检测临床病理专家共识》[10]对HER2表达情况进行判读,具体标准详见表1,评分0为HER2零表达,1+、2+和3+为HER2表达,其中1+为HER2低表达,2+和3+为HER2高表达。

1.3 临床和病理学资料来源
通过医院病历系统收集以下资料:人口统计学信息(年龄、性别、体重指数、吸烟及饮酒情况等),既往病史与伴随疾病(高血压、糖尿病及心脑血管疾病等),美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分,肿瘤病理学检查结果(病理学类型、分化程度、TNM分期及原发灶的HER2检测结果等),实验室检查结果(血常规、血生化、尿常规),治疗方案等。
1.4 统计学处理
所有数据均使用SAS 9.4统计软件进行统计学分析。HER2的表达状态作为等级变量分为0、1+、2+/3+ 3组,纳入分析的变量均为二分类或多分类变量,组间比较采用Wilcoxon秩和检验。采用威尔逊置信区间算法估计各因素中HER2高表达率的95% CI。采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者资料和原发灶的HER2表达情况
本研究于8个中心共纳入1 054例患者,平均年龄为(66.8±10.5)岁,其中76.9%(n=811)为≥60岁的老年患者,以男性居多(n=827,78.4%,表2)。肿瘤部位以膀胱UC为主(n=807,76.6%),其余为上尿路UC (n=247,23.4%),上尿路UC中肾盂癌和输尿管癌所占比例相近(48.6%和51.4%)。少量患者 (n=50,4.7%)合并转移,这些患者的转移部位以淋巴结(58.3%)、骨转移(27.1%)、肺转移(20.8%)和肝转移(6.3%)为主。1 054例患者中共616例(58.4%)HER2呈高表达,242例(23%)HER2 IHC 1+,196例(18.6%)HER2零表达。绝大部分(n=1 021,96.9%)患者接受了手术治疗,7例(0.7%)患者接受了HER2-ADC药物治疗。
2.2 HER2表达与患者临床特征的关系
HER2高表达率在≥60岁的老年UC患者中为60.2%,而这一比例在非老年患者中为52.7%,差异虽无统计学意义,但较为接近于0.05的置信水平(P=0.097,表2)。不同性别的HER2高表达率无差异。在ECOG评分为0分的UC患者中,HER2高表达率为67.2%,高于其他ECOG评分的患者(P<0.001)。在合并心脑血管疾病的患者中,HER2高表达率为62.5%,高于无该病病史的患者(57.3%),差异有统计学意义(P=0.030)。在脂代谢异常的患者中,该比例为41.2%,低于脂代谢正常的患者(58.2%),差异有统计学意义 (P=0.006)。在吸烟的患者中,该比例为64.9%,高于不吸烟患者(56.2%),差异也有统计学意义(P=0.004)。
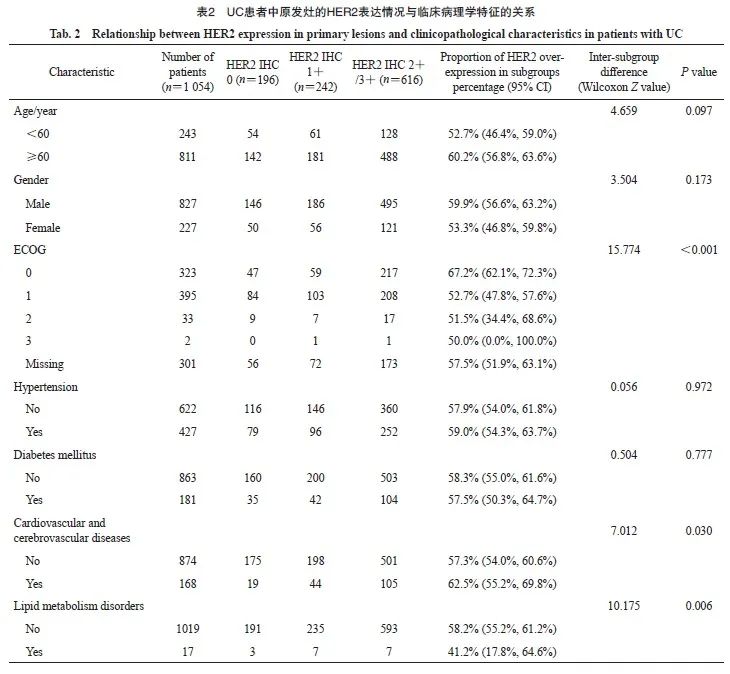
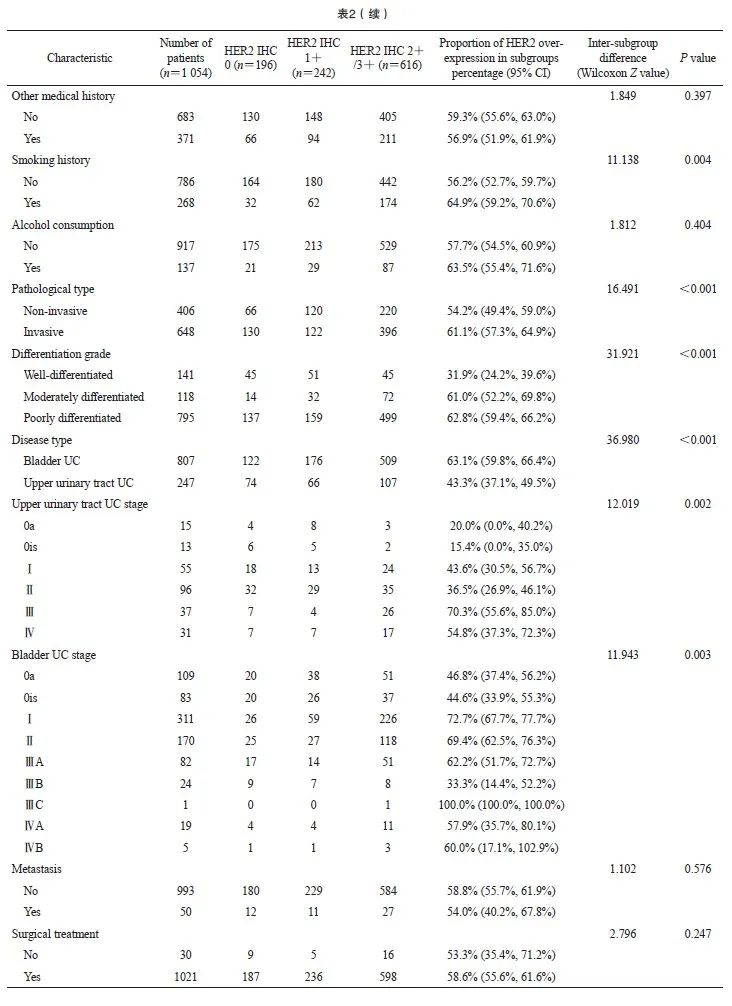
2.3 HER2表达与肿瘤病理学特征的关系
本研究涉及的病理学特征主要包括UC部位、分化程度、浸润性和分期4个方面,结果显示,这4个方面均与HER2的表达有关(图1、2):① 不同部位的UC的HER2高表达率差异有统计学意义(P<0.001),膀胱UC的HER2高表达率为63.1%(509/807),而上尿路UC的HER2高表达率为43.3%(107/247);② 不同分化程度的UC的HER2高表达率差异有统计学意义 (P<0.001),高分化UC中HER2高表达率较低,为31.9%(45/141),而中分化UC和低分化UC中HER2的高表达率分别为61.0%(72/118)和62.8%(499/795);③ 浸润性UC的HER2高表达率高于非浸润性UC,差异有统计学意义(61.1% vs 54.2%,P<0.001);④ 在上尿路UC和膀胱UC中,不同肿瘤分期的HER2高表达率差异均有统计学意义(P=0.002和0.003),随着疾病分期的进展,HER2高表达的比例也有升高的趋势。另外,原发灶的HER2表达率与是否存在远处转移无显著相关性(P>0.05)。
2.4 接受HER2-ADC药物治疗的患者基本情况
1 054例患者中,有7例接受了HER2-ADC药物治疗,7例患者均未发生转移,并且都接受了手术治疗(表3)。除1例患者的疾病分期无法判断以外,其余6例均为Ⅰ或Ⅱ期。多数患者(6/7)为HER2高表达,仅1例患者为低表达。
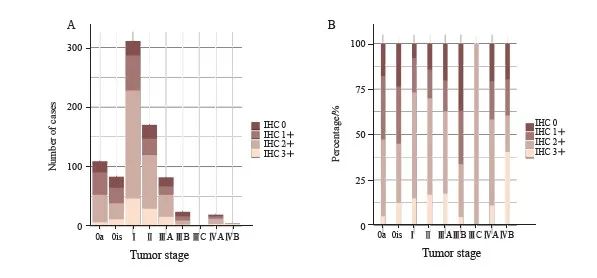
图1 膀胱UC在各肿瘤分期的原发灶HER2 IHC检测结果对应的人数(A)和百分比(B)的分布情况
Fig. 1 Distribution of number (A) and percentage (B) of HER2 IHC results of primary foci of bladder UC by tumor stage
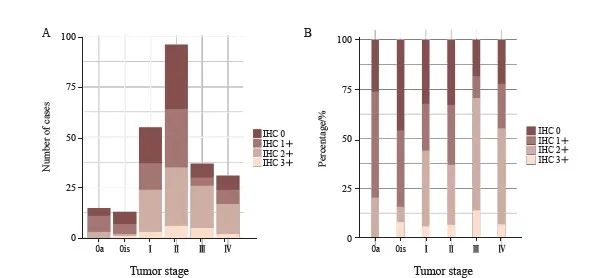
图2 上尿路UC在各肿瘤分期的原发灶HER2 IHC检测结果对应的人数(A)和百分比(B)的分布情况
Fig. 2 Distribution of number (A) and percentage (B) of HER2 IHC results of primary foci of upper urinary tract UC by tumor stage
3 讨 论
本研究是中国迄今最大规模的调查UC HER2表达情况的病例登记研究,根据8个医学中心的调查结果,有超过半数的患者(58.4%)存在HER2高表达,并且HER2高表达患者具有显著不同的临床病理学特征(如病变部位、病理学类型及分化程度等)。本研究发现病变部位发生在膀胱的UC的HER2高表达率高于上尿路(82.7% vs 17.4%),浸润性UC的HER2高表达率也高于非浸润性UC(64.3% vs 35.7%)。此外,在分化不良的UC中,HER2高表达率达81.0%,高于分化良好(7.3%)和分化中等(11.7%)的UC,上述差异均有统计学意义(P均<0.05)。
既往HER2低表达的UC缺乏有效的靶向药物,该人群容易被临床研究忽略。但近期有研究[11]表明,HER2-ADC药物在其他瘤种中能够为HER2低表达的患者带来临床获益,因此其在HER2低表达的UC患者中的疗效值得期待。早年国内团队研究[9,12]报道的UC的HER2总体阳性率为26.1%~32.0%,而国外研究[13-14]报道为6.7%~37.5%,均普遍低于本研究。在《中国尿路上皮癌人表皮生长因子受体2检测临床病理专家共识》[10]颁布之前缺乏统一规范的判读标准,因此既往研究多采用乳腺癌[15-16]或胃癌[17]的HER2检测指南作为判断UC的HER2表达情况的依据。由于HER2表达具有很高的异质性,这会导致在IHC判读过程中的困难和误差。随后有研究团队根据最新的专家共识诊断429例UC患者的HER2高表达率为45.7%[8],而近期也有研究[18-19]表明,在特定的患者群体(如高级别UC)中HER2高表达率可达44.0%~68.7%,这些数据都普遍高于既往早期研究。而本研究基于最新的诊断标准检测到的HER2高表达率同样较高(58.4%)。该数值与近期使用同样的HER2判读标准所报道的数值存在一些差异,提示不同地区UC分子流行病学研究可能存在异质性,此外也可能与纳入患者群体疾病特征的差异有关。目前已有的研究报道大多为几十例到几百例不等的小样本的区域性调查,而本研究是包含中国多个地区的大样本多中心研究,有超过半数的UC患者的原发灶HER2呈高表达状态,提示HER2高表达在UC中较为普遍,并且很可能是被既往研究所低估的。值得注意的是,也有相当一部分患者(23.1%)为HER2低表达。HER2-ADC的应用还有待推广,本研究纳入的病例中,仅有7例报告了HER2-ADC的使用,这可能与目前HER2-ADC适应证尚限制在UC二线及以后的治疗,而本研究中Ⅲ期及以上的患者总数较少(仅约60人) 有关。
在既往研究以及本研究中,都报道了UC的HER2表达与一些临床病理学特征之间的相关性,尤其是与肿瘤的分化程度、肿瘤分期等密切关联。膀胱UC的HER2高表达率明显比上尿路UC高,而恶性程度低(分化良好)的UC的HER2高表达率明显更低。既往研究也发现肿瘤分期越高的情况下HER2高表达的可能性有升高的趋势,但大多因样本量较小,该趋势尚不明确,本研究在更大样本量的条件下,进一步揭示了这一关系。本研究还发现浸润性与非浸润性UC的HER2高表达率有显著差异,这一点与既往的研究结果有所不同:既往报道中关于浸润性与HER2高表达的关联差异并无统计学意义,例如,基于中国最新的HER2临床病理学专家共识诊断标准的3篇报道[8,18-19]。与既往研究结果的差异可能是由既往研究的小样本量的局限性所致,因此本研究为更深入、全面地了解UC中HER2表达情况提供了更为翔实的数据,并为了解其相关的临床病理学特征提供了新的视角。
原发灶与转移灶HER2表达的异质性已经在其他瘤种(如乳腺癌)中有诸多证据支持,其不一致率可高达49.6%[20-21],而在UC中的相关数据较为有限,中国近期的几项研究对于原发灶和转移灶的HER2表达异质性并未深入阐述。同样,本研究中50例有转移的患者均未能获得转移灶的HER2结果,这可能与临床实践中转移灶活检样本获取难度较高有关,另一方面也提示应提高临床上对获取转移灶病理学结果重要性的认知。考虑到目前已有可用于靶向HER2的ADC药物,对于合并转移灶的UC患者,了解其转移灶HER2表达情况对于治疗决策也有非常重要的指导意义。因此,在今后的临床实践中,还需要进一步提高对转移灶活检重要性的认知和重视程度。
本研究仍存在一定局限性。首先,本研究虽纳入了多个医疗中心的患者,但未能实现中心实验室对HER2表达的统一检测;其次,也未对不同HER2表达水平的患者的疗效和预后进行分层评估。
综上所述,本多中心研究基于中国多个地区的大样本调查,发现UC有着较为普遍的、不同程度的HER2表达,HER2高表达率达58.4%,并且HER2表达与多种临床病理学特征有着一定关系。因此,充分了解UC的HER2表达情况对于指导个体化治疗是至关重要的,而HER2表达与患者预后的关系也有待在未来的长期随访研究中进一步阐明。
致谢:感谢王奇峰(复旦大学附属肿瘤医院病理科)、牛茜(兰州大学第二医院病理科)、袁静萍[武汉大学人民医院(湖北省人民医院)病理科]、张建波(河南省肿瘤医院病理科)、杨明(华中科技大学同济医学院附属协和医院病理科)、吴秀玲(温州医科大学附属第一医院病理科)、叶新青(广西医科大学附属肿瘤医院病理科)对本文提供的帮助。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
王珊珊:实施研究,采集数据,撰写与修改文章;
杨立,程帆,杨铁军,章小平,余志贤,张庆云,杨勇:参与患者入组,实施研究,采集 数据;
叶定伟:引导研究方向与课题设计。
[参考文献]
[1]SORIA F, SHARIAT S F, LERNER S P, et al. Epidemiology, diagnosis, preoperative evaluation and prognostic assessment of upper-tract urothelial carcinoma (UTUC)[J]. World J Urol, 2017, 35(3): 379-387.
[2]HE W, CHEN C H, LIN T X, et al. Epidemiology, treatments, and related biomarkers of locally advanced or metastatic urothelial carcinoma in Chinese population: a scoping review[J]. Cancer Med, 2023, 12(14): 15384-15403.
[3]GUPTA S, ANDREEV-DRAKHLIN A, FAJARDO O, et al. Platinum ineligibility and survival outcomes in patients with advanced urothelial carcinoma receiving first-line treatment[J]. J Natl Cancer Inst, 2024, 116(4): 547-554.
[4]ZINNALL U, WEYERER V, COMPÉRAT E, et al. Micropapillary urothelial carcinoma: evaluation of HER2 status and immunohistochemical characterization of the molecular subtype[J]. Hum Pathol, 2018, 80: 55-64.
[5]YOROZU T, SATO S, KIMURA T, et al. HER2 status in molecular subtypes of urothelial carcinoma of the renal pelvis and ureter[J]. Clin Genitourin Cancer, 2020, 18(4): e443-e449.
[6]WEN F, LIN T H, ZHANG P, et al. RC48-ADC combined with tislelizumab as neoadjuvant treatment in patients with HER2-positive locally advanced muscle-invasive urothelial bladder cancer: a multi-center phase Ib/II study (HOPE-03)[J]. Front Oncol, 2023, 13: 1233196.
[7] SHENG X N, YAN X Q, WANG L, et al. Open-label, multicenter, phase II study of RC48-ADC, a HER2-targeting antibody-drug conjugate, in patients with locally advanced or metastatic urothelial carcinoma[J]. Clin Cancer Res, 2021, 27(1): 43-51.
[8] 张孟尼, 龚 静, 陈雪芹, 等. 尿路上皮癌429例HER2表达情况及临床病理学分析[J]. 中华病理学杂志, 2023, 52(3): 243-249.
ZHANG M N, GONG J, CHEN X Q, et al. Expression of HER2 in 429 cases of urothelial carcinoma and clinicopathological analysis[J]. Chin J Pathol, 2023, 52(3): 243-249.
[9] 黎美仁, 路名芝, 郑美蓉, 等. HER2及CD44v6在膀胱尿路上皮癌中的表达及意义[J]. 中国老年学杂志, 2018, 38(19): 4641-4647.
LI M R, LU M Z, ZHENG M R, et al. Expression and significance of HER2 and CD44v6 in bladder urothelial carcinoma[J]. Chin J Gerontol, 2018, 38(19): 4641-4647.
[10] 中国抗癌协会肿瘤病理专业委员会, 中国临床肿瘤学会尿路上皮癌专家委员会. 中国尿路上皮癌人表皮生长因子受体2检测临床病理专家共识[J]. 中华肿瘤杂志, 2021, 43(10): 1001-1006.
Tumor Pathology Committee of Chinese Anti-Cancer Association, Expert Committee on Urothelial Carcinoma of Chinese Society of Clinical Oncology. Clinical pathological expert consensus on HER2 testing in urothelial carcinoma in China[J]. Chin J Oncol, 2021, 43(10): 1001-1006.
[11] WANG J Y, LIU Y J, ZHANG Q Y, et al. RC48-ADC, a HER2- targeting antibody-drug conjugate, in patients with HER2-positive and HER2-low expressing advanced or metastatic breast cancer: a pooled analysis of two studies[J]. J Clin Oncol, 2021, 39(15_suppl): 1022.
[12] 王 磊, 谢进东. HER2在膀胱尿路上皮癌中的表达及意义[J]. 右江医学, 2009, 37(4): 386-388.
WANG L, XIE J D. The expression and significance of HER2 in uroepithelium cell carcinoma of bladder[J]. Mod Chin Med, 2009, 37(4): 386-388.
[13] KHALIFA S E. Immunohistochemical expression of CD117/ KIT, HER2, and Erβ in schistosomal and non-schistosomal urothelial carcinoma of Egyptian patients[J]. Int Urol Nephrol, 2023, 55(10): 2473-2481.
[14] SCHERRER E, KANG A, BLOUDEK L M, et al. HER2 expression in urothelial carcinoma, a systematic literature review[J]. Front Oncol, 2022, 12: 1011885.
[15] 黎美仁, 郑美蓉, 周 燕, 等. 膀胱尿路上皮癌中HER2基因扩增及蛋白表达的意义[J]. 赣南医学院学报, 2015, 35(4): 514-517.
LI M R, ZHENG M R, ZHOU Y, et al. Gene amplification and protein expression of the human epidermal growth factor receptor 2 in urothelial carcinoma of bladder[J]. J Gannan Med Univ, 2015, 35(4): 514-517.
[16] 王婧婧, 吴 景, 尹恬恬, 等. HER2与膀胱尿路上皮癌临床病理分子分型的相关性[J]. 中山大学学报(医学科学版), 2020, 41(5): 758-766.
WANG J J, WU J, YIN T T, et al. Correlation of HER2 with clinicopathologic features and molecular subtypes of urothelial bladder carcinoma[J]. J Sun Yat Sen Univ Med Sci, 2020, 41(5): 758-766.
[17] 管建云, 李军扩. HER2在膀胱尿路上皮细胞癌组织中的表达及其临床意义[J]. 中国当代医药, 2014, 21(24): 13-15.
GUAN J Y, LI J K. The expression and clinical significance of HER2 in bladder urothelial cell carcinoma[J]. China Mod Med, 2014, 21(24): 13-15.
[18] ZHU K J, CHANG Y, ZHAO D L, et al. Expression of HER2 in high-grade urothelial carcinoma based on Chinese expert consensus and the clinical effects of disitamab vedotintislelizumab combination therapy in the treatment of advanced patients[J]. Front Pharmacol, 2024, 15: 1355081.
[19] ZHOU L, SHAO Z T, LIU Y Q, et al. HER2 expression associated with clinical characteristics and prognosis of urothelial carcinoma in a Chinese population[J]. Oncologist, 2023, 28(8): e617-e624.
[20] LIN M X, LUO T, JIN Y Z, et al. HER2-low heterogeneity between primary and paired recurrent/metastatic breast cancer: Implications in treatment and prognosis[J]. Cancer, 2024, 130(6): 851-862.
[21] ALMSTEDT K, KRAUTHAUSER L, KAPPENBERG F, et al. Discordance of HER2-low between primary tumors and matched distant metastases in breast cancer[J]. Cancers, 2023, 15(5): 1413.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#尿路上皮癌# #人表皮生长因子受体2#
3