《中药药源性肝损伤临床评价技术指导原则》发布,旨在科学保护中药产业
2018-06-21 佚名 中国中医
6月19日,国家药品监督管理局发布了《中药药源性肝损伤临床评价技术指导原则》,这是我国首个针对药品全生命周期(临床前、临床试验期间、上市后)的肝损伤进行风险识别和评估的指导文件。
随着《 “健康中国2030”规划纲要》和《中华人民共和国中医药法》的公布,中医药上升为国家战略。党的十九大报告明确指出,我国社会的主要矛盾转变为人民日益增长的美好生活需要和不平衡不充分的发展之间的矛盾。但是,中药安全性屡屡成为社会热点问题,越来越受到社会关注。2017年,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),中药相关配套文件和制度规范等亟需进一步调整。因此控制中药用药安全风险,科学保护中药产业,科学推动中药研发被提上议事日程。
由于中药物质基础和作用机制的复杂性、非临床安全性研究薄弱、临床不合理用药和药源性肝损伤的特异性诊断指标缺乏等因素导致中药药源性肝损伤具有较大的隐匿性,误诊率较高,中药药源性肝损伤的预测和防控面临极大难题。此外,我国的医药卫生保障条件存在一定的资源配备不平衡问题,大众对于中药的安全性防范意识较为薄弱,药品安全风险防控能力建设相对滞后。
因此,亟需建立一套符合中国国情和中药特点的药源性肝损伤风险评价与管理体系,以指导和帮助中药研发、审评、监管、使用相关人员,有效捕捉和识别中药药源性肝损伤风险信号,科学厘定患者肝损伤与中药之间的因果关系,系统评价相关中药的安全性及风险获益比,有针对性制定中药药源性肝损伤的风险控制措施,提高中药新药研发的成功率,实现中药产品全生命周期安全性风险管控,促进我国中医药产业健康持续发展。
二、起草背景和起草过程
药源性肝损伤是常见的药物严重不良反应之一,重者可致急性肝衰竭甚至死亡;药源性肝损伤也是国内外药物研发失败、增加警示和撤市的重要原因。目前,国内外药源性肝损伤的临床诊断和研究方法主要是针对临床诊断而研制,目标使用人群主要是临床医师,对于新药研发中的中药药源性肝损伤的临床评价均具有一定局限性,主要表现在由于中药组方和用药的复杂性,难以将每味药物单独评价打分,对因果关系评价关键证据的缺失(计0分)可能对评价结果带来重大偏倚,且/或难以根据分值的高低明确与诊断的正相关性,对于中药药源性肝损伤的因果关系评价的判断强度和可信度有待提高。
国内药源性肝损伤和中药安全性评价的专家学者围绕中药药源性肝损伤的临床评价开展了大量扎实可靠的研究工作,积累了卓为显着的成果,并形成了一支多学科交叉融合的专家团队,为本指导原则的编制提供了坚实的工作基础和专业的智囊团队。编制专家学术专长覆盖中药临床安全性评价、中西医肝病临床诊疗、中药药理毒理、中医基础理论、系统生物学等多个学科。
编制工作自2017年11月7日正式启动,先后召开现场讨论会5次、网络电话会议1次(见附表),完成讨论稿6份、征集意见稿1份,并于2018年3月16日开始网上公示。2018年4月27日召开指导原则定稿会,特邀张伯礼院士、陈香美院士等十多位医药行业专家、企业代表等对本指导原则进行集中审读、修改,历经6个月最终形成正式稿。
三、指导原则起草细节考量
(一)本指导原则与既往临床诊疗指南的差异
本指导原则针对药品全生命周期(临床前、临床试验期间、上市后)的肝损伤进行风险识别和评估,用于指导新药研制和临床使用过程中有效防控中药药源性肝损伤,供中药研发、生产、医疗和监管机构使用。而既往发布的临床诊疗指南主要用于指导临床应用中药发生肝损伤病例的诊断和治疗,主要面向的是医生,明确特定的损肝中药种类并非必需要求。
(二)突出中药特点
指导原则强调了中药药物因素的影响,包括中药材、中药饮片的来源、炮制和质量;强调了处方合理性,包括配伍、用量、用法、品规、调剂和方证相应等方面。
考虑到我国中药药源性肝损伤相关研究基础薄弱的现实问题,本指导原则鼓励结合系统毒理学、毒代动力学等研究手段,开展临床和实验室的再评价,进一步确证肝损伤风险信号和肝损伤类型,阐明易感病证、风险物质、作用机制及影响因素,从而为肝损伤风险防控提供更多的科学依据支撑,体现风险信号在新药研发过程中双向传递的指导思想。
(三)风险信号的概念和内涵
本指导原则以肝损伤风险信号作为串联药品全生命周期监管的具体抓手,目的是为了实现在中药新药研发的各个阶段早期发现、有效识别、客观评估肝损伤风险。因此,本指导原则所指的肝损伤风险信号是广义的风险信号或信息,包括但不同于药品上市后不良反应数据的风险信号。为此,在本指导原则第三部分“中药药源性肝损伤的主要风险因素”专门列述了中药药源性肝损伤的主要风险因素,并在第四部分“中药药源性肝损伤的相关风险信号及收集”专门列述了可作为中药药源性肝损伤风险信号的指标种类,以及中药药源性肝损伤风险信号的收集途径和方法,以期指导新药研发人员尽早全面系统地发现中药药源性肝损伤风险信号,及时采取风险防控措施,提高新药研发成功率。
(四)中药药源性肝损伤因果关系评估
中药药源性肝损伤因果关系评估是此次编制工作的重点及亮点。与临床诊断不同,在中药新药研发过程中,对疑似肝损伤的评价需要尽可能得到明确的因果关系结论,也即在明确诊断为药源性肝损伤的基础上,其目的不仅要甄别患者肝损伤是否由中药所致,而且还要甄别是否由所评估中药所致。国内外针对药物不良反应因果关系评价的方法大致可以分为三类:专家判断法、评分算法、概率法或贝叶斯法。其中针对药源性肝损伤的临床诊断,常用的方法有Roussel Uclaf评分法(RUCAM)和结构化专家意见流程法(SEOP)等。但这些方法对中药特点和复杂性的关注不多,对于中药药源性肝损伤因果关系评价还存在证据的客观性不足或易受评估者主观性影响的问题;而RUCAM和SEOP主要是针对临床医生诊断而不是针对新药研发设计的。为此,本指导原则在前期中华中医药学会《中草药相关肝损伤临床诊疗指南》的基础上,以中药新药研发和因果关系评价为主要导向,提出四步递进的因果关系判断过程即“肝损伤→药物→中药→具体中药”,将临床指标、用药史、药物鉴定、生物标志物、再激发等多方面的肝损伤风险信息进行串联整合,形成具有客观性和方向性的证据链条,进而根据可获取的证据链的可靠性程度,将因果关系可靠性分级分为“排除、疑似、可能、很可能、肯定”五级。此五级划分方式,与世界卫生组织(WHO)以及我国药监部门广泛采用的药品不良反应因果关系可靠性级别划分也是一致的,同时又提供了以客观证据链为依据的判断方式,避免了WHO方法作为专家判断法的主观性问题。该方法既参照了药源性肝损伤临床诊断的最新方法和规范,又参照了WHO和我国药物不良反应因果关系评价的基本原则和分级惯例,突出新药研发者和企业在因果关系评价中的主体作用和责任,兼顾科学性和可操作性。
(五)中药药源性肝损伤风险防控
针对中药上市前和上市后的特点及要求,本指导原则分别制定其风险控制措施,包括密切观察、调整治疗方案或停药、临床试验中止、修改说明书、限制流通和使用、药品撤市等,以实现中药安全性风险全生命周期监测与管控,保障受试者的安全。
四、本指导原则的特点
(一)坚持两个紧密结合
一是紧密结合中国新药研发与审评的实际情况。针对国内新药研发现状,尤其是研发者对于风险预测和评估能力的局限性,注重适用性,特别关注指导原则的可操作性,邀请工业界专家参与制修订工作。
二是紧密结合中药的复杂性和肝损伤发生的特点。中药自身的复杂性以及临床用药的复杂性,是中药临床肝损伤评价的突出特点,也是关键难点。采用整合证据链思想和方法,科学辨识肝损伤风险信号和中药的因果关系,提高中药临床肝损伤评价的准确性和可靠性,提高中药新药研发成功率。
(二)实现药品全生命周期的肝损伤评价与监管
立足上市前、辐射上市后,贯穿全生命周期,涵盖了风险信号的发现、中药药源性肝损伤因果关系的评估,以及严重程度的分级,并给予临床诊疗方案的支持。既鼓励药品研发者创新,同时践行药品监管“四个最严”要求,维护人民用药安全。
(三)建立中药药源性肝损伤风险信号的“双向传导”机制
既注重从临床前、到上市前、再到上市后评价阶段的肝损伤风险信号“正向”传导,指导新药研发进程;又注重从临床阶段发现的肝损伤风险信号的“反向”传导,开展实验室再评价研究,通过基础研究证据对所发现的肝损伤风险信号进行科学确认。中药药源性肝损伤风险信号的“双向传导”研究鼓励企业在中药新药研发过程中主动研究,提高中药临床安全性以及合理用药水平。
五、本指导原则与国内外可参考技术要求的异同
针对药源性肝损伤,国内外可参考技术要求或指南主要有中华医学会发布的《药物性肝损伤临床诊治指南》、中华中医药学会发布的《中草药相关肝损伤临床诊疗指南》、美国食品药品管理局(FDA)发布的《Guidance for Industry Drug-induced Liver Injury: Premarketing Clinical Evaluation》。本指导原则与这些技术要求或指南在研制目的和应用范畴(是否针对中药新药研发)、评价内容(风险信号、损害程度、因果关系、风险防控)、是否针对中药特点等方面存在差异(详见表1)。
总的来说,中华医学会发布的《药物性肝损伤临床诊治指南》和中华中医药学会发布的《中草药相关肝损伤临床诊疗指南》均是针对药源性肝损伤的临床诊断和治疗,其中后者针对中药药源性肝损伤的复杂性进行了侧重和改进,但这两个临床指南均不是为指导新药研发而研制的。美国FDA发布的《Guidance for Industry Drug-induced Liver Injury: Premarketing Clinical Evaluation》是针对指导新药研发而研制的,但该文件主要是针对上市前的肝损伤评价,且没有考虑中药药源性肝损伤的复杂性。而本指导原则是针对中药新药研发中的中药药源性肝损伤评价问题,以加强药品全生命周期风险管理为主要导向,旨在指导和帮助相关机构及人员有效捕捉和识别中药药源性肝损伤风险信号,科学评估患者肝损伤与中药的因果关系,“早期发现、早期干预、科学防控”,从而达到降低中药新药研发的失败率及临床使用风险的目的。本指导原则与国内外可参考技术要求或指南的异同点如下:
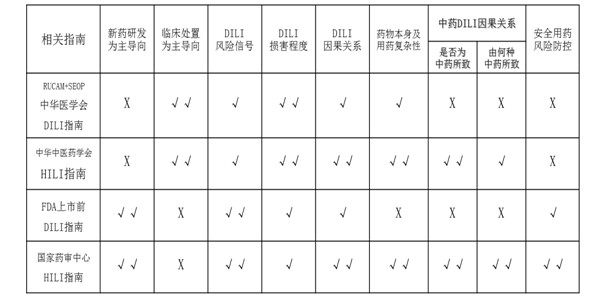
注:HILI,herb-induced liver injury。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#临床评价#
88
#肝损伤#
106
#损伤#
114
#评价#
93
#技术指导原则#
76