文献荐读|胡兴胜教授:放化疗期间动态监测循环肿瘤DNA对局部晚期非小细胞肺癌患者的预后预测分析
2024-02-20 医悦汇 医悦汇 发表于上海
该研究是目前探索ctDNA-MRD检测在接受根治性RT的NSCLC患者中应用价值的最大的前瞻性队列研究。
01 研究背景
目前,人们对使用循环肿瘤DNA (ctDNA)监测肺癌的分子残留病灶(MRD)越来越感兴趣。前期的研究表明,术后的纵向MRD检测的对预后的阳性和阴性预测值分别达89.1%和96.8%。因此,手术的非小细胞肺癌 (NSCLC)患者的MRD检测标准被进一步开发。和手术切除的全或无不同,根治性放疗(RT)是许多癌症的重要治疗方法,可诱导DNA损伤引发肿瘤细胞凋亡、坏死、衰老和有丝分裂障碍。与手术相比,RT时ctDNA-MRD检测存在不确定性:局限性NSCLC的根治性RT标准疗程常为6-7周,期间ctDNA的动态变化尚不清楚;且由于细胞死亡与放疗后肿瘤缩小存在延迟,是否会干扰MRD的监测尚不确定。
已有研究表明放化疗(CRT)后的ctDNA对接受根治性RT的局部晚期NSCLC患者具有预后预测价值,并可协助预测巩固免疫治疗的价值。然而,ctDNA在放化疗(CRT)期间对MRD检测的具体应用价值尚不清楚,不可切除的NSCLC组织活检采样有限,此时治疗前ctDNA的改变是否能可靠地预测MRD仍然未知。为了进一步探索ctDNA的作用,该研究对接受根治性RT的不可切除局部晚期NSCLC患者进行了ctDNA-MRD分析。
02 研究内容与结果
患者特征和基线ctDNA分析
研究共纳入139例不可手术切除的局部进展的NSCLC患者,其中IIB期患者6例, IIIA期患者38例,IIIB期患者76例,IIIC期患者19例。所有患者均接受根治性RT,其中82.7%接受同步CRT,15.1%接受序贯CRT,2.2%单独接受根治性RT,共58例患者在RT后接受了巩固性ICI或靶向治疗。该研究共收集并分析了患者治疗前、放疗前 (放疗第一天,95.7%)、放疗中(达40 Gy时)、放疗后(放疗最后一天)和随访过程中的761份血样:多数患者(90.1%)在基线时检测到ctDNA。最常见的基因突变是TP53(46.0%),其次是CSMD3(24.5%)、CDKN2A(12.9%)、LRP1B(12.9%)和ZNF536。
CRT过程中ctDNA的动态变化
在放疗前、放疗中和放疗后的时间点ctDNA阳性检出率分别为72.9%、52.6%和53.0%。共有57例基线时间点ctDNA阳性的患者接受了诱导化疗,只有7.0%的患者在放疗前ctDNA转为阴性。正如预期,ctDNA浓度随RT治疗进展呈下降趋势,可能反映了肿瘤负荷的减轻。然而与基线相比,这种趋势仅在放疗前和放疗后时间点具有显著性(P<0.001)。上述数据表明,放疗对CRT期间ctDNA的变化有更实质性的影响。(图1)

CRT期间ctDNA的早期变化
作者探索了放疗后MRD状态的预后预测价值,放疗后MRD阴性的患者比MRD阳性患者有更好的PFS。MRD阳性组中40.6%的患者接受了巩固性ICI治疗,其PFS优于未接受治疗者(p=0.013, HR=0.54)。相反,在MRD阴性的群体中是否接受巩固性ICI治疗的患者PFS间无显著差异(p=0.304, HR=0.69)(图2)。然而,放疗后ctDNA阴性的患者中近一半出现了疾病进展,这是由于仅基于放疗后单一时间点的ctDNA-MRD检测灵敏度不足。由于ctDNA浓度在放疗中就已经有显著下降趋势,作者推测在CRT中较早达到ctDNA阴性的患者可能有更好的预后。放疗中、后ctDNA检测为阴性的患者中72.1%的PFS优于ctDNA仅在放疗后转为阴性的患者(22.9月vs.10.3月,P<0.001),而ctDNA放疗前后均阴性的患者与放疗前阳性但放疗中、后转为阴性的患者生存率无显著差异(p=0.478;HR=0.68)(图3)。
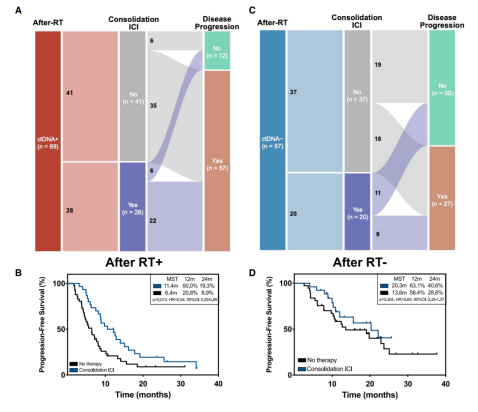
不同疾病进展模式的纵向MRD监测
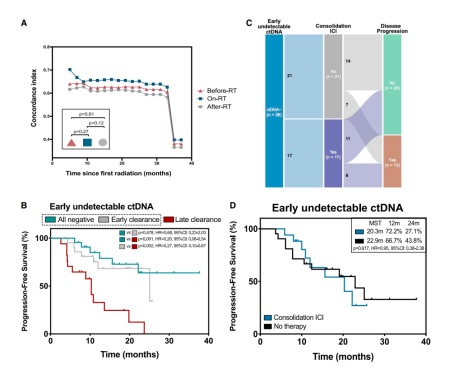
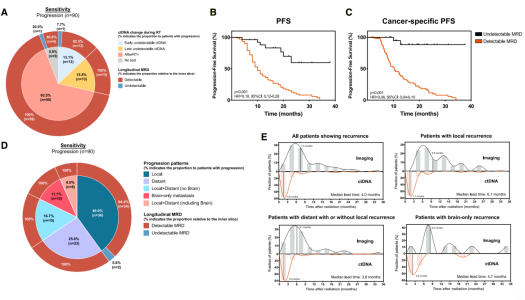
截至2022年7月31日,99名患者出现肿瘤进展或死亡,其中65.5%在CRT期间未达到ctDNA清除。在整合后续随访时间点进行纵向分析时,97.8%的病例至少一个时点ctDNA阳性。自 “放疗中”节点开始,20.1%的纵向MRD均阴性的患者的PFS优于MRD阳性的患者(p<0.001, HR= 0.18)。在排除非肿瘤性死因后,预后值预测价值也具有显著性(p<0.001, HR=0.06)。而纵向MRD均阴性的患者1年和2年PFS 分别达到94.7%和88.4%,这表明此类患者可对应潜在的治愈人群。
随后作者探索了纵向MRD监测对不同疾病进展模式的预测价值,在84.7%的患者中MRD的检测比影像学进展早4.0个月。放疗后第一次检测到MRD信号的中位时间为1.6月,与第一次随访时间点基本一致。有趣的是,局部复发的患者影像学复发和MRD阳性的高峰时间分别为9.6个月和1.7个月,中位提前时间为6.1个月,长于远处转移和脑转移灶复发患者的中位提前时间,这可能是因为放疗诱导的肺纤维化和病变进展难以辨别。(图4)
主编评语
该研究是目前探索ctDNA-MRD检测在接受根治性RT的NSCLC患者中应用价值的最大的前瞻性队列研究。该研究主要包含以下三点优势:
首先,作者确定了早期ctDNA在放疗时的预后价值,即早期对CRT有反应的患者预后更好,他们从巩固性免疫治疗中获益有限。虽然该研究队列的驱动基因和治疗方案存在异质性,但综合监测RT时和RT后不同时点的ctDNA水平可能为真实世界中局限期NSCLC患者提供更可靠的预后预测价值。
其次,研究发现多时点MRD检测可以区分潜在治愈的NSCLC患者群体。局部不可切除NSCLC的总体治疗方案具有高度异质性,包括同步或序贯CRT及是否联合免疫治疗或靶向治疗,该研究队列的患者治疗异质性高,具有真实世界代表性。既往研究表明约20%的患者在末次CRT后已经治愈,该研究中17.7%的患者无法检测到MRD,其中多数保持无进展状态,与潜在的治愈人群相对应。此外,该队列中9名患者(6.5%)死于根治性CRT相关并发症,与之前的临床研究结果相似。强化的多模式治疗在提高临床疗效的同时也增加了不良反应,因此我们应特别关注MRD的阴性预测值以避免不可切除的局限性NSCLC的过度治疗,特别是对早期存在ctDNA应答的患者。
最后,该研究表明治疗前ctDNA变异是一个必不可少的MRD信息来源。尽管治疗前ctDNA变异已被确认为MRD检测的方法之一,但尚无它在临床实践中的有效性证据。对于同时检测了组织和血液来源变异的患者,发现检测到的血液来源ctDNA突变显著高于组织来源突变,这可能是由于活检采样相对局限,不能代表整个肿瘤突变谱。对于仅有多时点血液来源MRD检测信息的患者,检测的敏感性、重复性和稳定性较好。因此,血液来源的信息对此类患者MRD的检测十分重要。
多时点MRD检测的总体灵敏度为97.8%。人们普遍认为血脑屏障导致外周血的ctDNA检测对脑转移无效,然而该队列中所有的10例仅有脑转移的患者均可检测到ctDNA信号。因为RT的常见并发症肺纤维化或肺炎可能导致局部疾病进展的准确诊断延迟,所以该研究中局部进展的患者ctDNA提前时间相对较长。因此,作者推测检测到的ctDNA信号来自影像学稳定的原发灶而不是脑转移灶。
该研究仍存一些局限性:放疗前后MRD状态对巩固治疗预测价值的亚组分析不能推翻目前标准治疗的“PACIFIC”模式;多时点MRD检测灵敏度达97.8%,但单次ctDNA检测的灵敏度不足,有待进一步解决;辐射诱导的肺损伤本身是否会增加ctDNA检测的背景噪声(如克隆性造血突变)有待进一步研究。
总之,该研究详细分析了接受根治性CRT的局部晚期NSCLC患者的ctDNA-MRD检测价值,发现了CRT期间ctDNA检测的独特价值,如血液来源ctDNA的早期反应对预后预测的有效性。此外,多时点MRD检测阴性的患者的预后良好,与潜在治愈人群相对应。然而由于ctDNA-MRD检测的灵敏度不足,依靠MRD的阴性预测值指导临床决策还有很长的路要走。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















好文章,值得一读。
42
#NSCLC# #ctDNA#
79